RNA干扰(RNAi)技术的原理和应用 |
您所在的位置:网站首页 › 简述ta克隆的原理和应用 › RNA干扰(RNAi)技术的原理和应用 |
RNA干扰(RNAi)技术的原理和应用
|
RNA干扰(RNAi)技术的原理和应用
2010-04-18 20:21 · Hebe
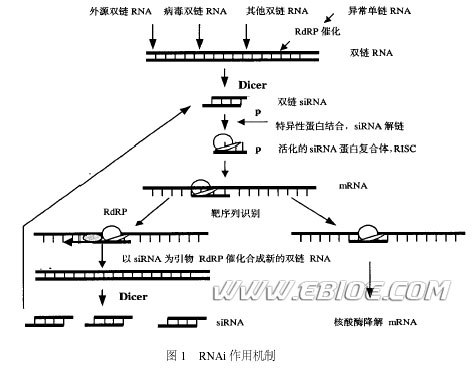
马鹏鹏 薛社普 韩代书 (中国医学科学院基础医学研究所, 中国协和医科大学基础医学院细胞生物学系, 北京100005) RNAi 是由双链RNA 所引起的序列特异性基因沉默。RNAi 首先由Fire 等发现于秀丽隐杆线虫(C. elegans) 中, 他们发现将dsRNA 注 马鹏鹏 薛社普 韩代书 (中国医学科学院基础医学研究所, 中国协和医科大学基础医学院细胞生物学系, 北京100005) RNAi 是由双链RNA 所引起的序列特异性基因沉默。RNAi 首先由Fire 等发现于秀丽隐杆线虫(C. elegans) 中, 他们发现将dsRNA 注入线虫体内后可抑制序列同源基因的表达, 并证实这种抑制主要作用于转录之后, 所以又称RNAi 为转录后基因沉默( postt ranscriptional gene silencing ,PTGS) 。随后人们陆续在果蝇(Drosophila) 、锥虫( Trypanosomes) 、涡虫( Planaria) 、斑马鱼( Zebrafish) 、拟南芥(Arabidopsis thaliana) 、大小鼠和人体内发现了RNAi 现象, 遗传学研究表明RNAi 是真核生物中一种普遍存在且非常保守的机制, 与真核细胞中许多重要生物学过程密切相通过对RNAi 现象的遗传学与生物化学研究,其作用机制已日渐清晰(见图1) 。Zamore 等利用果蝇胚胎提取物建立的体外系统, 证实RNAi 是一个依赖ATP 的过程, 在此过程中, dsRNA (外源的或体内产生的) 首先被降解为具5'2单磷酸、长21~23bp 的小分子双链RNA , 这种RNA 分子称为小干扰RNA , siRNA 通过碱基互补配对识别具同源序列的mRNA , 并介导其降解。研究表明在生物体中siRNA 具相似的结构特征: 为长约21~23bp 的双链RNA , 具5'单磷酸和3'羟基末端, 互补双链的3'端均有一个2~3nt 的单链突出。在RNAi 过程中一种称为Dicer 的核酸酶负责将dsRNA 转化为siRNA , 它属于RNase Ⅲ家族,具有两个催化结构域、一个解旋酶( helicase) 结构域和一个PAZ ( Piwi/ Argonaute/ Zwille ) 结构域, Dicer 在催化过程中以二聚体的形式出现, 其催化结构域在dsRNA 上反平行排列, 形成四个活性位点, 但只有两侧的两个位点有内切核酸酶活性, 这两个位点在相距约22bp 的距离切断dsRNA , 各种生物体内Dicer 结构略有不同, 致使siRNA 长度存在微小差别。siRNA 形成之后, 与一系列特异性蛋白结合形成siRNA 诱导干扰复合体( siRNA induced interference complex , RISC) ,
此复合物通过碱基互补配对识别靶mRNA 并使其降解, 从而导致特定基因沉默。在RISC 中, 起靶序列识别作用的是siRNA的反义链 , Zamore 等发现在RNAi 过程中,首先产生的是RISC 无活性前体, 分子量~250kD ,当加入ATP 后可形成100kD 的活性复合体。由无活性前体向活性酶复合物的转换类似蛋白酶原的激要求结合于其上的siRNA 双链的解开。在ATP 存在时, 依赖于ATP 的解旋酶解开siRNA 的双链并将其正义链与靶mRNA 置换, mRNA 取代正义链与反义链互补, 然后由活化的RISC 在互补区的中间, 距离siRNA 反义链3'末端约12bp 处切断靶mRNA 序列。RNAi 效应具有两个明显的特征, 特异性和高效性。干扰的高效性提示在机制中存在信号放大的步骤。Fire 等早在1998 年便发现少量的dsRNA就能够导致线虫大量的靶mRNA 降解, 但单凭少量dsRNA 被Dicer 降解为几十个siRNA 并不能解释这种高效性。许多研究显示RNAi 过程中有新的dsRNA 分子的合成, 当siRNA 反义链识别并结合靶mRNA 后, siRNA 反义链可作为引物, 以靶mRNA 为模板在依赖于RNA 的RNA 聚合酶(RNA2dependent RNA polymerase , RdRP) 催化下合成新的dsRNA , 然后由Dicer 切割产生新的siRNA , 新siRNA 再去识别新一组mRNA , 又产生新的siRNA , 经过若干次合成切割循环, 沉默信号就会不断放大(图1) 。正是这种称为靶序列指导的扩增( target2directed amplification) 机制赋予了RNAi 的高效性和持久性。
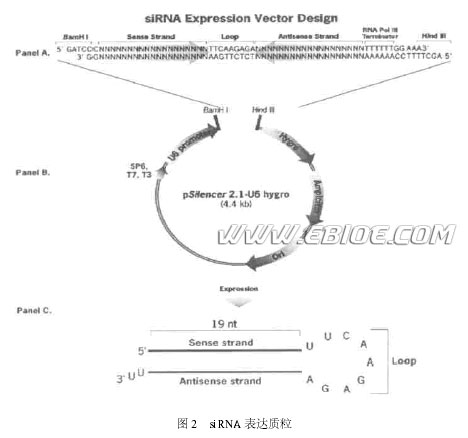
此外许多研究还显示RNAi 信号可以越过胞间屏障向其他细胞和组织扩散, 在植物中, RNAi 信号可以通过两种途径在细胞间传递: ①短距离的相邻细胞之间的传递, 植物细胞之间有着非常丰富的连接---胞间连丝, 沉默信号(如siRNA 分子)可以通过胞间连丝在细胞间传递; ②沉默信号还可以通过植物里纵横交错的脉管系统进行长距离的传送。而在动物中, RNAi 信号的扩散需要特殊的蛋白参与, 最近Hunter 等在线虫中鉴定出了一种与沉默信号传播相关的蛋白, 它是由sid21 基因编码的一种跨膜蛋白, 能在膜上形成跨膜通道供沉默信号通过, SID21 蛋白同源物在果蝇中不存在, 但有研究表明在哺乳动物中存在SID21 蛋白同源物。 2.RNAi 机制相关基因和酶 生命过程中的RNAi 现象受多种基因和酶的调节。通过对链孢酶(N. crassa) 、网柱原虫(Dictoyostelium) 、果蝇、线虫、拟南芥等的研究, 人们对与RNAi 相关的基因和酶有了一定的了解。在链孢酶中, qde21 基因编码的QDE21 蛋白是RdRP 的同源物 , qde22 基因编码Argonaute 家族的一个成员。在网柱原虫中发现了3 个RdRP的同源物, 其中两个由rrpA 和rrpB 基因编码, 但只有rrpA 编码的酶参与RNAi 过程。在线虫中已鉴定出至少有六个基因( rde21 ,rde22 , rde23 , rde24 , mut27 , ego21) 与RNAi 过程相关, 这些基因突变可导致RNAi 现象缺失(RNAi deficient) , 其中RDE21 蛋白与链孢酶中的QDE22 以及植物中的AGO21 同源, 同属于Argonaute 家族。mut27 编码一种具有3' →5'外切核酸酶活性的蛋白, ego21 基因编码RdRP 同源物,如果发生突变将造成某些胚系(germline) 基因沉默解除, 最终导致胚系发育缺陷, 这也表明RNAi机制与发育存在一定关系。另外研究者还发现smg22 、smg25 、smg26 基因与RNAi 效应的维持相关, smg22 编码一种依赖于ATP 的RNA 解旋酶,可能参与RNAi 过程中siRNA 双链的解开。在拟南芥中, sde23 基因编码一个与线虫SMG22 相似的RNA 解旋酶, 参与PTGS 过程,而sde21 编码蛋白介导转入基因的沉默, 与PTGS无关。除上述基因之外, 还有一些重要的基因产物也参与RNAi 过程, 如线虫中编码Dicer 酶的dcr21 基因, Dicer 在RNAi 起始阶段负责将长的dsRNA切割为siRNA , 对RNAi 过程至关重要。虽然目前已经发现了与RNAi 机制相关的几十个基因, 但RNAi 是一个极为复杂的生物学过程, 一定会有更多参与RNAi 过程的基因和酶被逐步发现。 3.RNAi 的生物学功能 RNAi 机制依赖于siRNA 反义链与靶序列之间严格的碱基配对, 所以具有很强的特异性, 研究表明RNAi 机制除了参与转录后对mRNA 的稳定性调节(即转录后基因沉默) 之外, 还与其他重要的生物学过程有关。 3.1 通过组蛋白甲基化影响染色质结构 最近, Volpe等利用裂殖酵母(S. pombe) ,发现整合入着丝粒区的转基因表达总被抑制, 他们称此现象为"着丝粒沉默" (cent romeric silencing) , 随后发现着丝粒沉默是由于此区域核小体组蛋白H3 的Lys29 甲基化后引起染色质凝集所致,并证明与RNAi 相关的基因突变可使组蛋白H3 甲基化消失, 同时使着丝粒沉默现象消除。由此可知, 至少在裂殖酵母中, RNAi 机制可通过组蛋白甲基化改变染色质结构造成着丝粒区域基因沉默。与此同时Bartel等从裂殖酵母中分离出了一种与着丝粒区序列同源的小RNA 分子, 将其命名为异染色质siRNA , 并推测"着丝粒沉默"是由siRNA造成的序列同源区组蛋白甲基化所致, 即在着丝粒区域, DNA 一条链连续表达, 而另一条链间断表达, 两条链的转录本互补形成dsRNA , 然后通过RNAi 机制形成siRNA , siRNA 引导甲基转移酶到序列同源的着丝粒区, 使组蛋白甲基化, 最终导致染色质结构改变, 从而调节基因活性。 3.2 通过DNA 甲基化在转录水平调节基因表达 对 RNAi 相关基因突变体的研究表明RNAi 机制参与细胞编码基因正常转录的调控 , 生物体内三种基因沉默机制---DNA 甲基化、协同抑制和转座子沉默均与RNAi 有关。Wessenegger等1994 年在植物中发现染色体DNA 甲基化依赖于RNA 复制, 即依赖于双链RNA 的存在。随后Wessenegger 与Pelissier又证实病毒在细胞内复制所形成的双链RNA 可使宿主染色体上长约30bp 的同源序列甲基化, 并发现只要存在序列同源性, 双链RNA 即可使基因发生甲基化。DNA 甲基化后, 基因就会失去转录活性, 不再起始转录,导致特定基因沉默。而且这种甲基化状态可以传给子代, 使该基因在子代中表达仍然受到抑制。协同抑制现象指转入的基因可导致细胞内同源基因沉默, PalBhadra 等证实在果蝇中协同抑制是由于Polycomb 复合体结合到内源基因上所致, Polycomb 由siRNA 引导并结合到同源序列附近, 使染色质处于非活性状态, 抑制其起始转录。另外Sijen 等发现在矮牵牛( Petunia) 中若转入基因产生的dsRNA 与靶基因的启动子同源则会导致转录水平基因沉默( t ranscriptional gene silencing ,TGS) , 若与编码区同源则会导致转录后基因沉默(PTGS) , 而且还发现TGS 和PTGS 过程中都有小分子RNA 产生, 并且两个过程均伴随靶序列的DNA 甲基化, 最终都可导致基因沉默。 3.3 在翻译水平调节机体发育 对动植物中RNAi 相关基因突变体的研究表明RNAi 机制与生物发育过程相关, 其作用机理是RNAi 机制的某些组分通过与PTGS 彼此分离但又密切相关的过程参与对发育过程的调控。Ketting等发现单个Dicer 基因dcr21 发生突变的线虫,除了RNAi 机制缺失外, 还产生了一系列表型改变。并且dcr21 突变体表现出的发育时序的改变与let27 和lin24 突变体相似, 而let27 和lin24 编码小分子RNA , 在体内首先合成~70nt 长的RNA 前体, 然后在Dicer 作用下生成~ 22nt 的小分子RNA , 称为小分子瞬时RNA ( small temporalRNA , stRNA) , 这些小RNA 在线虫的发育过程中参与对mRNA 翻译的调节, 是特定基因的负调控因子, 但并不介导mRNA 的降解, 而是结合于mRNA3'非翻译区, 阻止核糖体与mRNA 有效结合, 从而抑制翻译的进行。stRNA 和siRNA 关系密切, 除了都由Dicer 加工成熟之外, RNAi 必需的Argonaute (alg21 , alg22) 家族基因也为两种RNA 行使生物功能所必需。研究者认为在RNAi 过程中形成的RISC 复合物既含有siRNA 又含有stRNA , 此复合物可根据不同情况产生不同效应, 它可利用siRNA 与靶mRNA 互补介导mRNA 降解, 但若siRNA 与靶序列不能严格配对(如有单个碱基错配) , 则PTGS 即无法进行, 此时复合物又可转而利用stRNA 抑制核糖体在mRNA 上延伸从而在翻译水平阻断基因表达, 此模型中RISC 作为一个平台, 不同情况下可以募集不同的组件在其上装配, 从而行使不同的功能, 但最终均导致特定基因沉默, 最近Sharp等证实在哺乳动物培养组织中, siRNA 确实可通过与mRNA3′端非翻译区结合而抑制翻译的进行。 3.4 作为基因组的免疫系统 所有的复杂生物的基因组在长期的进化过程中均面临着病毒等外来核酸序列的侵入, 如人类基因组约有54 %的序列含有这种入侵留下的遗迹。那么生物怎样才能使自己的基因组免受外来核酸分子侵袭, 保持结构完整呢? 研究表明RNAi 机制在真核细胞中起着类似动物免疫系统的作用, 充当基因组的防护者。在植物中, RNAi 导致的PTGS 和VIGS 是保护基因组免受病毒入侵的重要机制, 在动物中也存在类似的机制。除了可以抵御外来病毒入侵外, RNAi 还可以控制基因组自身的寄生物---转座因子的活动, 在许多生物中, RNAi 机制通过使转座因子或重复序列区域异染色质化, 大大抑制了转座子和重复序列之间的同源重组对基因组可能造成的破坏。正是由于RNAi 机制的存在, 才使生物基因组在长期的进化过程中能够保持结构的完整性和遗传的连续性。综上所述, 可见RNAi 机制在真核生物生命活动中处于极为重要的地位, 可以把它看作是一个以小分子RNA 为核心的由多种组分构成的真核基因表达调控体系。它可以在转录水平、转录后水平和翻译水平调节基因表达, 并与细胞众多生物学过程密切相关。 4 RNAi 技术的应用 虽然对 RNAi 的研究只有短短几年时间, 但RNAi 技术已经快速被应用于多个领域。 4.1 基因功能研究 随着人类基因组计划的提前完成, 科学家急需一种新的、快速的方法解读基因的功能和基因的表达机制以及基因之间的相互关系。而RNAi 技术已成为解决这些问题的重要手段。与其他方法相比,RNAi 技术在基因功能研究上有其独特的优点:①简单易行, 容易开展; ②与基因敲除( geneknockout) 相比实验周期短, 成本低; ③与反义技术相比具有高度特异性和高效性; ④可进行高通量(high throughout) 基因功能分析。RNAi 技术的诸多优点使它很快便被作为研究基因功能的主要方法, 如Harbth 等应用RNAi 技术发现有13 个基因对哺乳动物培养细胞的生长和分化必不可少。最近Maeda 等利用高通量RNAi 技术对线虫的大约10000 多个基因进行了功能分析, 取得了理想的效果。总之, 随着后基因组学时代的到来,RNAi 技术将会成为功能基因组学研究的主要方法。 412 临床应用 前已述及, RNAi 机制可作为真核生物的基因组免疫系统, 抑制外源和内源有害基因的表达。人类目前对病毒(如HIV) 所致疾病缺乏理想的治疗方法, 如果利用RNAi 技术把与病毒基因具同源性的siRNA 引入感染细胞将会抑制病毒的增殖,这为病毒相关疾病的治疗提供了新的思路, 最近Song等利用RNAi 技术在病毒性肝炎的治疗方面取得了很好的效果。另外, 利用RNAi 技术还可以高效、特异、快速的抑制细胞内癌基因的表达,人类的许多癌症是由于少数癌基因超表达导致细胞过度增殖所致, 如果利用RNAi 技术抑制过度表达的癌基因将会使癌症表型逆转或病程得以控制。Yin 等利用人类皮肤癌细胞作为模型, 将一组与癌基因具同源性的siRNA 引入人黑素瘤细胞,结果发现癌细胞的异常增殖被显著抑制。最近Brummelkamp 等开发的一种质粒系统(pSUPER) 可以使siRNA 在哺乳动物细胞内长时间稳定表达, 这为抗癌药物开发和应用开辟了新的途径。可以预测, RNAi 技术将会很快应用于癌症和病毒疾病的治疗, 并可能会为这些疾病治疗带来突破。 5 RNAi 技术要点 5.1 siRNA 的设计 以前人们一般应用较长的dsRNA 作为基因沉默的工具, 但后来发现长链dsRNA 特异性较差。它可激活RNaseL 导致非特异性RNA 降解, 还能激活依赖于dsRNA 的蛋白激酶R (protein kinaseR , PKR) , PKR 可磷酸化翻译起始因子e IF2a 并使其失活, 从而抑制翻译起始。后来人们发现小于30bp 的dsRNA 就可以有效引起基因沉默,并且不会产生非特异抑制现象, 进一步研究表明抑制作用最强的是长21bp 、3'端有两个碱基突出的siRNA。但RNAi 技术要求siRNA 反义链与靶基因序列之间严格的碱基配对, 单个碱基错配就会大大降低沉默效应, 而且siRNA 还可以造成与其具同源性的其它基因沉默(也叫交叉沉默) , 所以在siRNA 的设计中序列问题是至关重要的。要求所设计的siRNA 只能与靶基因具高度同源性而尽可能少的与其他基因同源。设计siRNA 序列应注意以下几点: ①从靶基因转录本起始密码子AU G 开始, 向下游寻找AA 双核苷酸序列, 将此双核苷酸序列和其下游相邻19 个核苷酸作为siRNA 序列设计模板; ②每个基因选择4~5 个siRNA 序列, 然后运用生物信息学方法进行同源性比较, 剔除与其他基因有同源性的序列, 选出一个特异性最强的siRNA; ③尽量不要以mRNA 的5'端和3'端非翻译区及起始密码子附近序列作为设计siRNA的模板, 因为这些区域有许多调节蛋白结合位点(如翻译起始复合物) , 调节蛋白会与RISC 竞争结合靶序列, 降低siRNA 的基因沉默效应。 5.2 siRNA 的合成 目前获得siRNA 主要有三种方法, 化学合成、体外酶法合成和体内转录。 5.2.1 化学合成 siRNA 可以直接进行化学合成, 方便且不受碱基限制, 但合成一个siRNA 需先分别合成两条单链(每条链合成需20 步反应, 每步反应产物均需纯化) , 然后再退火成双链RNA , 合成耗时长且费用很高。 5.2.2 体外酶法合成 与化学合成相比体外酶法合成要经济得多, 此法需首先合成两段29nt 的DNA , 包括8 个与T7启动子3'端互补的碱基(称为引导序列, leadersequence) 和由21 个碱基构成的siRNA 编码序列。将这两段DNA 分别和T7 启动子混合, T7 启动子和DNA 引导序列退火结合, 然后用DNA 聚合酶Klenow 大片断补齐成为可用于转录的双链DNA 模板, 分别用T7 RNA 聚合酶进行体外转录, 再将产物混合形成dsRNA。新的双链RNA 包含5'端单链的引导序列和中间互补的19 个碱基序列以及3'端两个重复的U (UU) , 以DNA 酶降解模板,同时用单链专一的核糖核酸酶(RNase) 消化5'的引导序列, 由于RNase 不能切开U 碱基也不能降解双链RNA , 所以得到的产物就是所需的21bp的双链siRNA ---有19 对碱基互补, 3'端各有2个U 突出。用酶法合成的siRNA 比化学合成的同序列siRNA 活性高20倍, 估计可能是由于siRNA 纯度的差异造成的结果。 5.2.3 体内转录 最近有几个研究小组构建了一些可以在真核细胞内表达siRNA 的载体, 包括被广泛应用的质粒载体和新研发的转染效率较高的病毒载体。质粒载体都包含有一个RNA 聚合酶Ⅲ( PolⅢ) 启动子和一个4~5 个连续的T 构成的转录终止位点以及选择标记, 选用Pol Ⅲ启动子是因为此启动子总是在距其一定距离的位置起始转录, 而遇到4~5 个连续的T 就终止转录, 并且终止于转录终止位点第二个碱基处, 十分精确。此法需首先化学合成一段编码siRNA 正义和反义链的模板, 正义与反义序列之间由一段环(loop) 序列隔开(图2A) , 插入载体Pol Ⅲ启动子下游, 然后转入细胞,环序列可使转录出的RNA 链折叠成具发夹结构的小RNA 分子(图2C) , 这些小RNA 可被细胞内的Dicer 切割为长21bp 的siRNA ---有19 对互补碱基, 3'端各有2 个U 突出, 可引起特定基因沉默。与化学合成及体外酶法合成相比, 表达载体是在细胞内通过转录持续产生siRNA , 所以可延长siRNA 作用时间, 目前此法已被广泛应用。
5.3 siRNA 导入细胞的方法 在体外(in vit ro) 可用不同的方法将siRNA导入靶细胞, 一般来讲化学合成和体外酶法合成的siRNA 可用电转移(elect roporation) 、微注射和转染的方法引入细胞。而表达质粒则常通过转染的方法导入靶细胞然后再表达siRNA。向体内(in vivo) 导入siRNA 的研究工作也已有报道, 如有研究者用静脉注射的方法将合成的siRNA 引入动物体内进行基因功能的研究。但这些方法所产生的抑制效应都是很短暂的, 一般有效期只有一周左右。最近Abbas等利用改造后的病毒载体转染哺乳动物细胞, 发现在细胞内的抑制效应可持续25 天左右, 进一步促进了RNAi 技术的应用。 6. 结语 虽然人们对RNAi 的研究只有短短的几年时间, 但进展却极为迅速。这种奇特的生物学现象使人们不得不对RNA 在生命活动中的作用进行重新认识。可以认为RNAi 是一个以小分子RNA 为中心的真核细胞基因表达调控系统, 它可以在多个层面调节基因表达和细胞的增殖分化, 通过对RNAi的研究将会使人们对生命现象的认识更加深入。同时, RNAi 技术为人们更迅速、更准确的剖析基因的功能, 分析基因之间错综复杂的联系和相互作用提供了极为有用的工具。而且它还为人们预防和治疗癌症和病毒疾病提供了新的思路, RNAi 技术必将为生命科学研究和临床治疗带来新的革命。 关键词: 阅读原文 分享到:  织梦二维码生成器
相关新闻
织梦二维码生成器
相关新闻
 国产高通量基因测序仪获
2023-09-07
国产高通量基因测序仪获
2023-09-07
 肠道“塞车”不容忽视 科
2023-09-05
肠道“塞车”不容忽视 科
2023-09-05
 唯择®(阿贝西利片)扩展
2023-09-05
唯择®(阿贝西利片)扩展
2023-09-05
 首款尿液宫颈癌HPV筛查产
2023-09-04
首款尿液宫颈癌HPV筛查产
2023-09-04
 昌平生命谷产业基地园区
2023-09-01
昌平生命谷产业基地园区
2023-09-01
|
【本文地址】
今日新闻 |
推荐新闻 |