乙炔(C2H2)是生产聚氯乙烯的重要原料.用电石(主要成分为CaC2)与水反应可制取乙炔.最终还可得到电石渣.某电石渣中含氢氧化钙92.5%.其余为杂质.此电石渣可用于处理电镀厂排出的酸性废水. (1)乙炔中碳.氢元素的质量比为 . (2)100kg上述电石渣中氢氧化钙的质量为 kg. (3)用上述电石渣处理含硫酸196 kg的酸性废水(假设电石渣中 题目和参考答案――青夏教育精英家教网―― |
您所在的位置:网站首页 › 用电石制备乙炔时,所得到的乙炔可能含哪些杂质 › 乙炔(C2H2)是生产聚氯乙烯的重要原料.用电石(主要成分为CaC2)与水反应可制取乙炔.最终还可得到电石渣.某电石渣中含氢氧化钙92.5%.其余为杂质.此电石渣可用于处理电镀厂排出的酸性废水. (1)乙炔中碳.氢元素的质量比为 . (2)100kg上述电石渣中氢氧化钙的质量为 kg. (3)用上述电石渣处理含硫酸196 kg的酸性废水(假设电石渣中 题目和参考答案――青夏教育精英家教网―― |
乙炔(C2H2)是生产聚氯乙烯的重要原料.用电石(主要成分为CaC2)与水反应可制取乙炔.最终还可得到电石渣.某电石渣中含氢氧化钙92.5%.其余为杂质.此电石渣可用于处理电镀厂排出的酸性废水. (1)乙炔中碳.氢元素的质量比为 . (2)100kg上述电石渣中氢氧化钙的质量为 kg. (3)用上述电石渣处理含硫酸196 kg的酸性废水(假设电石渣中 题目和参考答案――青夏教育精英家教网――
|
如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器).试根据题目要求,回答下列问题:
Ⅰ.氯酸钾(KClO3)固体在二氧化锰做催化剂并加热的条件下,能较快的分解为氯化钾和氧气。小刚同学欲在实验室中以此方法制备并收集干燥的氧气。 (1)所选仪器的连接顺序为 (填写仪器序号字母)。 (2)用氯酸钾制备氧气所发生的化学方程式为 。 Ⅱ.小强同学欲用锌和稀硫酸反应制取氢气,然后利用氢气测定某氧化铁样品中含Fe2O3的质量分数(假设杂质不会挥发,也不发生反应)。仪器的连接顺序为:A→D1→C→D2→D3。(其中D1、D2、D3为三个浓硫酸洗气瓶) (3)D1的作用是 (4)小强欲通过测量反应前后D2浓硫酸洗气瓶 ①若装置中不连接D1,则测算结果将 。 ②实验开始时,小强在没有加热之前就通了一会氢气,则测算结果将 。 (5)若测得洗气瓶D2的质量增加m g,则C处大玻璃管内的物质总质量应该减少 g(计算结果可为分数形式)。 |
【本文地址】
今日新闻 |
推荐新闻 |
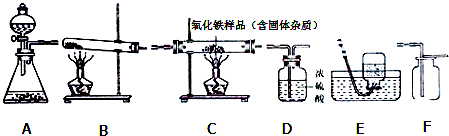
 的质量变化,测算氧化铁样品中含有Fe2O3的质量分数。试验中,在其他操作正常的条件下,若下列情况出现,请你对测算出的结果与实际值相比较,并作出判断(用“偏小”“偏大”“不受影响”之一填写下列空白)。
的质量变化,测算氧化铁样品中含有Fe2O3的质量分数。试验中,在其他操作正常的条件下,若下列情况出现,请你对测算出的结果与实际值相比较,并作出判断(用“偏小”“偏大”“不受影响”之一填写下列空白)。