指南与共识 |
您所在的位置:网站首页 › icd植入指征2022 › 指南与共识 |
指南与共识
|
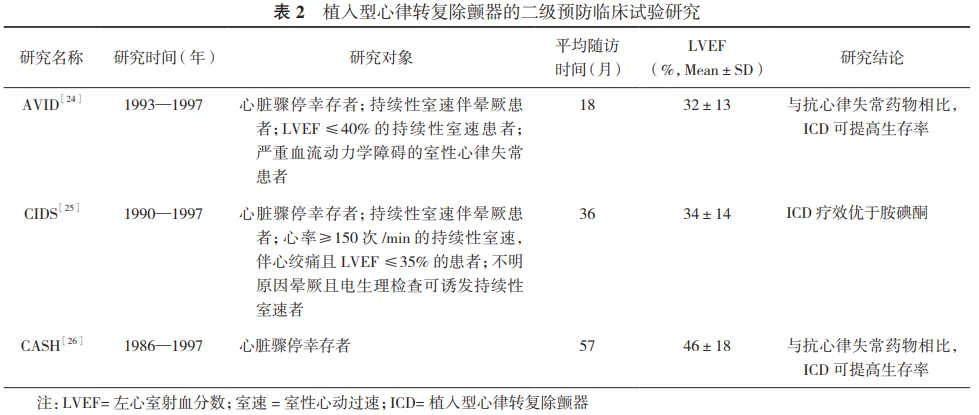
B级证据又分为:B-R级(randomized,随机),来自一项或以上中等质量的RCT证据;中等质量RCT的荟萃分析;B-NR级(nonrandomized,非随机),来自一项或以上设计及执行良好的非随机、观察性或注册研究或上述研究的荟萃分析。 C级证据又分为:C-LD级(limited data,有限数据),设计或执行有局限的随机或非随机观察性或注册研究或上述研究的荟萃分析,对人类受试者的生理或机制研究;C-EO级(expert opinion,专家意见),基于临床专家经验的共识。 二、心脏性猝死的流行病学 SCD是一种较为常见的临床和社会公共问题。有数据显示全球每年SCD发生大概为370万 [11] ,但实际上许多国家的SCD数据并不清楚,不同地域报道的SCD的发生率各不相同 [12] 。 心血管疾病流行病学及人群研究的方法是在20世纪40年代至50年代由Dawber等在弗莱明翰心脏研究(Framingham Heart Study)和Keys等在7国研究(Seven Countries Study)中建立起来的 [13] 。但这些回顾性的数据评估是基于默认院外死亡是SCD大致推断的。该方法对认定SCD的敏感性好,但缺乏特异性,故而会高估SCD发病率。相反,因SCD的时间定义是从症状出现后1 h内,而严格的时间限定标准又可导致SCD病例数丢失,加上可能会排除了许多无见证人的SCD病例,故SCD的发生率又有可能被低估。因此,不同的数据来源、SCD定义以及病例估算及诊断方法的差异,导致了不同研究中SCD的发病率范围跨度较大。 来自美国1998年的人口动态统计数据显示:黑种人、白种人、美国印第安人/阿拉斯加土著人以及亚洲/太平洋岛民的年SCD发生率分别是0.05%、0.041%、0.026%和0.021% [14] 。因此,SCD的发生率存在明显的人种差异。现将主要国家/地区报道的SCD数据汇总(表1),以便我们对全球主要地区的SCD流行病学状况有个较为全面的了解。 我们国家SCD的流行病学数据主要源自于2009年的研究报道 [3] 。该项目采用人群监测的方法,从我国4个地区(北京、广东、新疆和山西)选择了共67.8万人,监测时间从2005年7月1日至2006年6月30日。SCD发生率约为0.042%。以13亿人口计算,我国每年约有54.4万人发生SCD,发生率虽然低于美国,但考虑人口基数,SCD总人数位居全球各国之首。 心肌病、遗传性心律失常病、冠状动脉起源异常等是35岁以下青少年SCD的主要病因,而冠心病、心肌病则是35岁以上成人SCD的最主要病因。在血运重建的时代,虽然急性心肌梗死(AMI)后SCD的发生率有所降低,但其占全因死亡率的构成比仍然高达24%~40%,依然是AMI后最常见的死因 [15] 。一项来自德国和芬兰的研究证实:血运重建能降低AMI患者SCD风险,在所有优化治疗方案中,血运重建对降低SCD的贡献最大 [16] 。但CREDO-Kyoto注册研究则显示在裸金属支架时代,血运重建的方式[经皮冠状动脉介入术/冠状动脉旁路移植术(PCI/CABG)]对于SCD的发生率没有影响 [17] 。来自丹麦的一项研究纳入了2 804例行直接PCI的患者,平均随访4.7年 [18] 。在院外死亡原因中,SCD位居第一,超过其他所有心源性死亡的总和。而STICH研究中,接受CABG完全血运重建的缺血性心力衰竭(心衰)患者5年SCD累计发生率为8.5% [19] 。由此可见,即便进行了完全血运重建,缺血性心脏病患者仍有较高的SCD发生率,因此,冠心病患者SCD的防治工作仍充满挑战。 三、植入型心律转复除颤器的发展历程 目前,用于临床的ICD分为两大类:经静脉植入型心律转复除颤器(transvenous ICD,TV-ICD)和全皮下植入型心律转复除颤器(subcutaneous ICD,S-ICD)。 TV-ICD的除颤导线需通过静脉系统植入右心室。长期临床观察发现,TV-ICD可出现导线相关感染、导线脱位、三尖瓣损伤、静脉通路闭塞、血栓形成和导线拔除困难等诸多问题和并发症 [22] 。S-ICD是第1个可不在心脏内放置电极导线而具有感知和除颤功能的新型除颤治疗系统。Bardy等 [23] 于2001年开始进行S-ICD人体试验研究,第1代S-ICD于2009年获得欧盟CE(European Conformity)认证、2012年获得FDA认证并逐渐开始应用于临床。S-ICD的导线与脉冲发生器均埋于皮下,除颤电极置于与胸骨中线平行的胸骨左缘或右缘处,近端感知电极位于剑突附近,远端感知电极置于胸骨柄旁;脉冲发生器则置于左腋下前锯肌与背阔肌之间。除颤导线不直接接触心脏及相关静脉,进而避免了导线导致的静脉及心脏相关并发症。第2代S-ICD(Emblem TM ,美国波士顿科学公司)于2015年获得FDA认证,体积明显变小(90 cm 3 对60 cm 3 ),使用寿命可达7.3年并具有远程监测功能。目前S-ICD已发展至第4代(第1代SQ-RXTM、第2代EMBLEMTM、第3代EMBLEMTM MRI、第4代S-ICD+无导线起搏器)。 S-ICD最大的问题是舍弃了传统ICD的起搏和ATP功能,因此,不能用于需要起搏或ATP的患者。2018年7月研发成功了静脉外心律转复除颤器(extravascular ICD,EVICD,美国美敦力公司),与S-ICD的最大不同是其除颤电极导线置于胸骨后左缘、心包的表面(通过剑突下穿刺建立隧道)。EVICD除具有除颤功能外,还可进行心外膜起搏和ATP治疗。在澳大利亚和新西兰首次进行了人体临床试验,将于2021年完成。EVICD的第2个临床试验2019年6月在美国、加拿大等地24家医院进行,预计2022年12月结束。 四、植入型心律转复除颤器的临床试验 ICD对于SCD的预防包括二级预防和一级预防两个方面。二级预防是指对已发生过心脏骤停或发生过有血流动力学障碍的持续性室速患者植入ICD预防再次发生心脏骤停,而一级预防是针对从未发生过心脏骤停的高危人群(包括心梗后、心衰等)植入ICD以预防可能发生的SCD。20世纪末至21世纪初,多个关于SCD二级和一级预防临床试验的结果充分证实了ICD治疗能有效降低SCD高危患者的全因死亡率。 (一)植入型心律转复除颤器的二级预防临床试验 二级预防的主要临床研究包括抗心律失常药物与ICD对比研究(AVID) [ 24] 、加拿大植入型除颤器研究(CIDS) [ 25] 和汉堡心脏骤停研究(CASH) [ 26] (表2)。
针对上述二级预防临床试验的荟萃分析结果表明,对于心脏骤停和有血流动力学障碍的室速患者,ICD可使SCD的相对危险度降低50%,病死率下降25%,尤其对于左心室射血分数(LVEF)35%的患者获益更大 [ 27] 。 (二)植入型心律转复除颤器的一级预防临床试验 1.多中心自动除颤器植入试验(MADIT)[28]: MADIT研究入选心梗超过3周均有非持续性室速(NSVT)的患者,且LVEF35%、无血运重建适应证。随机分为传统药物治疗组和ICD组,平均随访27个月。结果发现,药物治疗组病死率39%,而ICD组病死率16%,ICD可显著降低心梗后高危患者的病死率。 2.多中心非持续性心动过速试验(MUSTT)[29]: MUSTT试验入选了2 202例LVEF≤40%伴无症状性、NSVT的冠心病患者,其中704例患者在电生理检查中诱发出持续性室速;随机分配至抗心律失常治疗(药物治疗或ICD治疗)组与无抗心律失常治疗组,主要终点事件为心脏骤停或心律失常致死。中位随访时间39个月,结果显示接受ICD治疗的患者主要终点事件风险较仅药物治疗的患者降低76%( P 0.001),而药物治疗的患者主要终点事件风险和全因死亡风险与无抗心律失常治疗组差异无统计学意义。 3.多中心自动除颤器植入试验Ⅱ(MADIT-Ⅱ)[30]: MADIT-Ⅱ研究是ICD一级预防里程碑式的试验,共入选了1 232例心梗超过4周,LVEF30%、无室速病史的患者,随机分为传统药物治疗组和ICD组,平均随访20个月,因结果差异非常显著(ICD组与药物组比较,总病死率下降了31%)而提前结束试验。随后的MADIT-Ⅱ研究8年随访结果显示,一级预防患者植入ICD后存活率可持续获益 [ 31] 。 4.心力衰竭心脏性猝死试验(SCD-HeFT)[32]: SCD-HeFT研究是目前患者数量最多的ICD临床试验,共入选2 521例左心室功能不全、LVEF≤35%、心功能为Ⅱ或Ⅲ级(NYHA分级)的中度心衰患者,所有患者在接受优化心衰药物治疗的基础上,随机分为3组:安慰剂组、胺碘酮治疗组和ICD组。结果发现,在随访期5年内,安慰剂组的年病死率为7.2%,ICD治疗使病死率降低了23%;胺碘酮组病死率与安慰剂组差异无统计学意义。由此提示,ICD治疗能够延长心衰患者的生存时间,降低LVEF≤35%的中度心衰患者的病死率。 5.非缺血性心肌病(NICM)ICD治疗试验(DEFINITE)[33]: DEFINITE试验入选了LVEF≤35%,合并频发室性早搏或NSVT的扩张型心肌病患者,随机分为传统药物治疗组和ICD组,平均随访29个月。结果提示ICD可显著降低因心律失常所致猝死的风险。 DEFINITE研究的亚组分析显示ICD植入时间不同而获益却相似 [ 34] 。但也有研究提供了不同的证据:首次诊断为NICM的部分患者经优化的药物治疗6~9个月后LVEF会增加,因而不再符合ICD的一级预防标准。因此,对于首次诊断为NICM 9个月内的患者,是否需要植入ICD有不同的意见。但多数研究表明,首次诊断为NICM 3~6个月内的患者,其左心室功能才有恢复可能性,6个月后LVEF很难再有提高 [ 35-36] 。 6.非缺血性收缩性心衰ICD治疗试验(DANISH)[6]: DANISH研究是一项多中心、非盲、随机对照研究,共纳入1 116例LVEF≤35%、心功能Ⅱ或Ⅲ级(NYHA分级)[若计划心脏再同步治疗(CRT),心功能可为Ⅳ级]的非缺血性心衰患者,以1∶1的比例随机分配至ICD组或对照组,平均随访67.6个月。结果表明,与优化药物治疗相比,ICD能够有效降低50%的SCD风险,但在降低长期的心血管病因病死率与全因死亡率上差异无统计学意义。亚组分析结果显示ICD降低全因死亡率与年龄显著相关,68岁的年轻心衰患者植入ICD获益更为明显,且这些结果与是否植入CRT无关。 7.心肌梗死后40 d内植入ICD的研究: ①AMI后除颤器的应用研究(DINAMIT) [ 37] ,为前瞻性、随机对照的临床试验。674例心梗后6~40 d的患者入选,332例患者接受ICD治疗。平均随访30个月,发现ICD组和非ICD组全因死亡率差异无统计学意义。ICD组能明显降低心律失常病死率,却明显增加了非心律失常病死率。②即刻风险评估改善生存率研究(IRIS) [ 38] ,为前瞻性、随机对照的临床试验,入选心梗后5~31 d的患者共898例,其中445例接受了ICD治疗。平均随访37个月,发现ICD组和非ICD组病死率没有差别,但ICD组显著降低了SCD的发生率。 8.血运重建术后植入ICD的研究: ①CABG-Patch研究入选了LVEF≤35%伴信号叠加心电图异常并行CABG的患者共900例,随机分为ICD组和非ICD组,ICD组患者在CABG术中植入心外膜除颤片状电极,随访36个月发现两组生存率差异无统计学意义,但心律失常性死亡在ICD组下降45% [ 39] 。②其他,一些ICD一级预防临床试验(MADIT-Ⅱ、MADIT-CRT和SCD-HeFT)的亚组分析显示ICD植入时间随着血运重建的时间延长而获益增加 [ 40-41] 。MADIT-Ⅱ研究的亚组分析中,有951例患者接受了冠状动脉血运重建,血运重建6个月后植入ICD的患者可额外获益 [ 41] 。 9.瑞典心衰登记处(SwedeHF)前瞻性倾向评分匹配研究[42]: 筛选出16 702例符合欧洲心脏病学会一级预防ICD标准的患者,其中只有1 599(10%)例患者进行了ICD植入,1∶1倾向评分匹配1 305例ICD患者和非ICD患者进行比较。平均随访2.64年,ICD可降低1年和5年的全因死亡率。该结论在所有亚组中都一致,包括缺血性与非缺血性心脏病患者、性别、年龄75与≥75岁患者、较早期与较晚期纳入的患者以及有或无心脏再同步治疗的患者。 10.欧洲ICD一级预防疗效比较研究(EUCERT-ICD)[43]: 该研究是一项前瞻性、非随机对照、多中心队列研究。共纳入欧洲15个国家、44个中心的2 247例符合ICD一级预防的缺血性及扩张型心肌病患者,排除拟植入CRT、心功能Ⅳ级(NYHA分级)的患者。其中ICD组1 516例,对照组731例,平均随访2.4年,ICD组年病死率5.6%,对照组9.2%( P =0.001 6)。多因素校正后,ICD组全因死亡率较对照组降低27%。亚组分析结果显示:糖尿病、高龄(≥75岁)患者植入ICD后获益不明显。 上述有关ICD一级预防临床试验的结果充分证明了对于SCD的高危患者,即使临床上无室速病史,ICD仍能显著降低病死率;ICD作为对SCD一级预防的获益程度超过二级预防。 (三)植入型心律转复除颤器的1.5级临床研究 绝大多数SCD高危人群难以有机会接受ICD的二级预防,而ICD一级预防的植入率仍然很低,部分原因是ICD对一级预防患者的益处存在异质性。而SCD-HeFT、MADIT-Ⅱ等研究显示有晕厥及类晕厥症状、ICD植入患者常规程控中出现NSVT及频发室性早搏者更易发生室颤。因此,为更有效筛选真正高危患者及提升ICD的治疗效能,由中国专家开创性地提出1.5级预防"的概念。1.5级预防"是指在符合一级预防适应证的基础上,同时满足以下1项或以上高危因素:①晕厥或先兆晕厥;②NSVT;③频发室性早搏(10次/h);④LVEF25%。Improve SCA研究是一项前瞻性、非随机、国际多中心临床研究,也是在发展中国家开展的最大规模的关于ICD预防SCD的前瞻性临床研究 [ 44] 。在全球17个国家或地区的86个中心共纳入符合ICD/CRT-D植入适应证的一级及二级预防患者3 889例,随访(20.8널.8)个月。在随访过程中共收集到4 870例ATP或除颤治疗的室颤/室速事件,其中86%为恰当治疗。结果显示,1.5级预防组恰当治疗率显著高于一级预防组,接受ICD植入的1.5级预防患者较未植入患者的全因死亡率降低49% [ 7] 。 此外,最近国外也有研究在一级预防患者中应用某些临床指标以提高患者从ICD中的获益。EUCERT-ICD的研究结果发现年龄、LVEF、NYHA分级、慢性阻塞性肺疾病等是植入ICD后患者死亡的预测因子 [ 43] 。该研究亚组分析显示夜间呼吸频率18次/min的患者从ICD中获益有限,18次/min的患者可从ICD中明显获益 [ 45] 。 (四)有关S-ICD及ICD术后参数设置的临床研究 1.针对S-ICD的临床研究: 包括Effortless研究 [ 46] 、S-ICD上市后注册研究 [ 47] 和PRAETORIAN研究 [ 48] 等,均显示S-ICD预防SCD与TV-ICD等效,并有减少导线相关并发症的趋势;打开SMART Pass程序后误治疗率低于TV-ICD。 2.ICD术后参数优化的临床试验 (1)专门以诊断参数为研究对象的临床试验①延长诊断时间程控策略的有效性和安全性研究(RELEVENT) [ 49] :共入组324例患者,平均随访6个月。结果表明通过延长诊断时间,90%的室性及室上性心律失常可自行终止,ICD放电次数明显减少( P 0.001),心衰住院率显著降低( P 0.004),且不增加晕厥及死亡事件。②减少不适当治疗的多中心自动除颤器植入试验(MADIT-RIT) [ 50] :该研究共入选1 500例ICD一级预防患者,随机按照1∶1∶1分为传统程控组、提高诊断频率组和延长诊断时间组。平均随访1.4年,结果显示与传统程控设置组相比,提高诊断频率或延长诊断时间,首次不适当治疗分别减少了79%( P 0.001)和76%( P 0.001),病死率分别减少了55%( P =0.01)和44%( P =0.06),而首次晕厥的发生率差异无统计学意义。③避免治疗非持续性室性心律失常研究(ADVANCE Ⅲ) [ 51] :该研究入选了1 902例首次植入ICD的患者,其中75%为一级预防,25%为二级预防。患者按照1∶1随机分配至延长诊断窗口组和标准诊断窗口组。平均随访1年后发现,与标准诊断窗口组相比,延长诊断窗口组显著减少ICD治疗,不恰当放电和住院率也显著降低,而病死率和晕厥率差异无统计学意义。 (2)专门以治疗参数为研究对象的临床试验①ATP减少放电研究(PainFREE RXI) [ 52] :共入选220例首次植入ICD的冠心病患者,平均随访6.9个月。结果显示ICD患者中快频率室速(FVT,诊断频率为188~250次/min)常见,ATP可以有效治疗约75%的FVT事件,其加速或晕厥风险较低。②比较经验性ATP与放电两种方式治疗自发的快速室速研究(PainFREE RxⅡ) [ 53] :也是第1个比较ATP和电除颤对FVT(周长240~320 ms)疗效的大规模随机试验。入选634例患者,按照1∶1随机分配到电击治疗组( n =321)和经验性ATP治疗组( n =313)。平均随访11个月,结果显示与电击治疗相比,经验性ATP治疗对于FVT是安全有效的,并能提高患者的生活质量。 (3)以诊断参数及治疗参数为研究对象的临床试验:①一级预防参数设置评估研究(PREPARE) [ 54] :是第1个专门探讨ICD一级预防参数设置的临床试验。共入选700例患者,随访时间为1年。该研究的程控策略:a. 避免对频率较慢的室速进行诊断;b. 避免对NSVT进行诊断;c. 对FVT区应用ATP;d. 打开室上性心动过速(室上速)鉴别功能,避免将室上速误诊断为室速/室颤;e. 第1阵高能量电击(shock)治疗。结果表明对于一级预防的ICD患者,策略性程控可以减少ICD的放电次数、心律失常性晕厥和对持续性室速/室颤治疗缺失的联合终点发生率。②标准化和医生个体化ICD程控的比较研究(EMPIRIC) [ 55] :旨在评价与医师个体化的设定方法相比,标准化的ICD程控策略能否在减少ICD放电的同时,保证治疗的有效性。共入选900例患者,其中一级预防患者416例,1∶1随机分组,随访时间为1年。结果显示标准化程控策略显著减少了发生5次以上电击的患者数量及住院率,但两组在全因死亡率、晕厥等方面差异无统计学意义,提示标准化程控策略可行、有效,不增加电击相关的病死率。③通过程控ICD参数延迟一级预防患者首次放电出现时间的研究(PROVIDE) [ 56] :入选1 670例一级预防的患者,并按照1∶1随机分配至试验组和对照组。与对照组相比,试验组程控特点为:检测频率更高,检测时间更长,设置更多ATP治疗,采用室上速鉴别功能。平均随访1.5年,该研究再次证实上述程控策略可以有效减少ICD治疗,降低总病死率而不增加心律失常性晕厥事件。 总而言之,通过延长诊断窗口、提高诊断频率、对于FVT给予经验性ATP等程控策略,可减少不必要电击,安全有效,提高患者生活质量,并能降低总死亡率。 五、植入型心律转复除颤器的适应证 (一)ICD适应证的发展历程 ICD应用于临床已有40多年,ICD器械本身及植入技术一直在不断进步,其适应证也在不断扩展,后者主要是依据大规模多中心前瞻性随机对照临床试验的结果。美国FDA于1980年首次提出,对于有两次心脏骤停发作病史的幸存者可植入ICD,之后在FDA及相关学会制定的指南中ICD的适应证得以拓宽,但仍局限于二级预防 [57] 。直至2002年,随着MADIT、MADIT-Ⅱ及MUSTT等ICD用于SCD一级预防的大规模随机对照临床试验结果的公布,ACC/AHA/北美心脏起搏和电生理学会(NASPE)联合发布的ICD指南中才将ICD适应证正式由SCD的二级预防扩展到一级预防 [58,59] 。2015年欧洲心脏病学会(ESC)发布了《室性心律失常治疗和心脏性猝死的预防管理指南》,丰富了心梗48 h后至40 d以内这一时间段内的ICD推荐,且首次提出了S-ICD的植入适应证 [60] 。2017年,AHA/ACC/HRS联合发布了《室性心律失常患者的管理和猝死预防的指南》,该指南纳入了多项新的ICD预防猝死相关随机对照临床试验证据,且以疾病为单元阐述ICD植入适应证,并提高了S-ICD的推荐级别 [8] 。 (二)我国ICD适应证的建议 我国关于ICD植入适应证的第1个和第2个专家共识先后发布于2002年和2014年 [61,10] ,分别主要参照了1998年ACC/AHA和2008年ACC/AHA/HRS制定的相关指南。由于新的临床研究及相关指南的出台,有必要对原共识进行更新。本次专家共识是在以往两个中国专家共识的基础上,结合2015年ESC和2017年AHA/ACC/HRS的相关指南以及一些最新的临床研究结果讨论制定。考虑既往习惯并参照最新推南推荐,本共识将适应证按SCD一级预防和二级预防以及不同疾病分别进行了扼要的分类和阐述,以利相关从业者查阅、参考。 1.以疾病为单元的ICD适应证推荐。参考2015年ESC及2017年AHA/ACC/HRS关于室性心律失常患者管理和SCD预防的指南,本共识以疾病为单元将ICD适应证用表格形式列出(表3~12)。
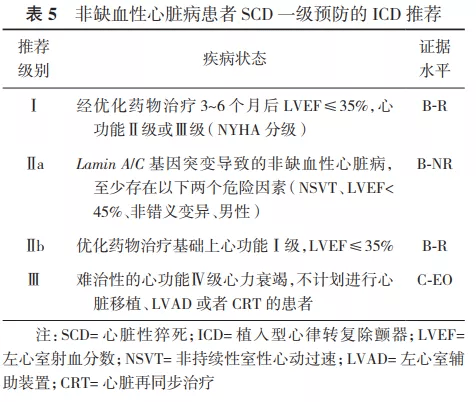
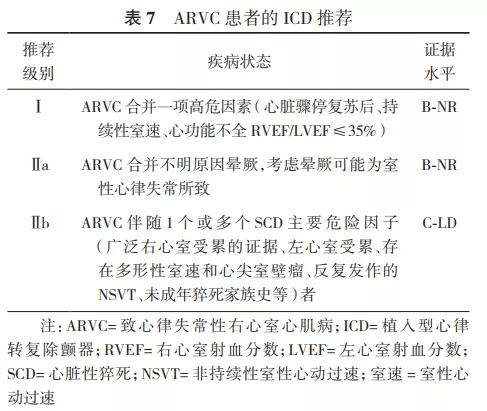
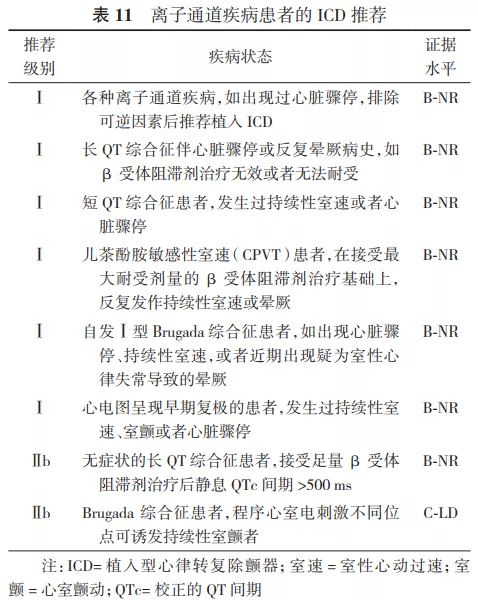
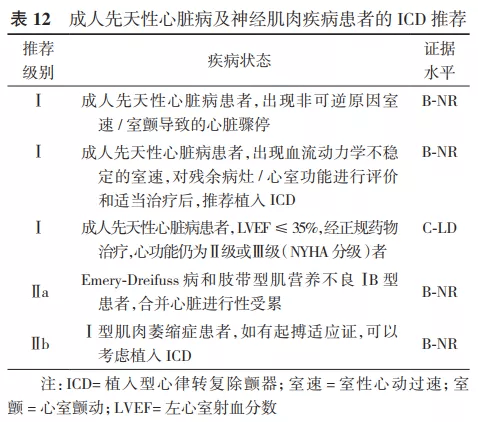
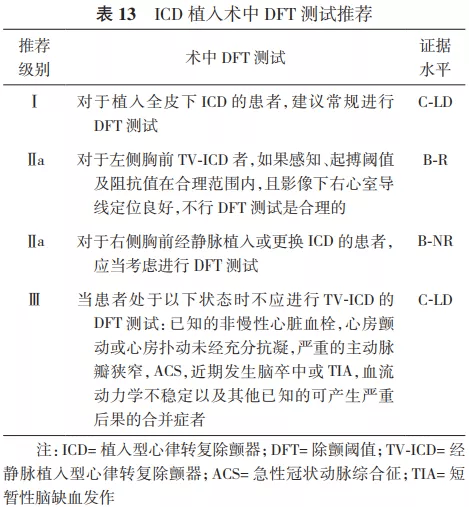
2.ICD在SCD一级预防中的推荐。Ⅰ类适应证:①心梗40 d后及血运重建90 d后,经优化药物治疗后心功能Ⅱ级或Ⅲ级,LVEF≤35%;或者心功能Ⅰ级,LVEF≤30%(证据水平A)。②既往心梗导致的NSVT,LVEF≤30%,电生理检查能够诱发出持续性室速、室颤者(证据水平B)。③非缺血性心脏病患者,经优化药物治疗3~6个月后心功能Ⅱ级或Ⅲ级,LVEF≤35%(证据水平B)。Ⅱ类适应证:详见表3、表5、表7~12。 3.ICD在SCD二级预防中的推荐。Ⅰ类适应证:①非可逆原因导致的特发性室颤或血流动力学不稳的持续性室速,引起心脏骤停后存活者(证据水平A)。②伴有器质性心脏病的自发持续性室速或室颤患者,无论血流动力学是否稳定(证据水平B)。③心梗48 h后发生的非可逆性原因导致的室颤或血流动力学不稳的室速患者(证据水平A),以及血流动力学稳定的持续性单形性室速患者(证据水平B)。④心梗48 h后不明原因的晕厥,电生理检查能够诱发出持续性单形性室速患者(证据水平B)。⑤非缺血性心脏病,出现非可逆原因的室速/室颤导致心脏骤停或血流动力学不稳定的持续性室速患者(证据水平A),以及血流动力学稳定的持续性单形性室速患者(证据水平B)。⑥各种离子通道疾病,如出现过心脏骤停或持续性室速,药物(如%u3B2受体阻滞剂)治疗无效或无法耐受者(证据水平B)。⑦不明原因的晕厥患者,电生理检查诱发出血流动力学不稳定的持续性室速或室颤(证据水平B)。Ⅱ类适应证:详见表4、表6~12。 关于ICD植入的Ⅲ类适应证,因其存在共性,故未以疾病类型分类,推荐如下:①满足ICD适应证,但患者不能以较好的功能状态生存1年以上,需要综合判断并与患方充分沟通;②无休止室速或室颤,需待室速、室颤控制且病情稳定后再计划ICD植入;③存在明显的精神疾病,可能由于ICD植入而加重,或不能进行系统随访者;④不合并器质性心脏病及离子通道疾病的不明原因晕厥,且未能诱发室性心律失常;⑤手术或导管消融可治愈的室颤或室速,主要是指无器质性心脏病患者;⑥由完全可逆因素(如电解质紊乱、药物或创伤)引起的室性快速性心律失常。 六、植入型心律转复除颤器类型的选择及除颤阈值测试 (一)类型选择 1.单腔和双腔ICD的选择: 根据2002年ACC/AHA/NASPE和2008年ACC/AHA/HRS指南描述,如果患者需要双腔起搏治疗或者伴有室上性快速心律失常有不恰当放电可能性时,可考虑选择双腔ICD治疗。目前由于缺乏临床依据及明确的指南推荐,临床上对于单腔和双腔ICD的选择出现了很大差异,有些中心只植入单腔ICD,而另一些中心则只植入双腔ICD [62] 。 双腔ICD的优势在于可提供心房感知和起搏,且能通过观察房室分离有助于鉴别室速与室上速。但实际上,美国国家心血管数据注册的ICD数据库分析显示,二度、三度房室传导阻滞仅占5%,窦性停搏需要心房起搏者占12% [58] 。而随着现代ICD程控策略的优化,心房导线在辅助鉴别室速与室上速方面的优势逐渐降低。PAPRURE研究入选了100例双腔ICD患者,随机程控为单腔或双腔模式,随访1年发现,两组不恰当治疗发生率差异无统计学意义,均为2% [63] 。双腔ICD的劣势包括增加了手术相关并发症、手术花费、脉冲发生器寿命缩短和心室起搏比例的增高。DAVID研究显示,在不需要心动过缓起搏的患者中,双腔ICD组心衰住院率增加,病死率增加,并证实与高比例右心室起搏相关 [64] 。 2014年HRS/ACC/AHA联合发表了针对未纳入临床试验患者植入ICD的专家共识,建议在选择单、双腔ICD时,需综合考虑患者是否有心动过缓起搏适应证、基础心脏疾病、心功能状况以及室性心律失常类型等,以选择适合患者的ICD类型 [65] 。推荐如下:①症状性窦房结功能障碍的患者,推荐植入心房导线;②窦性心动过缓和/或房室传导功能障碍患者,需要使用%u3B2受体阻滞剂或其他具有负性变时功能作用的药物时,推荐植入心房导线;③记录到二度或三度房室传导阻滞伴窦性心律的患者,推荐植入心房导线;④由心动过缓诱发或长间歇依赖的室性快速心律失常(例如长QT综合征伴尖端扭转型室速)的患者,植入心房导线有益;⑤记录到房性心律失常(排除永久性房颤)的患者,可以考虑植入心房导线;⑥肥厚型心肌病患者,若静息或激发状态下出现明显的左心室流出道压差,可以考虑植入心房导线以通过短AV间期起搏右心室减轻梗阻程度;⑦未记录到房性心律失常且无其他原因需要植入心房导线的患者,不推荐植入心房导线;⑧永久或长程持续房颤患者,并且不考虑恢复或维持窦性心律,不推荐植入心房导线;⑨非心动过缓诱发或长间歇依赖的室速患者,不推荐植入心房导线。 2.心脏再同步治疗除颤器的选择: 依据相关指南,具有心脏再同步治疗起搏器(cardiac resynchronization therapy pacemaker,CRT-P)适应证者(QRS时限130 ms,LVEF35%),除非预期生存期1年,都是ICD的适应证。在器械功能上,心脏再同步治疗除颤器(cardiac resynchronization therapy defibrillator,CRT-D)为ICD和CRT的组合,因此理论上讲,需要植入CRT者都应植入CRT-D。但目前CRT的相关指南并未对选择CRT-P或CRT-D做出明确规定。一方面,既往的研究主要是针对CRT-P与药物以及CRT-D与ICD的对比研究,缺乏CRT-P与CRT-D头对头的随机对照研究证据(仅有的COMPANION研究显示CRT-D与CRT-P在全因死亡和心衰住院风险上差异无统计学意义 [66] ),而已有的回顾性研究的结果并不一致 [67] ;另一方面,临床的净效应并非全部归因于器械本身功能的增减,不同病因和心功能都会左右CRT与ICD功能所起作用的权重,加之CRT-D的并发症(除颤导线高故障率、不适当电击等)和高费用等 [68] ,针对个体患者并非CRT-D一定优于CRT-P。结合2013年ESC起搏与CRT指南中有关CRT-P和CRT-D的推荐意见 [69] ,本共识推荐植入CRT-D的情况:①具有CRT适应证,同时符合ICD二级预防适应证者,推荐植入CRT-D。②具有CRT适应证,即使无ICD二级预防适应证,若满足以下条件之一者,也优先考虑CRT-D:a.缺血性心脏病;b.心功能Ⅱ级;c.显著的左心室扩大和更低的LVEF;d.预防SCD作为CRT疗法的主要目的;e.预计CRT效果差者(选择CRT-D至少保证了ICD预防SCD的疗效)。③心功能Ⅳ级,预期寿命1年者不建议植入CRT-D,但需综合考虑患者意愿,与患者共同探讨其风险获益比。 3.全皮下植入型心律转复除颤器的选择: 结合2017年AHA/ACC/HRS相关指南 [8] ,S-ICD推荐级别如下:①符合ICD植入标准,但缺乏合适的血管入路或预计感染风险高;目前不需要、预期将来也不需要起搏来治疗心动过缓或者终止心动过速;目前无CRT适应证、预期将来也不需要植入CRT的患者(Ⅰ类推荐,证据水平B-NR级)。②符合ICD植入标准,目前不需要、预期将来也不需要起搏来治疗心动过缓或者终止心动过速;目前无CRT适应证、预期将来也不需要植入CRT的患者(Ⅱa类推荐,证据水平B-NR级)。③虽然符合ICD植入适应证,但合并心动过缓需要起搏器治疗;合并心衰需要CRT治疗;或者需要ATP终止室速的患者(Ⅲ类推荐,证据水平B-NR级)。 (二)心室除颤阈值的测试 除颤阈值(defibrillation threshold,DFT)概念于1963年第1次提出,定义为终止室颤所需的最小能量 [70] 。但是"阈值"这个概念并不适用于临床实践中的除颤,此处的除颤阈值只是指除颤成功的概率。 1.TV-ICD的DFT测试方法: 常用的两种模式为10 J安全范围法及逐级降低能量测试法。前者是以低于脉冲发生器最大除颤能量至少10 J以上的能量进行除颤,仅需诱发1次室颤,是目前临床最为常用的方法;逐级降低能量测试法需多次诱发室颤,精确但临床少用。早期ICD只有除颤功能,仅用于室颤患者的治疗,因此,DFT作为ICD植入术中的标准流程以确认ICD的感知和除颤功能,其作用毋庸置疑。随着ICD适应证的拓宽、临床应用经验的积累以及ICD工艺和技术的改进(如ATP、高输出能量),DFT测试是否仍有其必要性,许多学者产生了不同观点。 支持DFT测试的理由:①DFT测试是ICD植入过程的标准流程;②DFT测试中发现高DFT可以及时调整,使患者能接受更有效的除颤治疗;③较精确的DFT测试,可程控较低的除颤能量,而低除颤能量具有充电时间短、对心肌损伤小和节约电能等优点;④DFT是测试ICD能否正确感知室颤波及除颤系统连接是否正常等的重要判断依据;⑤自发性室颤者除颤失败是ICD患者猝死的主要原因。据报道,没有达到10 J的安全范围是在双相波、TV-ICD患者发生SCD的独立预测因子 [71] 。若ICD患者出现不明原因死亡,而医生未按标准流程进行DFT测试,可能使医生处于不利和被动的局面,出现医学伦理问题 [72] 。 不支持DFT测试的理由:①诱发性室颤不同于自发性室颤,临床最常见的需要ICD治疗的心律失常是室速而非室颤;②DFT测试成功与否并不能预测临床除颤功能的成败;③有研究报道DFT测试与否不影响长期预后 [73] ;④DFT测试有一定风险 [74] ;⑤ICD植入术后发生猝死未必与DFT有关,可以由导线和ICD故障所致,也可以是除颤成功但后续发生电机械分离引起。 SIMPLE(Shockless implant evaluation)研究的主要目的是评价在ICD植入过程中进行DFT测试对患者长期临床预后的影响 [75] 。前瞻性、多中心、随机对照纳入2 500例新植入ICD/CRT-D患者,随机分为DFT组和非DFT组,平均随访3年。结果显示,首次除颤成功率两组间差异无统计学意义,随访期间全因死亡率差异亦无统计学意义。结论为ICD植入过程中,推荐不必常规进行DFT测试。 建议:ICD植入过程中,针对一级预防的患者,推荐不常规进行DFT测试。而对二级预防的患者,可根据患者基础心脏疾病、心功能状况以及室性心律失常类型等,由植入医生决定是否进行DFT测试。 2.S-ICD的DFT测试方法: 目前临床上多采用15 J安全能量范围测试法,即以低于S-ICD最大除颤能量(80 J)15 J的能量(65 J)进行除颤。测试前医生根据需要可考虑X线下再次确认导线和脉冲发生器位置(心影应在脉冲发生器及导线除颤线圈之间)。闭合囊袋及剑突和胸骨柄切口处的皮下组织时,需排尽切口和隧道中的空气。关闭条件电击区,电击区设置为170次/min,开启电击后起搏功能(按需起搏,起搏频率50次/min,最长30 s)。测试时患者处于中度至深度镇静或全身麻醉下,以200 mA/50 Hz交流电3~10 s诱发室速/室颤,首次电击能量为65 J,标准极性;如首次除颤失败,系统会再次用80 J除颤,如仍未成功,应及时体外电击复律。DFT失败患者可尝试转化除颤极性,必要时调整脉冲发生器和/或除颤电极位置。 目前用于评估S-ICD安全性及有效性的大型临床研究中,绝大多数案例均接受DFT [46,47,76] ,尚无S-ICD不行DFT测试的大型临床研究数据。正在进行的前瞻性、随机对照研究PRAETORIAN-DFT有望为此提供数据支持。 建议:S-ICD植入过程中,推荐常规进行DFT测试。但在临床实际工作中也可根据患者基础心脏疾病、二级预防或一级预防、心肺功能状况及镇静麻醉可行性等,结合植入时PRAETORIAN评分,由植入医生决定是否进行DFT测试。 本共识结合2015年HRS/ EHRA/ APHRS/ SOLAECE关于ICD程控和测试专家共识对ICD植入术中DFT测试作出如下推荐(表13) [77] 。
七、植入型心律转复除颤器的随访和程控 (一)植入型心律转复除颤器的随访 对已接受ICD治疗的患者进行定期随访是ICD治疗过程中的重要环节。相对于普通心脏起搏器,加强ICD术后管理显得尤为重要。一方面,ICD器械本身较为复杂,尤其是针对快速室性心律失常诊治的精细算法和程控;另一方面,植入ICD的患者多伴有较为严重的心脏疾病。通过随访可了解ICD治疗的效果,及时发现和处理手术及ICD本身可能出现的并发症及故障,了解ICD是否处于最佳工作状态,使患者得到最优治疗效益 [78-79] 。 1.随访目的: 2.随访方式和频度 (1)随访方式:ICD的随访方式主要有诊室随访和远程随访两种。①诊室随访:诊室随访是目前主要的随访方式,即由专科医师和/或从事ICD的医护技术人员在诊室进行检测的随访方式。通过程控仪询问读取ICD数据和信息,同时了解患者的病情、用药和生活工作情况,最后决定是否调整器械参数设置以及其他治疗措施。②远程随访:远程随访能提供及时、准确的ICD工作数据和信息,某种程度上具有与传统诊室随访相当的功能 [80-81] 。远程询问可以减少患者来医院就诊次数,增加随访频度,尤其适于路途遥远、交通不便的患者;而远程监测可及时发现器械及患者发生的问题,减少不适当放电,并降低ICD患者住院率和病死率 [82-86] 。当然,远程随访亦有其局限性,例如当患者病情有变化或不稳定时(ICD患者多存在器质性心脏病及心衰),远程随访不能做到针对疾病本身,包括器械参数设置的及时调整。因此,ICD患者仍然需要每半年至少1次的诊室随访。 (2)随访频度:出院后随访通常分为3个阶段。①早期:植入后4~12周内应来院随访1次;②中期:依据患者临床情况,每3~6个月应进行1次诊室随访或远程询问,ICD随访间隔通常不应超过6个月;③后期:当ICD接近择期更换适应证时,应该考虑增加诊室或远程随访次数(每次间隔1~3个月);④紧急随访:在ICD电风暴或远程监测出现红色报警时需紧急随访。若怀疑导线或脉冲发生器功能障碍时,应提高随访频度。 3.随访内容: (二)植入型心律转复除颤器的程控建议 ICD的程控参数设置包括抗心动过缓的起搏设置、心动过速检测设置和心动过速治疗参数设置 [77] 。 1.抗心动过缓起搏参数的设置: 需根据患者基础心脏疾病、心功能状况及存在的缓慢心律失常等,调整相关起搏参数 [87] 。程控设置要点:①伴有变时功能不全的患者(尤其是年轻或运动量较大患者),需打开频率应答功能;②植入单、双腔ICD的患者,均需通过程控参数调整以达到最小化右心室起搏;③合并肥厚型梗阻性心肌病的患者,将AV间期个体化程控为短于自身PR间期,用尽量多的右心室起搏减轻流出道梗阻;④植入CRT-D的患者,应通过AV间期优化增加双心室起搏比例,并尽可能提升至98%以上。推荐使用自动优化AV/VV间期功能,以获得更窄的起搏QRS时限和更好的血流动力学效果。 2.心动过速检测参数的设置: 3.ICD治疗参数的设置: 4.不同ICD制造商的程控设置推荐: 需要说明的是,这些不一定是制造商推荐的设置,也不一定适用于所有情况。每个患者的ICD程控设置必须依据患者的具体临床情况,临床医师需仔细判断这些推荐的程控设置是否适合具体的患者。以下就不同ICD制造商的程控设置推荐进行汇总。 (1)美国美敦力公司。①抗心动过缓设置:单腔为VVI 40次/min;双腔为DDD,可考虑心室起搏管理功能(MVP)%uB1频率应答;CRT为DDD%uB1频率应答,房室传导功能正常伴左束支传导阻滞(LBBB)患者可考虑Adaptive BiV & LV。②心动过速检测:无室速病史的患者,室颤区为30/40个心动周期,188次/min;关闭快心率室速区和室速区;室速区监测由程控者自主决定。室速周长已知的患者,室颤区为30/40个心动周期,188次/min;关闭快心率室速区;室速区为24个心动周期,10次/min |
【本文地址】
今日新闻 |
推荐新闻 |