|
编译:微科盟如风,编辑:微科盟木木夕、江舜尧。 微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。 导读
第二大脑、被遗忘的器官、个人的身份证和宿主的指纹是经常用来描述肠道微生物群的几个统称,这得益于它的可变性、可靠性和它在决定宿主健康方面的作用。此外,理解这种宿主健康-肠道微生物群的关系可以创造一个机会,通过操纵肠道微生物群的组成来改善人体健康。人们开发了一些方法,如服用益生菌、益生元、合生元及粪便微生物群移植等,被尝试用来减轻因菌群失调而引起的不良影响,但这些方法的效果是高度通用和非特异的。因此,有必要设计针对特定疾病的个性化药物,并需要考虑到个体特定的肠道微生物群。促进健康的共生菌可能成为新的设计个性化药物且有前途的预防和治疗剂。这些共生菌被定义为新一代益生菌(NGP),其独特的特性、未知的身份和特殊的生长需求给研究人员、工业开发和监管机构带来了困难。从这个角度,本综述讨论了NGP的概念、NGP作为设计个性化药物的候选工具,以及作为NGP的设计型益生菌所需的监管框架,并提出了基于NGP的产品开发路线图。 论文ID 原名:Next-generation probiotics: a promising approach towards designing personalized medicine 译名:新一代益生菌:一种有前景的个性化药物设计方法 期刊:Critical Reviews in Microbiology IF:7.624发表时间:2021.4.6 通讯作者:Tejinder Pal Singh,Basavaprabhu Haranahalli Natraj 通讯作者单位:印度Lala Lajpat Rai兽医和动物科学大学乳业科学技术学院乳业微生物系,印度卡尔纳尔ICAR -国家乳品研究所 综述目录 前言 1 人类微生物群:潜在的新一代益生菌的来源 2 NGPs 与传统益生菌 3 作为个性化医疗的NGPs 4 选择潜在的NGP 5 作为NGPs的设计型益生菌 6 NGP 开发的技术功能挑战 7 NGP监管指南 结论 主要内容 前言尽管分子生物学和生物信息学的最新进展使科学家们有能力描述人类肠道微生物组的组成和功能,但与人类肠道相关的微生物、它们促进健康的潜力和成功的应用已经有了几个世纪的历史。1889年,Tissier首次从母乳喂养的婴儿肠道中分离出双歧杆菌,但改变肠道微生物群以促进健康的概念是由Elie Metchnikoff在1907年提出的,他认为保加利亚人的长寿是由于经常食用富含乳酸菌的发酵酸奶。1930年,Minoru Shirota开始将含有干酪乳杆菌Lactobacilluscasei 株的Shirota的益生菌饮料(Yakult)商业化。此后,利益相关者(研究人员、行业、监管机构和消费者)对益生菌的目标、概念和利益的倾向不断地从发酵食品转向传统的益生菌,进而转向先进的现代益生菌,如开发新一代益生菌(NGPs)。图1描绘了益生菌历史上的里程碑和其概念的变化。 
图
1. 益生菌在历史上的变化趋势及里程碑
从词源学上讲,“益生菌”这个词是由拉丁语介词“pro”(意为“for”)和希腊语形容词“biotikos”(意为“适合生命”)组成的。Kollath首先用它来描述各种可以恢复营养不良患者健康的有机和无机补充剂,后来被各种研究人员用于不同的描述。最后,Fuller提出了“益生菌”一词,仅限于活菌的概念。由国际益生菌和益生元科学协会(ISAPP)召集的专家小组从语法上更新了粮农组织/世卫组织(FAO/WHO)给出的益生菌定义,该定义现在被解读为“当给予足够数量时,对宿主的健康有益的活微生物”。目前市面上的益生菌主要有乳酸菌Lactobacillus spp.,双歧杆菌Bifidobacterium spp.,还有酵母菌Saccharomyces,芽孢杆菌Bacillus spp.、大肠杆菌Escherichia coli,肠球菌Enterococci,魏斯氏菌Weissella spp.等,这些益生菌都是从肠道或传统发酵食品中随机选择的,这些食品都有很长的安全使用历史。虽然一些研究人员报告了益生菌促进健康和对抗疾病的作用,但仍存在一些限制,阻碍了传统益生菌的应用。值得注意的是,益生菌的使用主要集中在一般作用上,包括增强肠道上皮屏障功能、提高肠液中IgA水平、维持肠道微生物群稳态、通过产生抗菌成分减少肠道病原生物,以及产生必需分子。因此,益生菌的使用不以改善靶向性疾病为目的。此外,传统益生菌的功效在统计学上是微不足道的,因为其影响非常具有菌株特异性,而且宿主之间的效果也可能不同。个性化医疗是一种先进的方法,它考虑到了包括遗传、环境和生活方式在内的个体之间的差异性,并描述了每个病人独特复杂的疾病特定的代谢模式。这种未来主义的方法是基于对个体微生物组的常规分析,以及个体对不同营养物质和治疗剂的预测反应,从而为开发新的疾病特异性治疗策略创造机会。考虑到这些要点,NGPs和设计型益生菌的开发可能代表了个性化医学时代的一种合理的良性策略,可以用来重塑肠道微生物组,从而帮助改善目标疾病。 1
人类微生物群:潜在的新一代益生菌的来源人类被认为是超级生物体”,但他们并不孤单,因为他们与微生物密切相关。人类微生物组项目挖掘了人类胃肠道(GIT)中存在的100万亿个微生物(细菌、真菌、古菌、病毒和原生动物),即肠道微生物组。由于缺乏对营养需求和适宜培养条件技术的知识,因此培养所有的细菌可能是一项困难的任务。但核酸测序技术和生物信息学工具的出现克服了这种困难,使研究人员能够识别和/或量化肠道微生物组的不同成员。从系统发育学上讲,肠道细菌中大约90% 的细菌属于厚壁菌门和拟杆菌门,而其他细菌属于放线菌门、变形菌门、梭杆菌门和疣微菌门。Rinninella等人研究发现,每个人的肠道微生物群组成都是独特的,这种组成在人的一生中各不相同。在婴儿时期,肠道菌群组成相对清晰,具有丰富的阿克曼氏菌Akkermansiamuciniphila、拟杆菌Bacteroides、韦荣球菌Veillonella、梭状芽胞杆菌Clostridium coccoides spp.和肉毒梭菌Clostridium botulinum spp.的特征,其组成随分娩方式、出生胎龄、喂养类型、药物治疗或抗生素使用而变化。肠道微生物群在成年后变得高度多样化但又相对稳定,主要由厚壁菌门(毛螺菌科Lachnospiraceae和瘤胃球菌科Ruminococcaceae)、拟杆菌门Bacteroidetes(拟杆菌科Bacteroidaceae、普氏菌科Prevotellaceae和里肯菌科Rikenellaceae)和放线菌门Actinobacteria(双歧杆菌科Bifidobacteriaceae和棒状杆菌科Coriobacteriaceae)主导,但宿主特有的独特性归因于遗传、环境、饮食、生活方式和肠道生理学特点。在老年阶段,由于饮食习惯、消化、营养吸收和免疫系统薄弱,双歧杆菌计数减少,梭状芽孢杆菌Clostridium spp.和变形菌门的数量增加。来自宿主-微生物相互作用研究的证据表明,肠道微生物群的调节功能是决定宿主健康状况的重要调节器。对无菌(GF)动物的研究证明,肠道微生物群对宿主的代谢功能和食欲信号、保护宿主免受病原体侵害的肠道上皮屏障的完整性以及宿主免疫系统的发展有控制作用。研究还表明,肠道微生物群失调可能导致各种胃肠道(GI)或非GI感染。目前,服用益生菌、益生元或合生元等膳食补充剂是一种有助于恢复肠道平衡的策略,但其效果是高度通用的,没有疾病针对性。因此,先进的方法,如个性化医疗,主要是针对影响免疫和代谢功能的个体肠道微生物群特征。个性化医疗旨在通过新认识的交流途径,如肠道-大脑轴、肠道-肺轴、肠道-骨骼轴、肠道-血管轴和其他轴,加强肠道微生物群对不同胃肠道和非肠道感染的积极影响。大量的肠道微生物研究和粪便微生物群移植(FMT)在治疗复发性艰难梭菌(rCDI)感染和恢复微生物群失调方面的成功率,强调了共生物种在维持个人健康方面的重要性。然而,FMT的成功未能掩盖相关的困难,如治疗的微生物组优化、接受者的安全保证和监测患者的粪便改造成功。事实上,现有方法的这种局限性为出现更有希望的方法创造了机会。从传统的益生菌转向开发NGPs来设计个性化的药物,就是这样一种即将出现的有前途的、更安全的策略,可以用来治疗目标/特定的疾病。 2 NGPs 与传统益生菌考虑到肠道微生物群的重要性,从共生菌中找出能够解决特定健康问题的关键角色,可能是益生菌领域的新突破点。这些共生菌通常被称为
NGP
s。在没有任何证据的情况下,NGP被认为是标志着从具有安全历史的传统微生物向新微生物的继承的合理尝试。表1描述了NGPs和传统益生菌之间的其他区别。NGPs有时也被称为活体生物治疗产品(LBPs),但也值得考虑这些术语的不同。根据美国食品和药物管理局(FDA)规定,LBP是一种生物制品,(a)包含活的生物,如细菌、酵母(滤过性病毒、溶瘤细菌或作为基因治疗药物的产品除外),(b)适用于预防、治疗或治愈人类的疾病或情况,并且(c)不是疫苗,(d)不是注射剂。因此,NGP也很适合LBP的类别,包括LBP微生物和其他成分。NGP 可以由已经参与传统益生菌和微生物组研究的实验室进行研究,并且可以利用益生菌的经验来确定发展轨迹,而LBP则由具有营销兴趣的初创生物技术公司或制药公司处理。然而,研究人员对益生菌的看法相互矛盾,因为一些人认为,转基因益生菌必须在标签领域下处理,因为它满足了消费者的信心,即益生菌是未经修饰的生物体。而另一些人则认为应广泛使用NGP一词,因为它包括证实LBPs的微生物,包括转基因细菌以及潜在的有益共生细菌。人们还认为,随着认识的迅速进步,NGPs很快就会与目前的益生菌或LBPs合并。 表
1. 传统益生菌和新一代益生菌的特征
3 作为个性化医疗的NGPs
在过去的几十年中,肠道微生物群已成为描述健康状况、预后和预测治疗效果的生物标志物,肠道菌群失调与胃肠道疾病和非胃肠道疾病之间的联系在微生物组广泛联系研究中是显而易见的。由于每种疾病的表现、位置、治疗策略和诊断方法都有差异,对特定治疗的反应可能不是所有患者都一样。因此,考虑到病人的特殊性,针对疾病的个体化医学的概念需要被采纳。NGPs 似乎是个性化医疗的潜在工具,因为它可用于通过调节肠道微生物群来改善目标疾病。NGP 的开发通常采用两种策略。首先包括鉴定与特定健康表型相关的菌株,并验证其使用适当的实验模型重现健康表型的功效。第二种策略包括鉴定一种可以消除疾病表型的有效分子,并将其引入一个特征明确的益生菌菌株中,该菌株可以作为一种载体。不同的细菌菌株已被鉴定和研究为 NGP,用于改善肥胖、癌症,研究发病机制、炎症性肠病(IBD)等,如表2所示。拟杆菌门Bacteroidetes和厚壁菌门Firmicutes是肠道微生物组中最主要的门,因此,这些组的细菌主要作为 NGPs 候选物。脆弱拟杆菌
Bacteroides fragilis
菌株ZY-312(门水平:拟杆菌门),从母乳喂养的婴儿粪便中分离出来,与结肠细胞和巨噬细胞共培养时促进了微生物分子的产生和其吞噬功能。多糖A (PSA)被发现是一种效应成分,由特殊菌株Bact.fragilis产生,具有免疫调节功能,可能有助于预防病毒性脑炎和改善炎症相关疾病。相比之下,一些Bacteroidesfragilis菌株产生脆弱菌素和肠球菌素,被认为是疾病发展的危险因素,显然不能被认为是 NGP 的理想性状。同样,另一种产生人类粪便分离物的PSA,Bact.xylanisolvens DSM 23964已在1期人体试验中被证明可耐受。此外,这种有机体的热灭活制剂能够提高Thomsen-friedenreich特异性免疫球蛋白M 抗体(anti-TFα IgM)的水平,这种抗体被认为能够促进对癌症更强的反应。虽然这项研究与益生菌的定义特征之一相矛盾,即这种生物必须是活的。类似地,Bact.acidifaciens和Bact. ovatus菌株被报道可在无菌小鼠体内分别增加IgA、抗TFN α、IgM和IgG抗体水平。在胆固醇-心血管-疾病轴的背景下,Bact. dorei D8可以在体外将胆固醇转化为粪甾醇。在肥胖相关代谢疾病的背景下,口服Bact. uniformis CECT 7771在高脂饮食喂养的小鼠中显示出抗肥胖、抗糖尿病和免疫调节作用。同时, Bact. vulgatus对小鼠模型有抗糖尿病作用。普氏菌属Prevotella,也属于拟杆菌门,在遵循传统生活方式和食用新鲜未经加工食品的人群中更为普遍。报告中还提到了P. copri对宿主健康的积极和消极影响。De Vadder等人强调了P. copri通过肠道糖异生改善葡萄糖稳态的重要性,这被认为是由于通过膳食纤维发酵合成了支链脂肪酸(琥珀酸)。拟杆菌门的另一种细菌,Parabacteroides goldsteinii,在体外显示了抗肥胖、抗炎和胰岛素增敏的作用,使其成为一个可能进一步探索的合适的NGP候选细菌。 表2. 研究的不同 NGP 候选物的主要特征和效果



在厚壁菌门中,主要为粪杆菌属Faecalibacterium、梭菌属Clostridium、真杆菌属Eubacterium,和克里斯滕森菌属Christensenella已被研究认为属于NGPs。F. prausnitzii约占健康成年人粪便微生物总数的5%,有几篇报道提到了这个菌种在肠道和代谢紊乱患者中的减少,此外,一些研究人员声称该菌种是治疗溃疡性结肠炎(UC)和克罗恩病(CD)的首选生物标志物。研究人员已经阐明了F. prausnitzii在维持肠道稳态和完整性方面的作用,因为它能够产生短链脂肪酸(SCFA),特别是丁酸。F. prausnitzii也被报道诱导与IBD相关的调节性T细胞的增殖。Faecalibacterium对用于肿瘤改善的免疫检查点封锁(ICB)治疗的疗效有积极的影响,这从肿瘤环境内CD8+T细胞浸润增加以及外周效应CD4+和CD8+ T细胞频率增加可见一斑。这些发现突出了这种细菌作为治疗药物和癌症患者预后标志物的巨大潜力。几种梭状芽胞杆菌(Clostridium acetobutylicum, C. beijerinckii, C. butyricum, C. cellulolyticum, C. ljungdahlii, C. thermocellum)也已经显示出它们作为NGPs的潜力。研究人员利用丁酸梭菌C. butyricum MIYAIRI 588治疗艰难梭菌C. difficile感染、幽门螺杆菌Helicobacterpylori感染、心血管疾病(CVDs)和癌症。一些不产毒的丁酸梭菌C. butyricum也被发现可以提高肺癌患者的疗效,减少化疗引起的问题。Udayappan等人观察到,肥胖和糖尿病的db/db小鼠在给药后,霍氏真杆菌Eubacterium hallii改善了胰岛素敏感性,并增加了能量代谢。这种效应归因于霍氏真杆菌E. hallii在发酵葡萄糖和发酵中间体(乙酸和乳酸)时产生短链脂肪酸(丁酸和丙酸)的能力。而另一些人提出了这种代谢多功能性,这是霍氏真杆菌能够恢复宿主肠道微生物群稳态、改善DSS诱导的小鼠结肠炎的一个重要因素。其他研究人员将E. limosum的肠道丰度与血液系统恶性肿瘤患者异源造血干细胞移植(HSCT)治疗后疾病复发和进展的风险降低相关联了起来。另一项研究表明,克里斯滕森菌Christensenella minuta对肥胖和相关代谢紊乱的益生菌效应,因为他们观察了受体小鼠肥胖相关微生物模式的改变。作者还报道了克里斯滕森菌Christensenellaminuta在低体重指数(BMI)个体中的丰度。肠球菌属Enterococcus被认为是耐药感染病原体的有益肠道共生体。非人类来源的肠球菌Enterococcus菌株已经作为动物益生菌在可通过商业途径获得。与无反应的患者相比,在对PD-1-PD-L1阻断有反应的癌症患者的粪便样本中也观察到Ent. Hirae的丰富程度。还有研究报告了Ent. hirae的预后影响,其在非小细胞肺癌(NSCLC)或卵巢癌患者中促进免疫原性化疗的能力,这是由于记忆T细胞的活性增强导致的。此外,厚壁菌门的另一种细菌,Pediococcus pentosaceus LAB6在体外条件下也显示出了降低胆固醇的作用。
研究人员以双歧杆菌属Bifidobacterium为主,研究放线菌门Actinobacteria,对其作为NGP候选菌种的潜力进行了评估。口服Bif. Breve和Bif. Longum的混合剂能显著增强抗PD-L1免疫治疗小鼠模型的抗肿瘤作用。增强的疗效归因于DCs的激活,导致了增强的CD8+ T细胞启动和肿瘤微环境内的积累。双歧杆菌Bifidobacterium spp.在肿瘤发展及结肠炎和大肠癌CRC治疗方面也得到了广泛关注。在另一项研究中,共生物(抗淀粉和Bif. Lactis)在azoxymethane (AOM)/ DSS诱导的大鼠结直肠癌模型中显示出改善结直肠癌发展的作用。同样,用富含低聚果糖菊粉、Bif. Lactis和Bif. Lactis的干预能显著改善结肠切除和结肠癌患者的免疫功能。Rong等人也将CD8+ T细胞记忆反应的增强与Bif. Longum和E. hirae混合物在HBV相关肝细胞癌患者中的应用预后影响相关联。Matson等人观察到了抗pd -1抗体治疗对临床黑色素瘤ICB患者粪便样本中Bif. longum, C. aerofaciens和Ent. faecium的影响。然而,需要更多的独立队列研究来验证ICB的结果下的C. aerofaciens疗效。同样地,Burkholderia cepacia(变形菌门)单独或与B. fragilis联合使用,通过刺激抗生素处理的小鼠的TH1细胞免疫反应,显著提高CTLA-4阻断的疗效和耐受性。人类粪便起源的Gordonibacterurolithinfaciens和Gordonibacter pamelaeae属于放线菌门Eggerthellaceae家族,其作为潜在的NGP的潜力在于它们能够将鞣花酸(存在于核桃、草莓和石榴中)转化为尿路代谢物的能力。尿石素A和B以及异尿石素A是关键的代谢物,具有抗炎、抗癌、保护心脏和保护神经的特性。因此,服用鞣花丹宁可以改善健康状况。来自Verrucomicrobia门的Akkermansiamuciniphila占肠道细菌的5%,利用粘液蛋白作为碳、氮和能量的唯一来源。减少
A. muciniphila
的作用表现为改善代谢综合症和自身免疫性疾病。此外,在一个早衰的小鼠模型中,A. muciniphila被认为具有调节宿主代谢和免疫的能力。此外,它还与减少小鼠肥胖症和胰岛素抵抗的发展、抗癌免疫疗法(如抗PD-1治疗)的疗效增强以及改善小鼠肌萎缩侧索硬化症的效果有关。此外,Li等人报道,给予A. muciniphila可以逆转动脉粥样硬化病变,改善代谢性内毒素血症引起的炎症,并最终恢复Apoe-/-小鼠的肠道屏障。即使A. muciniphila显示出许多有益的作用,然而,其他一些动物研究报告了A. muciniphila在高脂血症小鼠中的丰度增加以及多发性硬化(MS)和帕金森病的相反情况。有必要对A. muciniphila的改善作用进行更多研究。这里值得一提的是,NGP包括以前没有安全使用历史的共生菌。此外,像传统的益生菌一样,NGP的有益作用也是菌株特定的。由于这些共生菌在特殊情况下可能成为机会性病原体,因此在人类应用之前必须保证其安全性。梭菌Clostridium、拟杆菌Bacteroidetes和肠球菌Enterococcus的一些菌株因其产生毒素的能力而闻名,并与各种感染有关。此外,人们对NGP的研究还处于初始阶段;因此,有必要对已确定的NGP进行详细的功能和安全性研究。 4 选择潜在的NGPNGP的鉴定并不像传统益生菌那样容易,因为目标生物可能无法培养。NGP的确认涉及不同的阶段,如图2所示。首先,使用下一代测序(NGS)平台识别潜在的共生体是基于对宿主和肠道微生物群之间实际互动情况的理解。重要的是要考虑样品的质量,必须严格遵守精心设计的样品采集、储存、详细测序和数据解释的标准程序,以获得更准确和适用的结果。 
图
2. 常规用于开发 NGP 的策略说明
被鉴定的微生物需要进行属、种和菌株的鉴定。其他信息,如微生物的来源、菌株的历史和捐赠者的健康史都需要被记录下来。随后,使用先进的培养学技术分离出潜在的NGP,用于后续的功能验证研究。需要研究分离株的生理特性,如对GIT恶劣条件的抵抗力;并且粘附粘膜的诀窍也很重要。分离株在细胞和分子水平上的疾病特异性改善作用需要在体外使用细胞系模型和在体内使用无特定病原体或GF小鼠的动物模型作为概念证明来进行。考虑到潜在的NGP的安全性,必须对健康和免疫抑制小鼠的毒性和耐药特性以及急性毒性研究进行基因组分析。综上所述,阐明参与宿主-NGPs相互作用的分子机制是最重要的。对NGPs及其代谢模式的全面理解可能为设计个性化的治疗策略提供有价值的信息。最近,NGP将通过1-3期临床人体研究来验证其疗效和效率。另外,值得强调的是,与传统的益生菌一样,NGP的有益作用也是菌株特异性和剂量依赖性的。 5 作为NGPs的设计型益生菌如前所述,术语NGPs还考虑了转基因微生物(GMMs),这些微生物通过添加、删除或过度表达特定基因来开发强大的益生菌菌株,涉及新陈代谢、技术压力耐受性、GIT生存能力以及治疗和/或预防分子的粘膜定向传递,以确认对宿主的一个或多个健康益处,从而衍生出用于预防或治疗各种疾病的“生物药物”概念。因此,利用分子编辑工具,可以进一步修改和探索已经证明的益生菌,以设计个性化药物。最近出现的CRISPR/Cas9基因组编辑工具提供了一个更好的平台,可以更精确地编辑基因组,以控制基因表达或提供新的功能,以加强宿主的定植和促进人类健康。然而,不同的菌株和方法的编辑结果可能不同。目前,这种益生菌工程战略的重点是提升现有益生菌的四个重要特性,如图3所描述。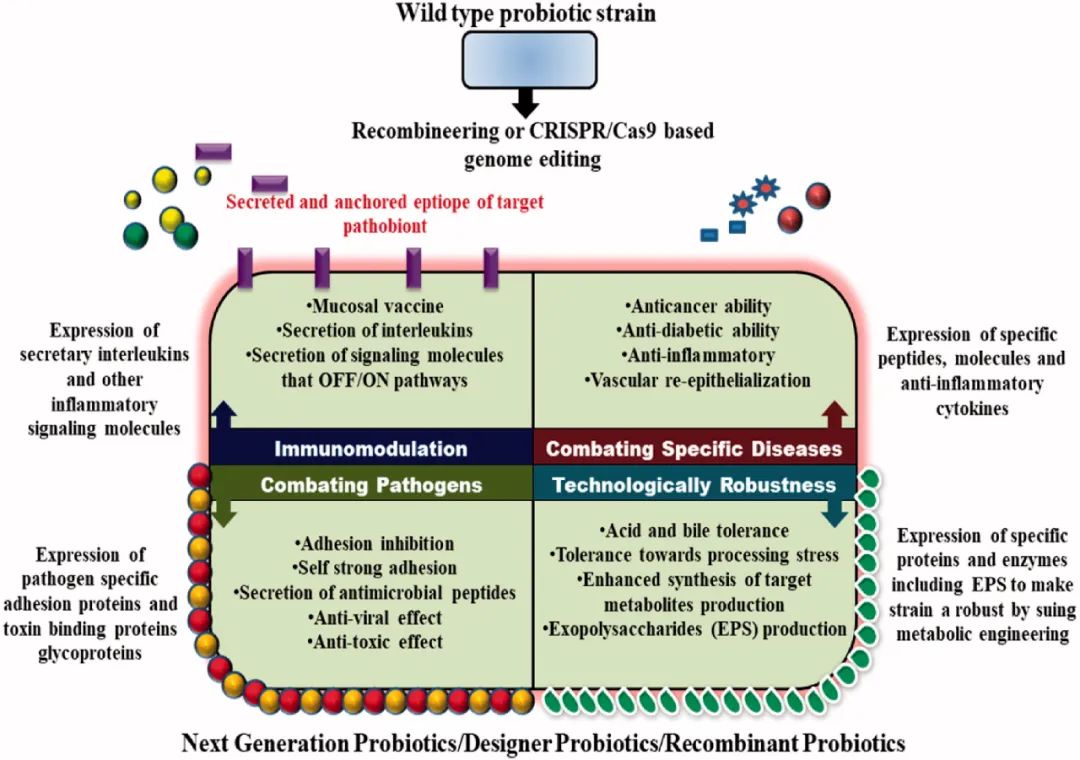
图3. 益生菌工程开发NGP与特定目标作用的途径 携带来自特定病原体的毒性基因的特制益生菌是用于遏制特定病原体感染的一种策略。例如,单核增生李斯特菌黏附蛋白(Listeria adhesion protein, LAP)是单核增生李斯特菌Listeria monocytogenes通过与宿主Hsp60相互作用而促进肠道黏附的蛋白,随后利用细胞内蛋白(InlA或InlB)通过细胞内途径侵入上皮细胞。利用pLP401-T表达载体克隆并在副干酪乳杆菌(Lactobacillusparacasei, LP)中表达。有趣的是,与野生型菌株相比,重组副干酪乳杆菌L. paracasei对Caco-2细胞表现出卓越的粘附能力,随后通过保护性、竞争性和置换模式对单核增生乳杆菌L. monocytogenes产生了显著的定植和内化抗性。此外,重组副干酪乳杆菌L. paracasei通过Caco-2单层降低了单核增生乳杆菌L. monocytogenes的经上皮易位。其次,靶向胃肠道感染和毒素是重组益生菌评估的另一个重要领域。在这方面,重组益生菌E. coli(CWG308)含有来自脑膜炎奈瑟菌Neisseriameningitidis或空肠弯曲菌Campylobacter jejuni的糖基转移酶基因,并表达嵌合脂多糖(LPS),能够高效中和ETEC不耐热肠毒素,从而阻止其被宿主细胞摄取,从而预防疾病。因此,作者认为,益生菌大肠杆菌E. coli(CWG308)可以成为治疗经肠易激综合征引起的旅行者腹泻的有效预防工具。迄今为止,该受体模拟益生菌已被用于中和霍乱毒素、志贺毒素(Stx)、产Stx的大肠杆菌E. coli STEC菌株的AB5毒素,以及志贺氏痢疾杆菌Shigella dysenteriae1型。开发用于大规模群体免疫的粘膜注射疫苗确实是世界卫生组织(WHO)的一个长期目标,以经济、物流和安全的输送途径克服传染病。口腔粘膜疫苗具有巨大的潜力,可以表现出更多的一般分泌免疫球蛋白A(IgA)反应,可以中和病毒或其毒素,抵制肠道微生物的定植。益生菌主要通过口服途径给药,有长期安全使用的历史,它们被认为是抗原、疫苗和治疗分子的有效粘膜传递载体,掩盖了传递功能蛋白的问题。此外,它是一种具有成本效益的方法,用于治疗粘膜相关疾病,并减少可能的副作用。另一方面,通过基因工程使益生菌表达目标抗原部分(多种蛋白质和其他分子)以引起特定的宿主反应是一种有针对性的方法。携带抗原部分的益生菌在粘膜递送后的结局是,DC细胞介导的抗原识别和加工,在滤泡相关上皮的M细胞的协助下摄取抗原并呈现给底层的免疫细胞。这些抗原呈递的DC细胞迁移到引流淋巴结(GALT)以触发T和B细胞反应。到目前为止,几种病毒抗原(猪细小病毒、猪轮状病毒、传染性支气管炎病毒、D型肝炎病毒、冠状病毒、口蹄疫病毒等)和细菌抗原(Bacillus anthracis, Borrelia burgdorferi, Clostridium botulinum,Clostridium perfringens, Clostridium tetani, Escherichia coli (ETEC),Helicobacter pylori, Salmonella enterica, Streptococcus mutans,Streptococcus pneumonia, Vibrio parahaemolyticus,Yersinia pseudotuberculosis,和Yersinia pestis)已在益生菌乳酸杆菌Lactobacillus spp.中成功表达(表面和细胞外),并在动物和人体试验中被发现可引起保护性免疫反应。但更有趣的是,很少有益生菌菌株通过克隆负责分泌抗炎细胞因子(IL10、可溶性TNF受体、三叶草因子)、超氧化物歧化酶的基因来克服炎症性疾病。 传统的益生菌无法更精确地治疗特定疾病,这使得它们的基因组发生改变,产生一种特定的分子,从而更有效地消灭目标疾病。在这方面,人们已经构建了一些重组益生菌,并被证明治疗是有效的,如糖尿病、癌症、IBD、细菌性阴道病等。例如,经上皮载体口服表达Ang-(1-7)的LP显示空腹血糖降低,腹腔葡萄糖耐量试验改善,血浆胰岛素水平升高,胰岛β细胞胰岛素表达增加。改造后的罗伊氏乳杆菌Lactobacillusreuteri RC - 14可产生抗HIV蛋白,阻断HIV进入人外周血单个核细胞,可能降低了HIV的性传播和随后的细菌性阴道病。最近,在高尿酸血症大鼠模型中,表达尿酸酶的基因工程益生菌大肠杆菌E. coli显示可降低尿酸含量和较高的脲酶。此外。表达LZ8蛋白的重组乳酸菌Lactococcus lactis对兔子模型的动脉粥样硬化和非酒精性脂肪肝(NAFLD)有改善作用,降低了IL-1β在主动脉中的基因表达,减少了内膜厚度和内皮下空间的泡沫细胞,因此由于其抗炎作用,表达乳球菌的LZ8将是一种很有前途的改善NAFLD和早期动脉粥样硬化形成的药物。 表3. 益生菌工程开发NGP与特定目标作用的途径

6 NGP 开发的技术功能挑战
为了将益生菌菌株商业化,需要仔细评估产品保质期内承受工艺处理、浓缩、冷冻干燥、产品掺入和活力控制能力等技术的功能稳健性,以研究其可行性。据我们所知,几个传统的细菌和酵母领域的益生菌目前已经在工业规模上生产,处理这些细菌菌株也许仍然是一个简单的任务,因为它们是微需氧的。值得注意的是,大多数假定的
NGP 候选物的极端氧敏感性显着阻碍了大规模生产。此外,一些现有的工业工厂设计和工艺流程不能显着地创造厌氧微环境来利用单位时间内最大的活细菌细胞。此外,在不需要微胶囊化的情况下,将这种细菌引入食品系统将是一项艰巨的任务,因为搅拌将导致空气的混入,从而发展出不利的有毒生态位。此外,作为冻干浓缩物的细菌生物量的生产需要在特定的厌氧条件下进行冷冻干燥,并加入潜在的低温保护剂,这需要微生物质量控制步骤来监测其他微生物污染物和活细胞计数。此外,为了在厌氧条件下有效地进行微胶囊化,低含水率要求对冻干菌群进行粉碎,其中粉碎后的粉末应满足粉体的润湿性、分散性和沉降性等特性。另一方面,所有NGP的具体营养需求尚未阐明。然而,少数经过充分研究的NGP物种需要复杂的营养需求,这需要实验室规模的粘蛋白、瘤胃液、血清肉汤等。因此,迫切需要进一步研究以开发一种经济可行且适合大规模培养 NGPs 的培养基。这一系列的技术因素给希望从共生肠道细菌中配制NGP 疗法的工业家们带来了潜在的障碍。 7 NGP监管指南益生菌的商业探索需要全球不同的最高机构的监管批准。尽管益生菌主要是作为食品补充剂在市场上销售,但根据其预期用途,在不同的国家有几个分类。例如,益生菌在美国被细分为膳食补充剂/药物/活体生物治疗剂/医用食品,在日本/印度/中国/马来西亚为功能食品,在欧洲国家/比利时/德国为生物治疗剂,在意大利为膳食食品,在加拿大为天然健康产品,在丹麦/瑞典/芬兰为食品补充剂。这些国家已经开发了他们的监管系统,以保证候选益生菌在保证安全事务后获得批准。例如,日本的特定健康用途食品(FOSHU)、英国的联合健康声明倡议(JHCI)、美国的食品和药物管理局(FDA)和膳食补充剂健康和教育法(DSHEA)、欧洲的欧洲食品安全局(EFSA)、中国的国家食品和药物管理局(SFDA)等监管机构。印度的印度食品安全与标准局(FSSAI)、加拿大的《天然保健品条例》下的《加拿大食品与药品法》、马来西亚的药物管制局的食品安全与质量司(FSQD)、国家药品管制局(NPCB)和巴西的国家卫生监督局,都已得到世界认可。总的来说,粮农组织/世卫组织的联合专家顾问根据科学建议,协调确保益生菌的健康和营养特性。由于EFSA是欧盟的负责任的监管机构,EFSA科学委员会为用于食品和饲料的微生物提供了关于合格安全推定(QPS)状态的通用概念。根据这一点,符合 QPS 条件的有益微生物的数量最近被重新审视,除了双歧杆菌属之外,该名单不包含任何肠道衍生的NGP或工程益生菌。然而,源自细菌或酵母的活性物质的生物医药产品需要欧洲药品管理局的授权和批准。此外,生物仿制药工作组(BMWP)建议人用医药产品委员会(CHMP)对生物仿制药产品进行监管评估(https://www.ema.europa.eu/en/human-regulatory/research-development/innovation-medicines; https://www.ebe-biopharma.eu/biotherapeutics/)。同样,欧洲药品质量管理局(EDQM)于 2014 年成立了一个活体生物治疗产品工作组,以制定 LBP 的专论,以协调 LBP 作为生物医药产品的质量标准。在美国,当作为食物使用时,活微生物属于食品或膳食补充剂的范畴,当作为药物使用时,则属于LBP的范畴。在这种情况下,根据从人类宿主中分离的共生微生物(NGPs)的疾病特异性用途,将它们归类为LBP。此外,美国食品和药物管理局的生物制品评估和研究中心(CBER)对LBP部分进行监管。CBER要求在表型和基因型层面对益生菌进行严格的体外表征,包括特性、抗菌性、突变、毒力因子和缓解疾病的作用方式。为了成功获得上市批准,LBP应经过精心设计的临床前和临床试验,以评估益生菌的安全性、功效和效力。 结论传统的益生菌在作用上是通用的,但仅限于有限范围的生物体。了解肠道微生物群及其与宿主健康状态的独特关系已经改变了这一模式,并扩大了探索系统发育中广泛的生物体的范围。深入了解与特定共生物相关的健康益处的科学研究,可能会导致发现新的微生物,并进一步探索设计特定疾病的个性化药物。最终,这些研究可能会发现具有不寻常特性的不明微生物,有些可能属于众所周知的致病群体,给研究、工业开发和监管机构带来困难。这种促进健康的非传统微生物通常被称为NGPs;如果用于制药,其本身就受美国食品和药物管理局的LBP指南的监管。识别NGP是最具挑战性的,因为它完全是一种基于假设的方法,主要是基于比较健康和患病对象之间的微生物相对丰度水平的相关研究。一旦确定,必须使用适当的实验、体外和体内模型对生物体的各种功能、安全和技术参数进行验证。需要考虑不常见的生长要求,以实现LBP的大规模生产,并且配方必须确保培养物的活力和生物活性,直到被消费。开发的产品必须通过1-3期临床试验对安全性、有效性、效率和剂量进行检查,并必须通过监管机构的批准。总之,NGP的概念尚处于起步阶段,但前景广阔,需要进行广泛的研究,以便将其开发为预防药物。
|