肿瘤病理诊断规范 第8部分:肝癌病理诊断规范 |
您所在的位置:网站首页 › 肝癌的诊断报告模板 › 肿瘤病理诊断规范 第8部分:肝癌病理诊断规范 |
肿瘤病理诊断规范 第8部分:肝癌病理诊断规范
|
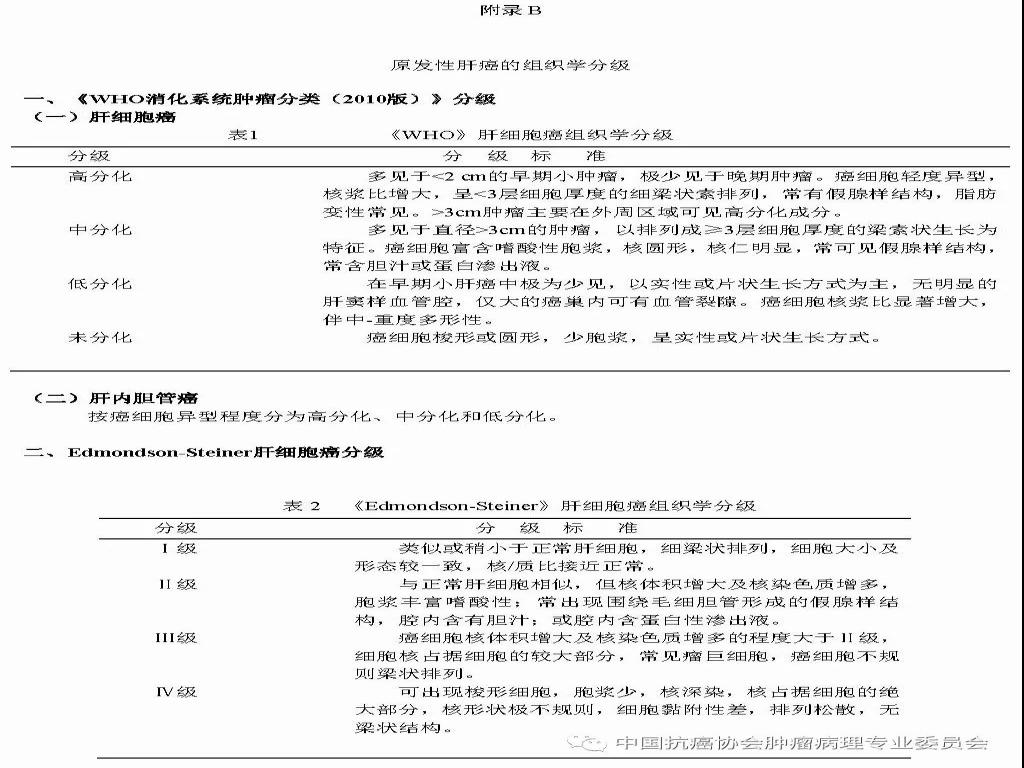
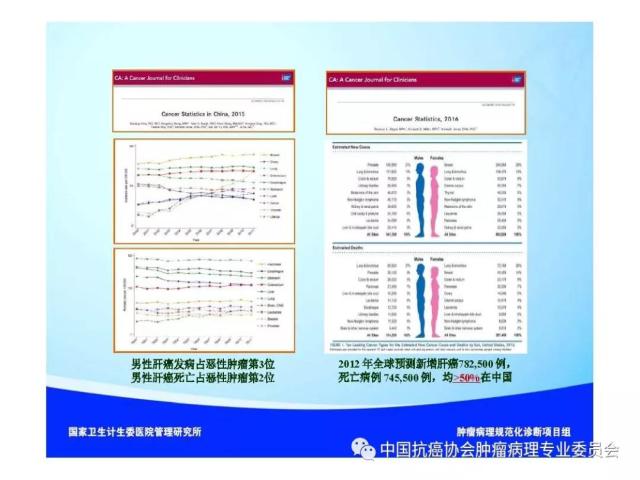
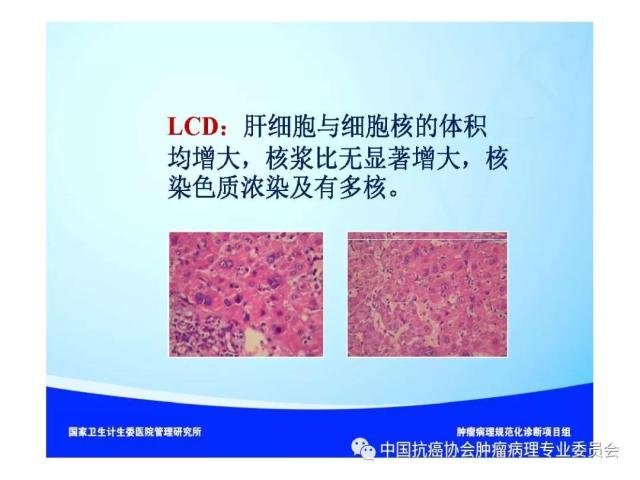
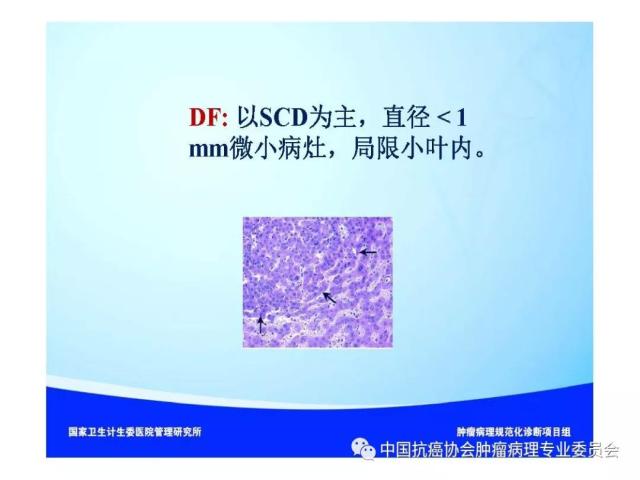
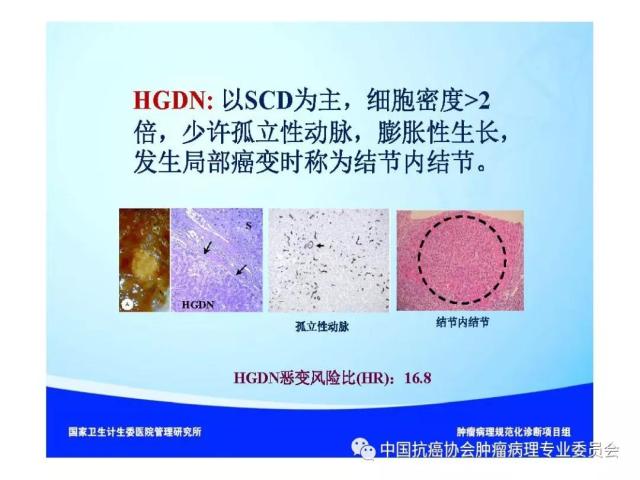
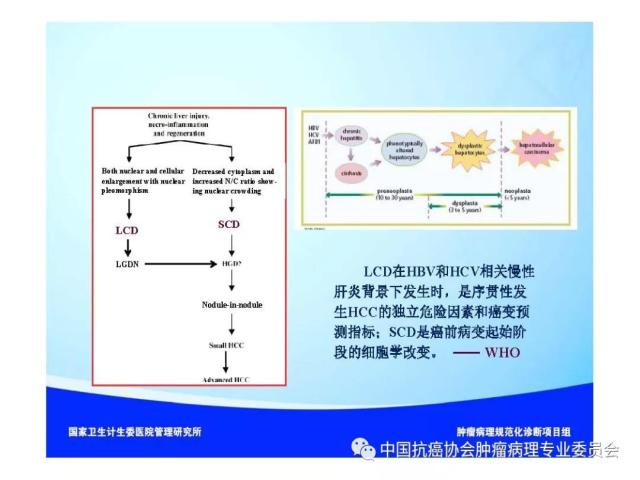
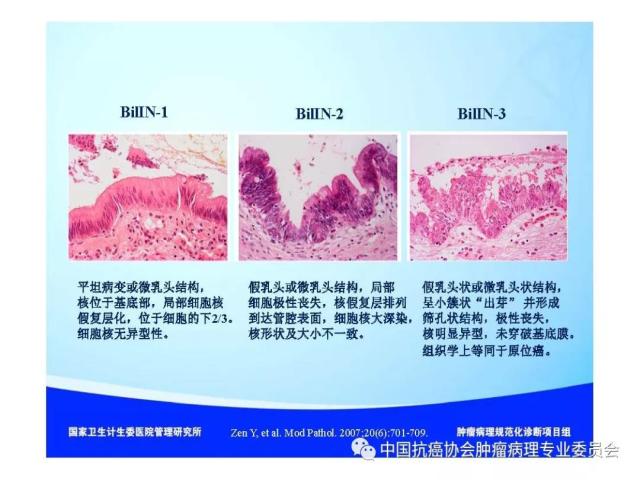
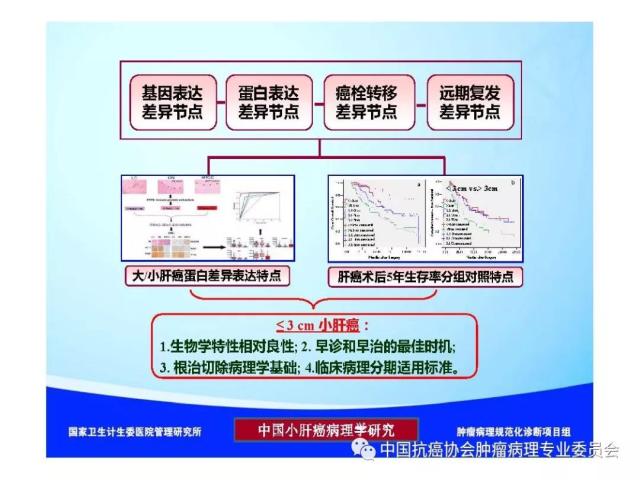
来源:中国抗癌协会肿瘤病理专业委员会 本规范起草单位:第二军医大学东方肝胆外科医院、复旦大学附属中山医院、空军军医大学(原第四军医大学)西京医院 本规范起草人:丛文铭、纪元、李增山 1.范围 本规范规定医疗机构病理科或其他具备相应资质的实验室进行肝癌病理诊断工作的基本原则、通用操作规范以及相关临床与管理部门的职责与要求。 本规范适用于医疗机构病理科、承担肿瘤病理诊断的病理教研室、独立实验室等机构(以下简称病理科)。 2.规范性引用文件 下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 《中华人民共和国执业医师法》 《临床技术操作规范-病理学分册》 《病理科建设与管理指南(试行)》(卫办医政发(2009)31号) WHO《消化系统肿瘤组织学分类(2010版)》 AJCC/UICC《肝癌TNM分期(第八版)》 中国《原发性肝癌规范化病理诊断指南(2015年版)》 3.术语和定义 3.1 原发性肝癌(Primary liver cancer) 原发性肝癌(简称肝癌)统指起源于肝细胞和肝内胆管上皮细胞的恶性肿瘤,其中以肝细胞癌(hepatocellularcarcinoma,HCC)和肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)最为常见。 3.2 肝细胞异型增生(Liver cell dysplasia) 是肝细胞癌的癌前病变在细胞学水平上的表现形式,根据肝细胞的异型程度分为两类。 (1)大细胞异型增生:也称大细胞变。主要特点是肝细胞与细胞核的体积均增大,因而核浆比无显著增大,核染色质浓染及多核,细胞出现多形性改变。在HBV和HCV相关慢性肝炎背景下发生大细胞异型增生,是序贯性发生HCC的独立危险因素和癌变预测指标。 (2)小细胞异型增生:也称小细胞变。主要特点是肝细胞体积缩小,核浆比增大,核密度增高伴轻度异型,细胞多形性改变不明显,是癌前病变起始阶段的一种细胞学改变。 3.3 肝细胞异型增生灶 (Liver cell dysplastic foci) 显微镜下由小细胞异型增生构成的直径≤1. 0 mm 的微小结节性病灶。 3.4 异型增生结节 (Dysplastic nodule,DN) DN是在影像学和大体标本检查时可见的一类肝细胞癌癌前病变,结节直径从数毫米~数厘米不等,多在1.5cm以下,患者多有HBV/HCV感染相关慢性肝炎及肝硬化背景。根据肝细胞异型性的大小可分为以下三种类型: 3.4.1 低度异型增生结节(Low grade dysplastic nodule,LGDN) 以大细胞异型增生为主构成的增生结节,病灶间质内无孤立性小动脉,无膨胀性生长。 3.4.2 高度异型增生结节(High grade dysplastic nodule,HGDN) 以小细胞异型增生为主构成的结节,细胞形态较一致,病灶间质内可出现孤立性动脉,对周围肝组织可有膨胀性或挤压性生长,当发生局部癌变时称为结节内结节(nodule-in-nodule)。HGDN需注意与高分化小肝细胞癌鉴别,后者常表现为细胞的核/质比和排列密度增加、小梁间隙增宽、假腺管结构、浸润性生长、免疫组化染色显示CD34阳性微血管密度增高、Ki-67表达增加、p53和GPC-3阳性,以及网状纤维染色显示病灶内网状支架减少或消失等特点。 3.5 微血管侵犯 (Microvascular invasion,MVI) 指在显微镜下于包膜内或癌旁肝组织中由内皮细胞衬覆的静脉血管腔内见到实性癌细胞巢团,其中以门静脉分支的MVI最为多见。当脉管腔内出现松散的悬浮癌细胞时,癌细胞数目≥50个与患者预后相关,可计为MVI。此外,肝细胞癌偶可侵犯淋巴管、肝动脉和胆管分支,肝内胆管癌除了可以发生MVI,还常出现淋巴管侵犯,因临床意义不同,可分别描述和报告。区分各类脉管类型可借助相应免疫组化染色,如可选用CD34标记血管内皮、SMA标记血管壁平滑肌、弹力纤维染色标记血管壁弹力纤维以及D2-40标记淋巴管内皮等。MVI是肝癌术后复发风险和预后的重要预测指标,也是临床肝癌术后抗复发治疗和预后评估的重要病理学指征,肝脏外科极为关注,应参照中国《原发性肝癌规范化病理诊断指南(2015年版)》,对MVI进行常规病理诊断和分级(见6.4 微血管侵犯(MVI)分级)。 3.6 卫星结节(Satellite nodule) 卫星结节(或子灶)是指主瘤周边肝组织内出现的肉眼或显微镜下的小癌灶,与主瘤之间有肝组织相隔,多来源于肝内转移(如MVI),但也可能是新生癌灶。 3.7 小肝细胞癌(Small hepatocellular carcinoma,SHCC) 指单个肿瘤,瘤体最大直径≤3 cm的肝细胞癌。 3.8 胆管上皮内瘤变(Biliary intraepithelial neoplasia,BilIN) 以胆管上皮细胞异型增生、细胞核复层排列并向管腔内呈微乳头状突起为基本特征。根据BilIN的异型程度可分为以下三个级别: 3.8.1 低级别BilIN (BilIN-1) 平坦病变或微乳头结构。核位于基底部,局部细胞核假复层化,但位于上皮细胞的下2/3。细胞核呈卵圆形,有轻微的核膜不规则及核/浆比增大。 3.8.2 中级别BilIN(BilIN-2) 平坦病变、假乳头或微乳头结构。局部细胞极性丧失,核假复层排列到达管腔表面。细胞核大深染,核膜不规则,核形状及大小不一致,核仁明显,核分裂少见。 3.8.3 高级别BilIN(BilIN-2) 假乳头状或微乳头状结构,细胞向管腔内呈小簇状“出芽”并形成筛孔状结构。细胞极性广泛丧失,出现显著的核大深染、核膜不规则、核分裂等恶性表现,但无穿破基底膜的侵犯。高级别BilIN具有高度恶变风险,通常认为在组织学上等同于原位癌。 4.标本类型及固定 4.1 标本类型 包括肝脏穿刺活检标本、楔形切除活检标本、腹腔镜下切除标本、部分肝脏切除标本和肝移植受体病肝切除标本等。 4.2 标本固定 4.2.1 标本的一般采集与送检、编号与登记等过程参见总则。 4.2.2 对肝脏肿瘤标本还应注意把握以下处理原则:(1)为最大限度地保留细胞内核酸和蛋白质的完整性,防止细胞自溶,应尽可能将肝脏标本在离体30 min 以内送达病理科切开固定;(2)病理科接受标本后,在不影响病理诊断的前提下切取新鲜组织冻存于组织库,以备分子病理学检查之用;(3)沿瘤体最大直径,每隔1cm 做一个剖面,并保持标本的连续性;(4)常温下 10% 中性缓冲福尔马林溶液4 倍~5倍于标本体积固定,肝穿刺标本固定时间1 h~4 h,手术切除标本固定时间12h~24 h。上述处理基本能够满足分子病理学和免疫病理学诊断的需要。 5.取材及大体描述规范 接收标本时,首先必须核对姓名、性别、年龄、门诊号/住院号或HIS序列号、床位号及临床诊断等信息是否完整,按外科医生的标示确定送检标本的名称、部位和数量。 5.1 部分或全肝脏切除标本 5.1.1 大体检查及记录 手术医生应在病理申请单上标注送检标本的种类和数量,对肿瘤方位、手术切缘、可疑病变以及重要血管和胆管的切缘可用染料染色或缝线标记,对切除小组织标本及淋巴结等应单独放置容器内并贴好标签说明,必要时联系手术医生明确标本的解剖学部位。除描述和记录送检肝脏标本的一般特点外,应测量肝组织、肿瘤或可疑病变三个径线的大小,重点关注病灶的数量、颜色、质地、与血管和胆管的关系、包膜形成与侵犯、周围肝组织肝硬化类型、肿瘤至切缘的最近距离以及切缘受累等情况,并对形态特殊的肿瘤标本拍照存档,记录每块组织所对应的切片总数及编号。 5.1.2 取材 根据我国《原发性肝癌规范化病理诊断指南(2015版)》,肝癌的外周区域是肿瘤异质性的代表性区域,是高侵袭性细胞群体集中分布的区域,是微血管侵犯和卫星结节形成的高发区域,也是影响转移、复发和预后的高风险区域。鉴于肝癌(HCC/ICC)的侵袭行为(如MVI和卫星结节)发生部位变异较大,因此应特别重视在癌与癌旁肝组织交界处进行多点取材,以便客观评估肝癌的生物学特性(如MVI发生率等)。对完整切除的肝癌标本推荐采用 “7点”基线取材方案(图1)。 (1)选取出血坏死少、组织完整的剖面,分别在12点、3点、6点和9点的位置上于癌与癌旁肝组织交界处取材,癌与癌旁肝组织的比例为1:1,以着重观察肿瘤细胞对包膜、微血管以及邻近肝组织的侵犯情况。 (2)在肿瘤中央无出血和坏死的部位至少取材1 块,以供分子病理学检查之用,对质地和色泽有差异的肿瘤区域应增加取材。 (3)对距肿瘤边缘≤1cm(近癌旁肝组织)和>1 cm(远癌旁肝组织)范围的肝组织分别取材,手术切缘组织取材应酌情包含于近癌旁或远癌旁组织块中。 (4)肝内胆管癌与肝细胞癌的取材模式基本相同,但对于管周浸润型胆管癌还应注意在胆管切缘取材。 (5)取材时应做好组织块的部位编号,以便显示肿瘤侵犯的部位或方位,组织块大小的要求参见《肿瘤病理诊断规范》总则。
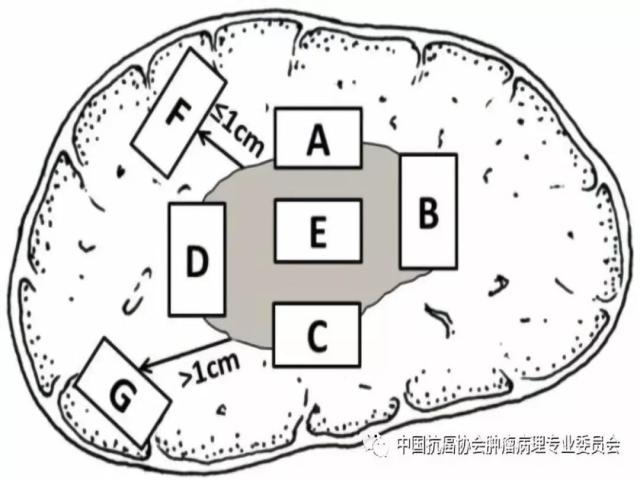
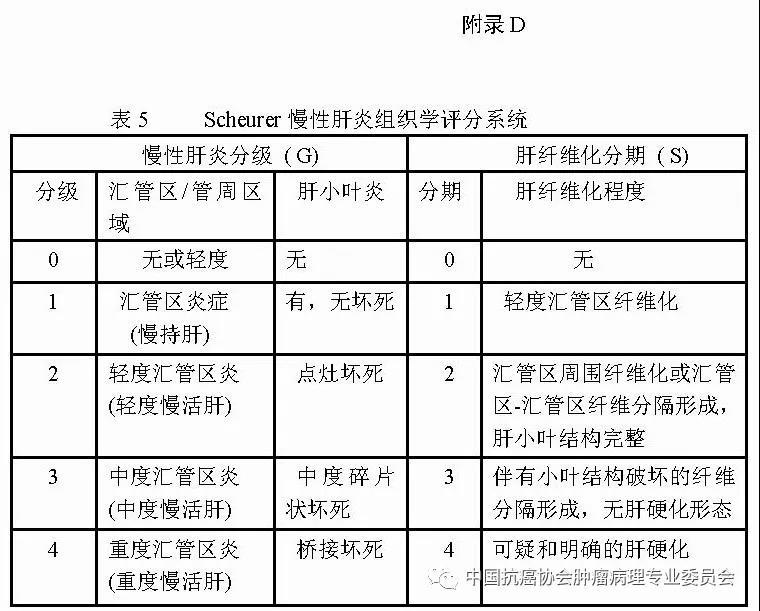
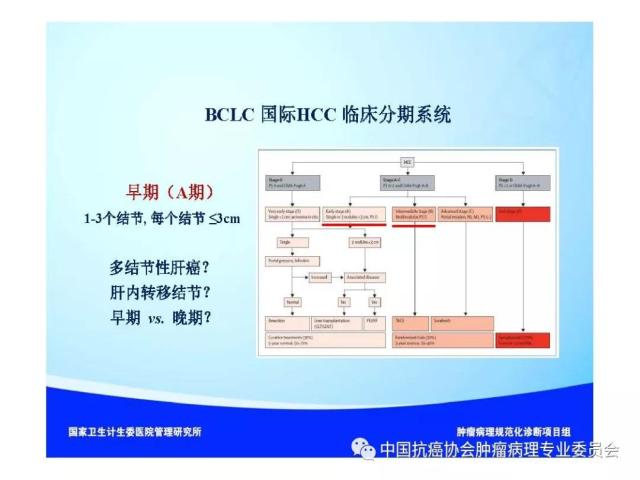
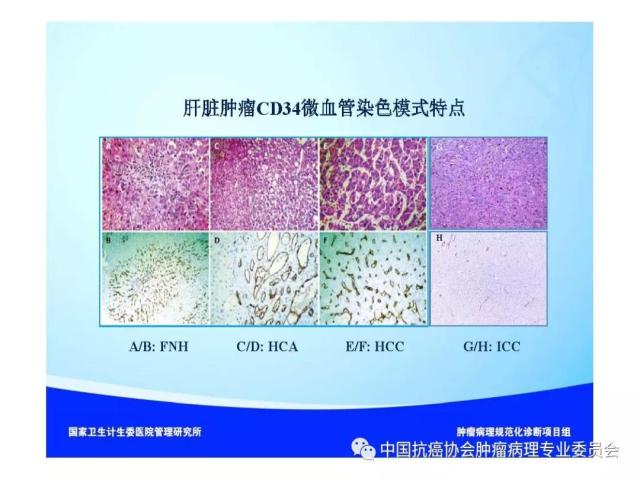
图1 肝脏肿瘤标本“7点”基线取材部位示意图 编号A、B、C和D:分别对应12点、3点、6点和9点的癌与癌旁肝组织交界处;编号E:肿瘤组织内部区域;编号F:近癌旁肝组织区域(或含切缘);编号G:远癌旁肝组织区域(或含切缘) 建议 1:肝癌标本“7点”取材方案仅是一种基线取材方案,实际取材的部位和数量还须根据肿瘤的直径、形状和数量等情况酌情增减,并注意在多剖面检查的基础上,对癌旁肝组织的可疑病灶重点取材。 建议 2: 当肿瘤距肝切缘较近时,可在距肿瘤最近的切缘处做垂直于切缘取材,以实际评估肿瘤与切缘的距离;当肿瘤距切缘较远时,可沿切缘做平行取材,以最大面积评估切缘肝组织的状态。 建议 3:≤3cm的SHCC多表现出分化好、膨胀性生长、无或少有微血管侵犯等相对温和的生物学行为,具有根治性治疗的病理学基础。但部分SHCC也可以出现明显的微血管侵犯和卫星结节形成。因此,对≤3cm的SHCC的肿瘤组织可全部取材检查,临床上对≤3cm的SHCC也应注意保留一定的治疗界限。 5.2 肝脏穿刺活检标本 5.2.1 大体检查及记录 标明穿刺组织的数目、色泽和大小(包括直径和长度)。 5.2.2 取材 对肝占位性病变通常采用16G穿刺针,标本长度宜>1.5cm,于肿瘤和瘤旁组织的交界处穿刺1条,或于肿瘤和瘤旁肝组织各穿刺1条,以便相互对照更有利于做出正确诊断。送检组织应全部取材制片,每例标本切取≥6张连续性组织切片,肝穿刺活检标本不宜行术中快速冰冻病理诊断。 6.常规病理诊断内容 6.1 大体标本描述(见5.1.1-5.1.2) 6.2 组织学类型(附录A) (1)肝细胞癌的常见组织学类型:细梁型、粗梁型、假腺管型和团片型等。 (2)肝细胞癌的特殊细胞学类型:如双表型、纤维板层型、硬化型、淋巴上皮瘤样型、肉瘤样型和未分化型等。 (3)肝内胆管癌:以腺癌最为常见,也可以出现肉瘤样癌和鳞状细胞癌等少见的组织学和细胞学类型。 (4)混合型肝细胞癌-胆管癌:单结节肿瘤组织内同时含有肝细胞癌和肝内胆管癌两种组织学成分,并分别表达各自的蛋白 标志物。 6.3 组织学分级(附录B) (1)肝细胞癌分化程度:可采用WHO的四级分级法(高、中、低和未分化),亦可采用国际上早期经典的Edmondson-Steiner四级分级法,目前在国际上仍有较多使用,两者的对应关系大致为高分化对应Ⅰ-Ⅱ级,中分化对应Ⅲ级,低分化或未分化对应Ⅳ级。 (2)肝内胆管癌分化程度:分为高、中、低分化。 6.4 微血管侵犯(MVI)分级 M0:未发现MVI。 M1(低危组):≤5个MVI,且发生于近癌旁肝组织(≤1cm,包膜内/包膜旁)。 M2(高危组):>5个MVI;或MVI发生于远癌旁肝组织(>1cm)。 6.5 肝癌的TNM分期方案(附录C) 建议在临床和病理资料齐全时对肝细胞癌和肝内胆管癌分别进行pTNM分期。目前AJCC/UICC出版了第8版(TNM-8)《原发性肝癌TNM分期系统》,并计划于2018年开始在全球应用,与第7版(TNM-7)的对照见附录C,在使用时注明TNM分期版本。 6.6 卫星结节的病理评估 (1)卫星结节的数量。 (2)卫星结节的分布范围(近癌旁肝组织;远癌旁肝组织)。 注:多结节性肝癌或在癌旁肝组织内出现的卫星结节,既可能是肝内转移灶,也可能是新生肿瘤,有条件时可选做克隆检测以明确癌灶的克隆起源性质。 6.7 癌旁肝组织慢性肝炎的病理评估(附录D) 肝癌常伴随不同程度的慢性病毒性肝炎或肝硬化,推荐采用Scheuer等国际公认和简便的肝脏炎症(G)分级和肝纤维化(S)分期系统,常规进行GS病理评估,为临床后续治疗提供指导依据。应注意以远癌旁肝组织表现作为评估对象,以避免癌组织的影响。 7.免疫组织化学检查 肝癌免疫组化检查的主要目的是:①肝细胞性良、恶性肿瘤之间的鉴别;②肝细胞癌与肝内胆管癌以及其他特殊类型的肝脏肿瘤之间的鉴别;③原发性肝癌与转移性肝癌之间的鉴别。由于肝癌的高度异质性,现有的肝癌细胞蛋白标志物在诊断的特异性和敏感性上均存在某种程度的不足,因而常需要合理组合、客观评估,有时还需与其他系统肿瘤的标志物联合使用。 7.1 肝细胞癌 7.1.1 以下标志物对肝细胞标记阳性,有助于提示肝细胞来源的肿瘤,但不能作为区别肝细胞性良恶性肿瘤的依据。 ①精氨酸酶-1(Arginase-1):肝细胞浆/胞核染色。 ②肝细胞抗原(Hep Par-1):肝细胞浆染色。 ③CD10:肝细胞的肝细胞膜毛细胆管面出现特异性染色,非肝细胞呈细胞浆阳性; ④多克隆性癌胚抗原(Polyclonalcarcinoembryonic antigen; PCEA):肝细胞的肝细胞膜毛细胆管面出现特异性染色,非肝细胞呈细胞浆阳性。 7.1.2 以下标志物肝癌细胞染色阳性,癌旁肝细胞阴性,有助于提示肝细胞癌。 ①磷脂酰肌醇蛋白-3(Glypican-3;GPC-3):肝癌细胞浆及细胞膜染色。 ②热休克蛋白70(HSP70):肝癌细胞浆或细胞核染色。 ③CD34:CD34免疫组化染色虽然并不直接标记肝脏实质细胞,但可显示不同类型肝脏肿瘤的微血管密度及其分布模式特点:如肝细胞癌为弥漫型、肝内胆管癌为稀疏型、肝细胞腺瘤为斑片型、肝局灶性结节性增生为条索型等,结合组织形态学有助于鉴别诊断。 ④谷氨酰胺合成酶(Glutamine synthetase; GS):肝癌呈弥漫性细胞浆强阳性,而正常肝组织内仅中央静脉周围的少量肝细胞呈灶性阳性。此外,GS在肝局灶性结节性增生呈特征性的“地图样”染色;在HGDN为中等强度灶性染色,阳性细胞数 7.2 肝内胆管癌 ①上皮细胞表面糖蛋白MOC31:胆管细胞膜染色。 ②细胞角蛋白CK7/CK19:胆管细胞胞浆染色。 ③黏蛋白-1(MUC-1):胆管细胞膜染色。 上述标志物在非肿瘤性胆管上皮也可以阳性表达。 7.3 混合型肝细胞癌-胆管癌combined hepatocellular-cholangiocarcinoma;cHCC-CC cHCC-CC组织内的肝细胞癌和肝内胆管癌两种肿瘤成分分别表达上述各自肿瘤的特异性标志物。此外,CD56、CD117和EpCAM等标志物阳性表达则可能提示cHCC-CC伴有干细胞分化特征,侵袭性更强。 7.4 双表型肝细胞癌 dualphenotype of hepatocellular carcinoma;DPHCC 是肝细胞癌的一种特殊亚型,表现为形态学上典型的肝细胞癌但可同时显著表达肝细胞癌和胆管细胞癌的标志物,需要通过免疫组化检查才能做出诊断。DPHCC具有肝细胞癌和胆管细胞癌的双重表型特征和双重生物学行为,因而恶性程度更高,预后更差,而正确的病理诊断可为临床个体化诊疗提供精细的病理学依据。 7.5 细胞增殖活性标志物 Ki-67(MIB-1)染色计数阳性肿瘤细胞占肿瘤细胞群体的百分比,可用于辅助评估癌前病变(如HGDN和高级别BilIN)和肿瘤细胞的增殖活性以及辅助鉴别良恶性。 8.分子病理检测 复发性肝癌和多结节性肝癌是制约临床疗效的瓶颈,也是临床的重要关切。复发性肝癌和多结节性肝癌的发生均存在单中心(单克隆性)和多中心(多克隆性)两种起源模式,与临床治疗模式的选择和预后密切相关。为此,建议有条件时可采用克隆检测的方法评估复发性肝癌和多结节性肝癌的克隆起源方式,为临床制订个体化治疗方案提供参考依据。 9.肝癌病理诊断报告推荐格式(附录E) 肝癌病理诊断报告应突出肝脏专科病理特点,注重回应临床对了解肝癌术后复发病理危险因素的关切。肝癌病理诊断报告一般由大体标本描述、免疫组化检查结果、其他特殊检查结果、典型病理照片以及病理诊断名称等部分组成,必要时还可以通过备注的方式,对临床需要引起重视的肿瘤重要生物学特征或病理学上还有待进一步鉴别诊断的病变等问题加以解释或补充说明。此外,为便于记录和统计临床和病理学参数,也可以在病理报告后附加清单式病理记录表格。
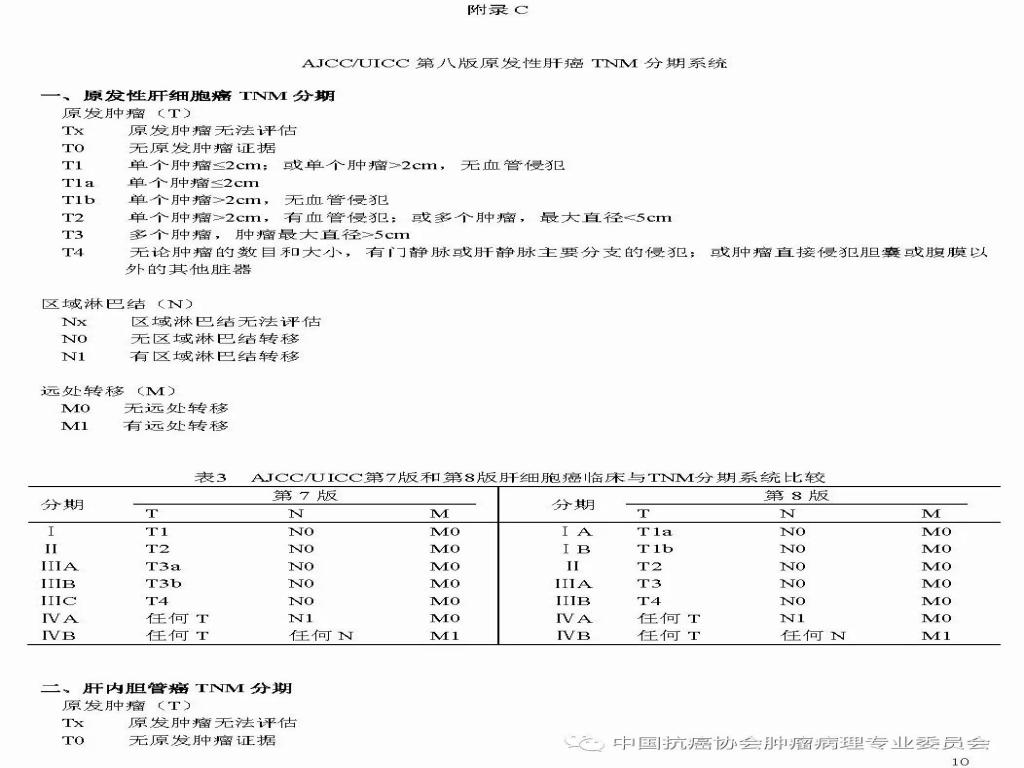
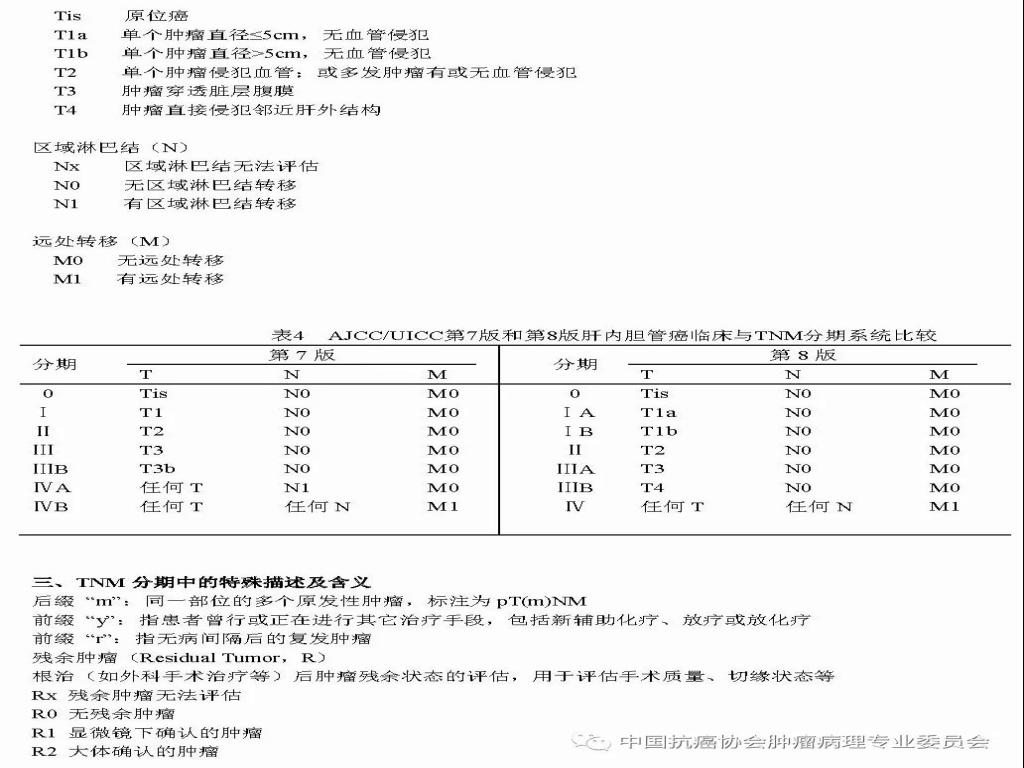
参 考 文 献 1.中华医学会.临床技术操作规范-病理学分册.北京:人民军医出版社, 2004;27-41. 2.中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版).临床肝胆病杂志, 2011; 27(11): 1141-1159 3.中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,等. 原发性肝癌规范化病理诊断指南(2015年版). 中华肝胆外科杂志, 2015,21(3): 145-151. 4.丛文铭.肝胆肿瘤外科病理学.人民卫生出版社,2015;276-339. 5.TheInternational Consensus Group for Hepatocellular Neoplasia. Pathologicdiagnosis of early hepatocellular carcinoma: a report of the internationalconsensus group for hepatocellular neoplasia. Hepatology, 2009; 49(2): 658-664. 6.BosmanFT, Carneiro F, Hruban RH, et al. World Health Organization., InternationalAgency for Research on Cancer. WHO classification of tumours of the digestivesystem. 4th ed. Lyon: International Agency for Research on Cancer,2010;205-238. 7.NCCNClinical Practice Guideline in OncologyTM. Hepatobiliary Cancers. V.2. 2015National comprehensive Cancer Network. 8.WangB, Xia CY, Lau WY, et al. Determination of clonal origin of recurrenthepatocellular carcinoma for personalized therapy and outcome evaluation: a newstrategy to hepatic surgery. J Am Coll Surgeons, 2013;217(6):1054-1062. 9.AmericanJoint Committee on Cancer. AJCC Cancer Staging Handbook, 7th ed. Chicago:Springer, 2010. 10.AmericanJoint Committee on Cancer. AJCC Cancer Staging Manual, 8th ed. Chicago:Springer, 2017.
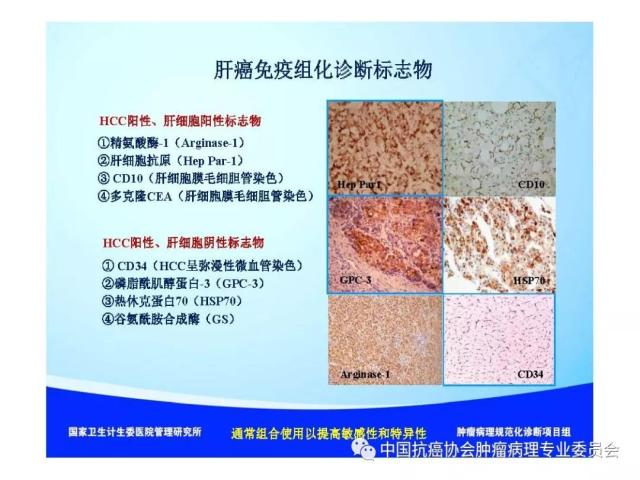
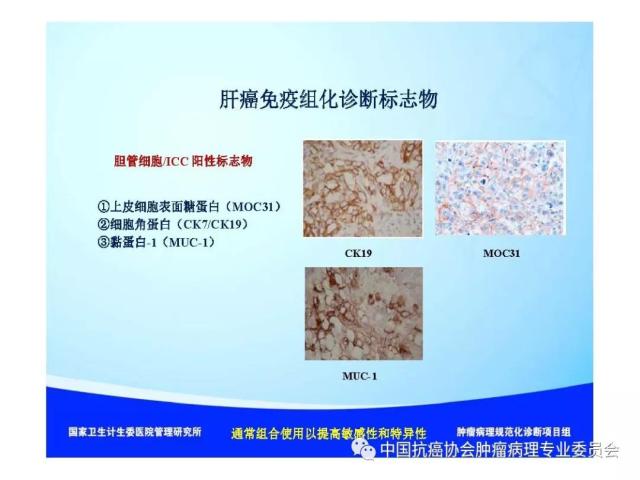
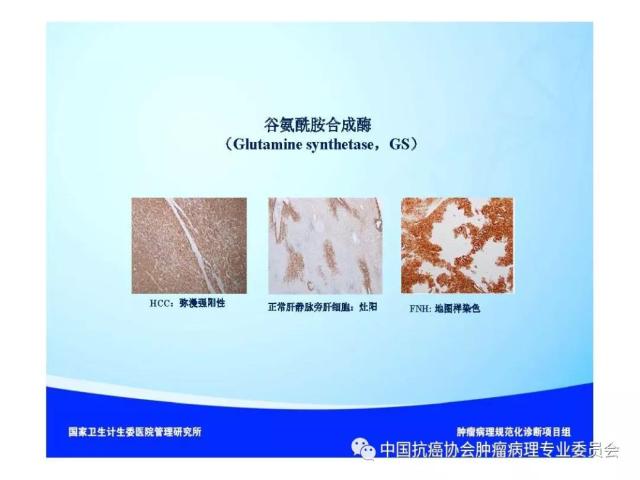
|
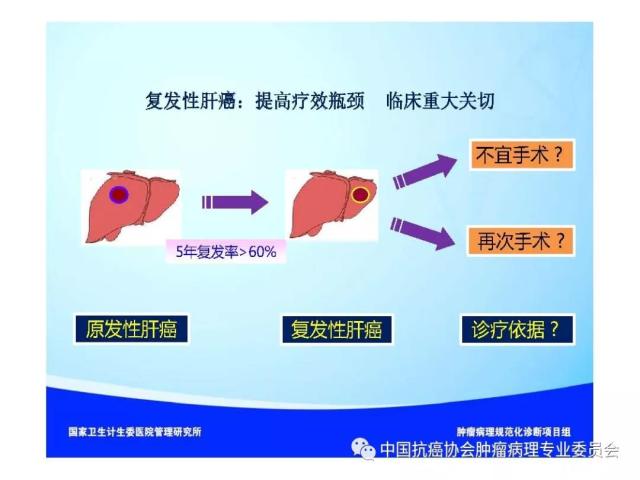
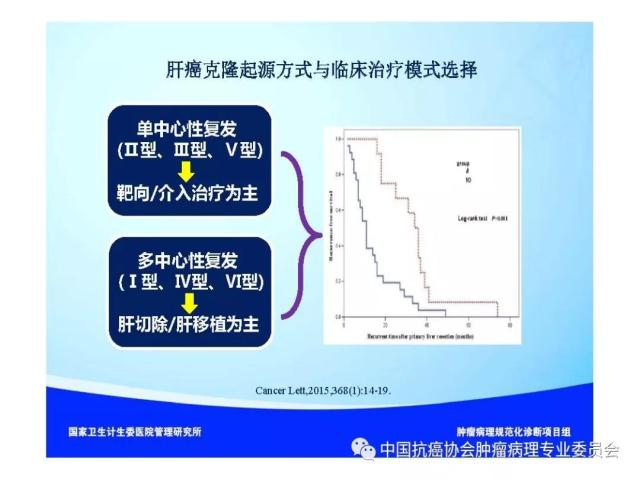
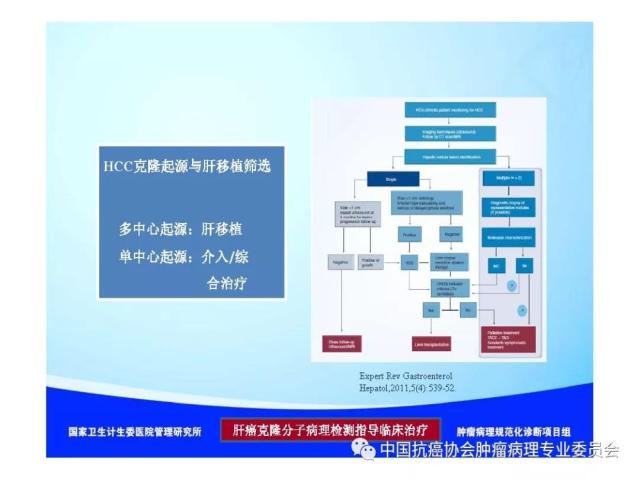
【本文地址】
今日新闻 |
推荐新闻 |