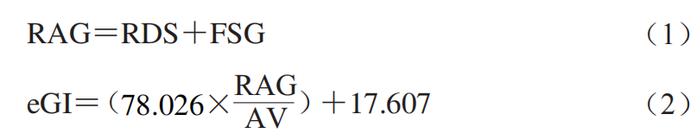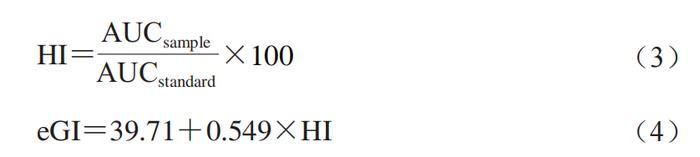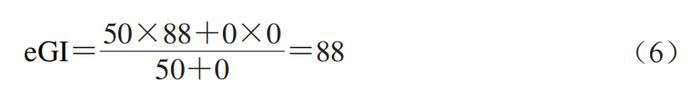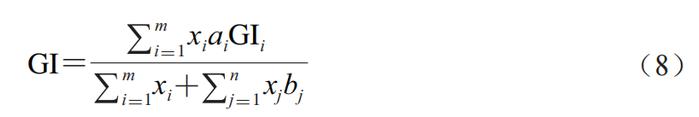暨南大学余稳稳副教授等:碳水化合物食品血糖生成指数值 |
您所在的位置:网站首页 › 碳水升糖指数排行榜最新 › 暨南大学余稳稳副教授等:碳水化合物食品血糖生成指数值 |
暨南大学余稳稳副教授等:碳水化合物食品血糖生成指数值
|
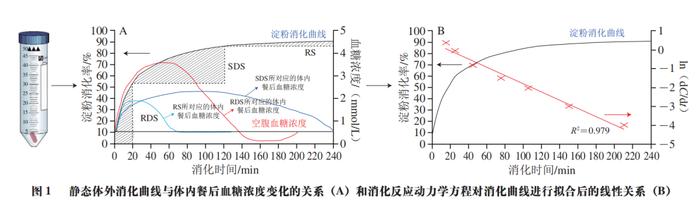
碳水化合物不仅是食物中含量最高的成分,也是人类七大营养素之一。食品中的碳水化合物,特别是以淀粉为代表的生糖类碳水化合物,经人体消化系统消化后,最终以葡萄糖的形式进入血液,是人体最重要的能量来源,也是引起人体内餐后血糖升高的最重要原因。为更好地表征碳水化合物食品对人体内餐后血糖浓度的影响,Jenkins等首次提出了血糖生成指数(GI)的概念,即一种食品与同样数量的参考食品(通常为白面包或葡萄糖)相比的血糖升高潜力。GI值是当前衡量和评价食品引起餐后血糖升高的最重要指标,与人体健康有显著的相关性。 鉴于此,暨南大学食品科学与工程系的王怀槟、余稳稳*,华南理工大学食品科学与工程学院的彭星光等人重点讨论体内、体外,特别是体外模拟消化测试在预测食品GI值方面的主要方法及其研究进展,主要从静态体外消化模型、动态体外消化模型、数值型模型、动物模型以及人体内模拟入手。对比分析各模型预测食品GI值的优缺点,并比较其局限性,为低GI食品的研发和推广提供具有参考意义的标准检测方法,以期帮助企业高效、简便地研发生产低GI值的碳水化合物食品。 1 静态体外消化模型 1.1 Englyst模型 基于食品中淀粉的消化特性而建立的各静态体外消化模型及其在预测GI值方面的应用一直受到研究者们的重视,其操作步骤可简要概括如下:1)通过剁碎或研磨待测食品样品模拟口腔咀嚼过程;2)在旋涡混合器或磁性水浴锅中通过加入磁力搅拌子进行持续性搅拌以模拟胃肠蠕动过程;3)通过添加一定浓度、体积的HCl和NaOH溶液来调节消化液的pH值,以模拟人体胃、肠道的消化环境;4)通过在不同消化步骤中添加一种或多种消化酶(通常为猪蛋白酶、猪胰酶、α-葡萄糖苷酶等)将待测食品最终消化成葡萄糖或麦芽糖,并通过分析葡萄糖浓度随时间的变化来反映餐后血糖变化。 如图1A所示,Englyst等根据不同时间段内食品中淀粉消化的程度,将其分为快消化淀粉(RDS)(可在0~20 min内消化)、慢消化淀粉(SDS)(可在20~120 min内消化)以及抗性淀粉(RS)(120 min内未消化)。其中,RDS的摄入能够迅速提高餐后血糖水平,为人体活动提供必要的能量。RDS含量较高的食物可导致餐后血糖浓度快速升高,长期食用会诱发与饮食相关的代谢性慢性疾病(如2型糖尿病),而SDS含量较高的食物由于消化较为平缓,餐后血糖浓度较为稳定,更有利于健康。与RDS和SDS相比,一般认为,食品中的RS难以甚至不会在人体上消化道消化。相反地,RS最终经结肠中的微生物群发酵利用后释放的短链脂肪酸等物质还有利于调节肠道微生物群和预防代谢性疾病。 研究发现,以淀粉为主的碳水化合物食品中的RDS及快速可利用葡萄糖(RAG)的含量均与GI值呈极显著的正相关关系。因此,一般情况下可根据待测食品中RDS、RAG以及可利用碳水化合物的含量来快速预估待测食品的GI值(eGI)(式(1)、(2))。 式中:RAG为快速可利用葡萄糖含量/(g/100 g);RDS为快消化淀粉含量/(g/100 g);AV为可利用碳水化合物含量/(g/100 g)。FSG为食品中初始葡萄糖含量以及食品中的蔗糖可释放的葡萄糖含量之和。 1.2 消化反应动力学模型 采用静态体外消化模型得到的淀粉消化曲线经公式换算和数学模型拟合后可得到的各体外消化参数也常常被用来预测食品的GI值(图1B)。例如,基于经拟合得到的各消化参数计算得到的一定消化时间段内的AUC,可用来计算待测食品的水解指数(HI),并最终用来预估其GI值(公式(3)、(4))。 式中:AUCsample为样品消化曲线下面积;AUCstandard为标准品消化曲线下面积。 1.3 其他静态体外消化模型 静态体外消化模型虽然具有操作简单、重复性好、成本低等优点,但简单的剁碎或研磨无法重现或代替人体的口腔消化过程,更无法模拟人体小肠的吸收过程。为克服此类问题,Germaine等基于剁碎(非咀嚼)非透析的方法进行研究,结果发现谷物食品中淀粉的体外消化率与GI值间有显著的相关性;Hettiaratchi等利用经志愿者咀嚼并进行透析后得到的食品残渣进行体外消化实验,结果表明其得到的HI值与eGI值间有显著的正相关性。此外,鉴于Englyst模型没有将葡萄糖的吸收过程考虑进去,有研究人员将消化后的液体转移到透析管和透析袋,结果也发现,HI值和GI值呈显著的正相关关系。最后,为更好地体外模拟人体小肠对葡萄糖的吸收过程,也有学者考虑了血糖清除率及其剂量依赖性,并提出用相对升糖影响参数(RGI)这一指标来预测待测食品的临床血糖反应。 预制水产品在加工、运输和贮藏过程中易发生腐败变质,产生风味劣变,进而对水产品食用品质、安全性及经济效益产生巨大影响。预制水产品的风味变化源于3 种基本机制:氧化、微生物降解及内源酶作用,其中氧化作用主要包括蛋白质氧化和脂质氧化。 2 动态体外消化模型 虽然静态体外消化模型因其简单、快速、实用、低成本等优势在预测食品GI值方面已展现出了巨大的应用潜力,但小肠上皮细胞对食品中可生糖组分经口腔、胃、小肠消化后产生的葡萄糖的吸收是引起餐后血糖浓度升高的最重要方式之一,然而当前大多数静态体外消化模型未能充分考虑消化过程的动态方面,特别是肠上皮细胞等对葡萄糖的吸收作用,难以模拟真实、全面、准确的人体内消化、代谢和吸收全过程。因此,静态体外消化模型测试得到的数据往往生理相关性较低,无法揭示与食品体内消化相关的现实或生理因素。 动态体外消化模型因为可通过设置相应的步骤来更好地模拟真实的人体内消化环境,也受到了研究者们的极大关注。当前,各环境动态体外消化模型主要由一个一个单腔室或多腔室所连接,内部常结合计算机系统或芯片用来调整不同消化阶段的pH值、传输时间和消化分泌物的动态,以尽可能地重现人体消化系统的生理状况。 2.1 TIMcarbo模型
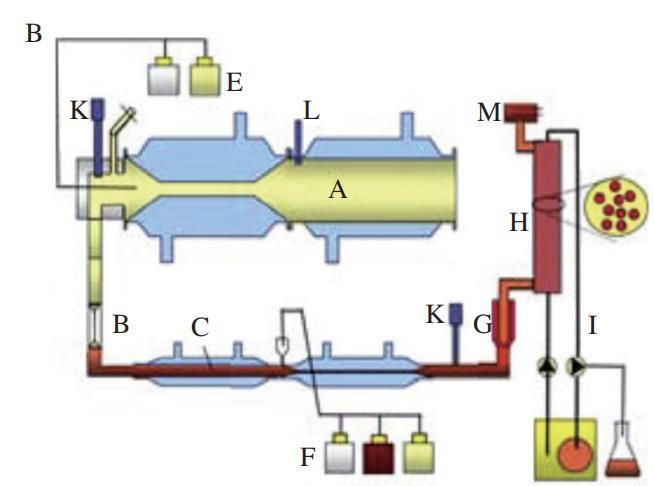
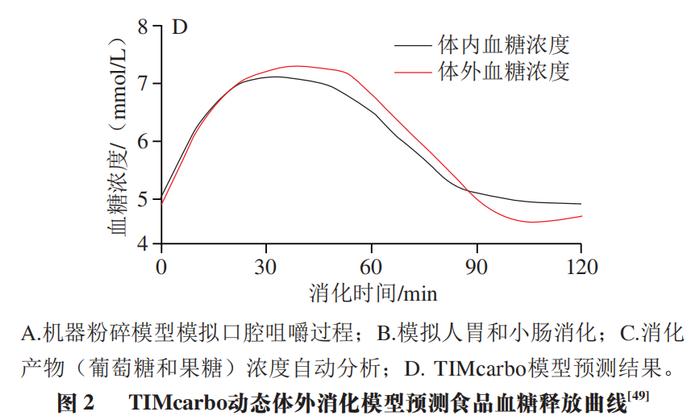
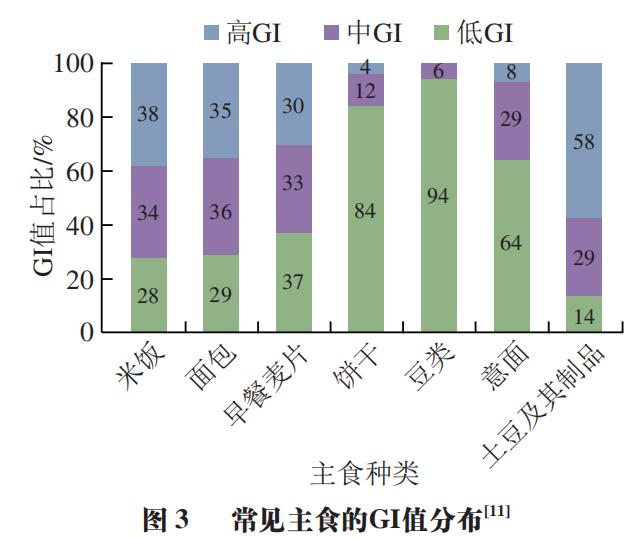
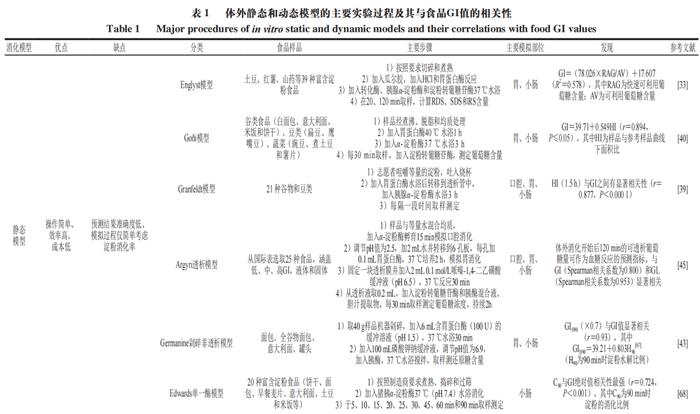
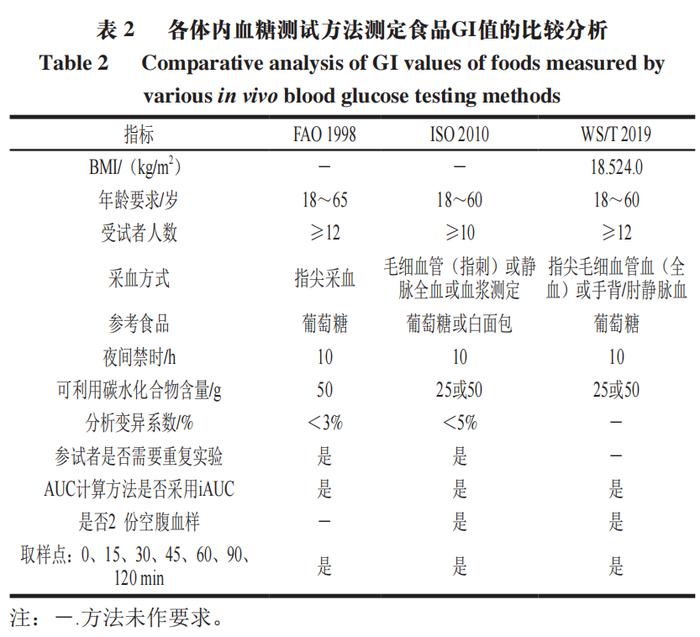
TIMcarbo模型(图2A~C)是动态体外消化测试食品餐后血糖反应的经典模型,其不仅模拟了口腔消化对血糖生成浓度的影响,同时还综合考虑了葡萄糖、果糖等物质在小肠的吸收过程。TIMcarbo模型操作步骤可概括为:1)待测食品经过机器粉碎模拟人口腔对食物的咀嚼作用后进入到动态的胃肠道模拟消化系统内,得到消化产物;2)消化产物经计算机自动分析,得到葡萄糖、果糖等物质的含量与时间的变化关系,并得到葡萄糖释放曲线。研究结果显示,TIMcarbo模型预测得到的血糖释放曲线与人体内血糖释放曲线高度一致(图2D),可用于研究待测食品样品对餐后血糖浓度的影响。 2.2 工程小肠模型 Priyadarshini等将鸡小肠适当加工后制备得到的工程小肠模型应用于体外预测食品餐后血糖水平中,结果表明该模型具有较高的精准度。该模型随即被用于测试3 款不同配方的饼干样品,其得到的体外血糖释放曲线与体内血糖测试结果无显著性差异。此外,含有大量RDS的食品会引起短时餐后血糖浓度的急剧升高,可使人血液中葡萄糖水平和胰岛素浓度大幅升高。有学者将动态胃模型(DGM)与静态十二指肠模型相结合,为模型体内GI测试提供了新途径。当前,虽然对各体外动态模型研究的相关报道仍然较少,但体外动态模型在预测待测食品所引起的人体内血糖反应方面具有较高的准确度,应用潜力不容忽视。尽管如此,动态模型由于设备占地大、费用昂贵、操作复杂且效率低、重复性较难保证等问题仍待解决,与高通量筛选低GI食品及其产品的研发测试目的间还存在有一定差距。 3 数值模型 数值模型通常指的是对待测食品进行初步消化或基本组分分析,得到与之相关的样品消化、理化以及不同食品组分的含量等参数,而后基于数值统计和软件进行分析得到的一种经验型预测GI模型。利用数值模型来预测单种食品或由多种不同食品组成混合餐的GI或GL值可参考联合国粮食及农业组织(FAO)预测模型。 3.1 FAO预测模型 正常饮食过程中,消费者往往需要同时摄入不同种类的食物。因此,为评估一份复合餐的GI值,FAO以该复合餐中各类食物自身的GI值为准,并利用相关数据库获得该复合餐中各类食物的GI值,代入到公式(5)中,进而来计算其eGI值。 式中:i为单一或者复杂食品中的基本营养成分数(i=1,2,3…);Ci(i=1,2,3…)为第i种营养素所含可利用碳水化合物的含量;GIi(i=1,2,3…)为第i种营养素的GI值。 例如,一份由110 g白面包(GI值为88,可利用碳水化合物的质量为50 g,即C1=50,GI1=88)和30 g黄油(GI值为0,可利用碳水化合物的质量为0,即C2=0,GI2=0)组成的混合餐中,其eGI值计算如式(6)所示。 尽管公式(5)极大地方便了复合食品GI值的计算和预估,但其未充分考虑食品在真实人体内消化和吸收过程的复杂性以及食品中各不同营养组分间相互作用对测试结果的影响,测试结果与真实的体内测试结果往往差异较大。例如,体内测试结果显示,添加黄油会将白面包的GI值从88降到67。可见,对于复合食品,简单地通过计算每种食品组分对GI值的贡献来预测其GI值,预测结果准确度较低,可靠性难以保证。 为克服上述缺陷,研究者们在FAO数值预测模型的基础上对公式(5)进行了一系列的修改和调整后得到公式(7)。 式中:i为单一或者复杂食品中的基本营养成分数(i=1,2,3…);xi(i=1,2,3…)为第i种营养素所含可利用碳水化合物的含量;GIi(i=1,2,3…)为第i种营养素的GI值;ai为校正系数,介于0~1之间,表示某一种可利用碳水化合物的利用率。例如,对于淀粉而言,其ai值为食品中RDS的含量/100。 其中,在进一步考虑非生糖食品组分(如蛋白质、脂肪以及非生糖碳水化合物等)对GI值的影响之后,公式(7)可转化成公式(8)。 式中:m为待测食品中生糖类食品组分的数目;n为待测食品中不可生糖类食品组分的数目;bj(j=1,2,3…n)为第j个不可生糖类食品组分对餐后血糖的影响能力。例如,由于食品中的水分含量对餐后血糖的影响较小,因此该值为0,蛋白质和脂肪均能够降低餐后血糖的浓度,其b值均为0.6。 3.2 经验模型 Atkinson等统计并收录了几千种食品的平均GI和GL值,并每隔几年进行一次更新。在其最近发表的论文中,其同时考虑了相同食物在不同食用条件下GI值的差异性,并统计了同一种食物为高、中、低GI值的概率。图3主要列举了我国居民常见主食GI值分别为高、中和低的概率分布。例如,豆类食品有94%的概率为低GI食品,而土豆及其制品为低GI食品的概率仅为14%。此外,虽然一般认为米饭的GI值较高,但结果显示,仍然有34%的米饭为中等GI值,有28%的概率为低GI值(GI<55)。 数值模型估算的往往只是一个粗略的GI值,其可靠度存疑。同时国际GI和GL值表中所列的GI值并不能够反映出实际食品的特性。例如,即使是相同种类的食品或食品原料组分,根据其来源与种类不同,GI值也具有一定的差异性,但在估算GI值的过程中往往容易被忽视。 为克服传统数值模型在预测GI值方面的缺点,Rytz等在量化生糖类碳水化合物对GI值影响的同时还考虑了食品蛋白质、脂肪、纤维等物质成分对GI值的影响作用,进而预测待测食品的GI与GL值。在其进行的60 项涵盖不同产品类别(GI值介于15~95)和多种配方的实验中,结果显示eGI值与实验之间的相关性非常大(r=0.97,P<0.01,n=60)。最后用42 种早餐麦片对模型进行验证,结果表明所预测的GI(r=0.90,中位残差为2.0)和GL(r=0.96,中位残差为0.40)的准确性与体内基础数据(GI的标准误差为3.5)相匹配。 此外,食品中的其他大量营养素如蛋白质、脂肪和纤维等均会影响食品的餐后血糖反应。Meynier等首次评估了谷物产品的不同特性与血糖反应参数之间的相互作用,并利用JMP软件(10.0版本),同时结合偏最小二乘回归法,分析了谷物产品特征与血糖反应之间的关系,然后进行建模。该数据库包括190 种谷物产品。这是第一个评估淀粉组分和宏量营养素含量对血糖代谢响应的影响的研究。结果显示,食品中的SDS、RDS、脂肪和纤维以及它们之间的相互作用显著解释了53%的GI和60%的血糖峰值。Hamli采用多元回归分析法分析了16 种谷类与豆类食品的直链淀粉含量以及这16 种食品的GI值与各营养成分间的关系,结果表明,待测食品中的淀粉与脂肪是唯二与公布的GI值显著相关的常量营养素。此外,也有学者使用HCl和酶模拟胃肠消化食品,并采用高效液相色谱法测定消化液中葡萄糖、果糖、蔗糖、乳糖、半乳糖以及糖醇(麦芽糖醋)等物质的浓度,最后利用人工神经网络系统对高效液相色谱数据进行处理,得到其eGI值。该方法快速且成本低,可以在24 h内完成15 次体外GI值分析。 3.3 COMSOL Multiphysics模型 Karthikeyan等基于商业计算机软件COMSOL Multiphysics建立了一个可模拟人小肠内液体流动、碳水化合物消化和葡萄糖吸收过程的数值模型,进而开发了一种模拟人体消化和预测不同碳水化合物食品葡萄糖吸收率的工具,其有助于控制热量的摄入过程。表1对比分析了当前各主要静态和动态体外消化测试方法预测食品GI值的优缺点。 4 体内消化模型 4.1 人体血糖测试 体内模型是在生物内部所建立的,能够获得最为真实的GI值测试数据。当前,碳水化合物食品标准的GI值是通过人体体内实验得到的。一般通过让志愿者食用含有一定量可利用碳水化合物(25 g或50 g)的食品后,测定餐后2 h内血液的血糖浓度变化并以葡萄糖或白面包为参考食品进行比较分析。 人体体内餐后血糖测试将胃排空、渗透压、体积、酸度、性别和年龄等因素的影响都考虑在内。由于考虑了每一个生理因素,因此这种方法没有确切的替代品。人体体内测试方法至今仍然是统一标准的方法,其中ISO颁布的ISO 26642:2010为国际共识。但人体体内测试具有费用昂贵、效率低、时间长、存在个体差异等局限性,且涉及到相关的伦理申请,极大地限制了其在现代食品工业中的应用。 各体内血糖测试方法测定食品GI值的比较分析汇总如表2所示。 4.2 动物模型 动物研究中使用的方法与人体体内实验方法高度相关。动物模型GI值可采用与人体体内血糖采样实验相同的程序计算曲线下增量面积,其中,大鼠和小鼠因为其血糖反应与人体相似,故应用较为广泛。 尽管各种动物模型都有各自的优点,但和人体模型一样涉及相关的伦理问题。此外,动物实验还具有其他缺点,如需要专业人员、程序耗时、培训和实验场所成本高。与人体模型相比,应用动物模型的优势在于能够更多地探究体内生理变化的机制(如胰岛素和激素控制),以合理解释各种食品的餐后血糖反应特征,但这涉及到更多危险性方法并需要大量血液,而这些在人体实验中不容易实现。 5 结 语 到目前为止,尽管研究者们已经开发了各种动态或静态模型,但仍然没有一个令人满意的模型能够代替人体体内实验来准确、快速、经济地预测碳水化合物食品GI值。笔者认为,与其他模型相比,尽管各种模型预测得到的GI值和人体体内真实血糖测试结果均有一定的差距,但是体外静态模型似乎是最优解。数值模型因其快速、简单的优点适用于原料或配方食品初期大规模的筛选工作,但其准确度有待商榷。体外静态模型快速、经济、重复性高且能够较为准确地预测食品GI值,适合代替人体血糖测试进行高通量筛选低GI食品研发与原料筛选;但大多数静态体外消化模型难以模拟真实食物消化吸收的全过程,无法揭示与食品体内消化相关的现实或生理因素。而动态体外消化模型可以进一步模拟酶浓度、pH值变化、胃排空、血糖透析吸收等,在探究消化数据与生理相关性方面具有更大的潜力。而在研究血糖反应的机理机制问题等方面,动物模型则具有更大的优势。最后,为精确掌握人体对不同GI食品的血糖反应,需要在体外静态、动态和动物模型进行互补使用。在更可靠的方法得到验证之前,有必要进行人体测试,以确定目前体外和动物模型预测的食品的GI值。尽管人体体内实验存在费用昂贵、涉及伦理道德、效率低等方面的缺点,但人体实验仍然是衡量食品GI值准确性的“金标准”。 本文《碳水化合物食品血糖生成指数值体外、体内预测方法的研究进展》来源于《食品科学》2023年44卷15期407-417页. 作者:王怀槟,彭星光,刘宏生,余稳稳. DOI:10.7506/spkx1002-6630-20220704-032. 特别声明:以上文章内容仅代表作者本人观点,不代表新浪网观点或立场。如有关于作品内容、版权或其它问题请于作品发表后的30日内与新浪网联系。 |
【本文地址】