【测试技术专栏】电化学循环伏安法剖析 |
您所在的位置:网站首页 › 氧化峰与还原峰的关系 › 【测试技术专栏】电化学循环伏安法剖析 |
【测试技术专栏】电化学循环伏安法剖析
|
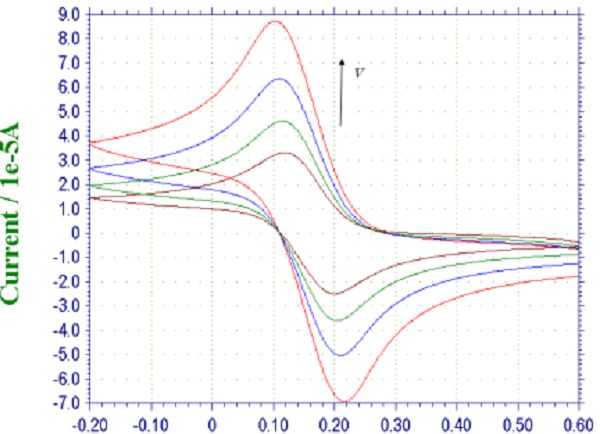
图一:K3Fe(CN)6溶液的循环伏安曲线 图一的i-E曲线即为循环伏安图。从循环伏安图中可以看出有两个峰电流和两个峰电位,阴极峰电流ipc,峰电位以Epc(jpc)表示;阳极峰电流ipa,峰电位以Epa表示。ipc或ipa的下标的a代表anode,c代表cathode。我们可知道,ΔEp=Epa-Epc=56/n(单位:mV)(n为反应过程中的得失电子数),ipc与ipa的比值越接近于1,则该体系的可逆程度就越高。这是判断可逆体系的最直接的方法。 从电化学工作站的工作界面,可以得出氧化峰电位为Epa=227mV,峰电流为ipa=-1.91´10-6A;还原峰电位是Epc=170mV,峰电流是ipc=1.9´10-6A。氧化峰与还原峰电位差为57mV(直接比较横坐标数值即可),峰电流的比值为:ipa/ipc=1.005≈1。由此可知,pH=7时,铁氰化钾体系(Fe(CN)63-/4-)的电化学反应是一个可逆过程。(通常都是借助该体系与其它体系进行比较,鉴别电极的优劣以及反应可逆程度)。 接下来,我们来研究扫速与峰电流及峰电位的关系。本实验室通常选择铁氰化钾作为实验对象。不同扫描速率100、200、300、400mV/s,分别记录从-200~+600mV扫描的循环伏安图。记录循环伏安曲线,观察峰电位和峰电流,判断电极活性。
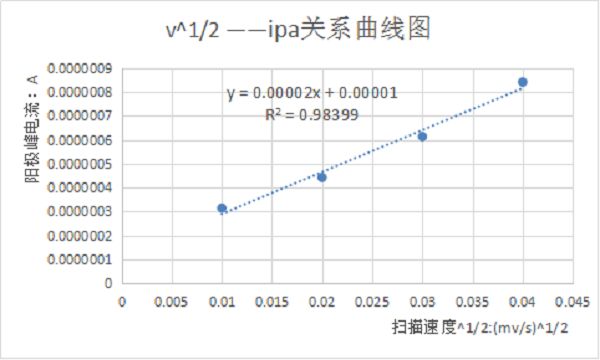
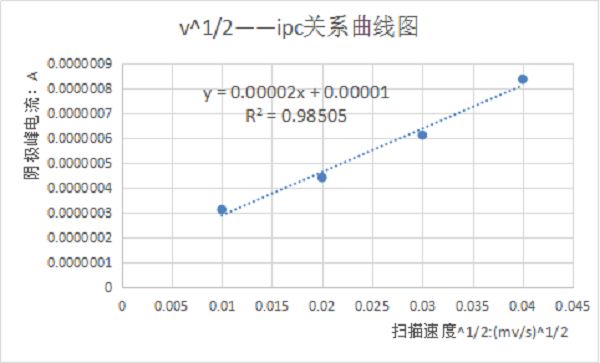
图二:不同扫描速率下铁氰化钾溶液的循环伏安曲线 将不同扫描速率100、200、300、400mV/s的循环伏安曲线进行叠加,如上图所示。由图可知,随着扫描速度的增加,峰电流也增加。且分别测量他们的峰数据可以得到峰电流与扫描速度的关系。根据电化学理论,对于扩散控制的电极过程,峰电流ip与扫描速度的二分之一次方呈正比关系,即ip~n1/2为一直线。对于表面吸附控制的电极反应过程,峰电流ip与扫描速度呈正比关系,即ip~n为一直线。
图三:扫描速率与峰电流的关系曲线 以上详细介绍了循环伏安法在电化学应用中的定量分析,如有不足,欢迎批评指正。最后,我针对微信留言区的问题来做解答。 一、计算扩散系数时,n是否取值? 答:物质的扩散系数表示它的扩散能力,结合物理化学中谈到的菲克定律,扩散系数是沿扩散方向,在单位时间每单位浓度梯度的条件下,垂直通过单位面积所扩散某物质的质量或摩尔数。质量扩散系数D和动量扩散系数ν及热量扩散系数α具有相同的单位(m^2/s)或(cm^2/s),扩散系数的大小主要取决于扩散物质和扩散介质的种类及其温度和压力。 二、测试时,搅拌溶液对CV曲线有什么影响,峰电流与峰电位怎么变化? 答:搅拌溶液,对CV曲线是有很大的影响,人为搅拌破坏了界面扩散状态,能够及时补充电解质,使得氧化还原电流增大。同时,溶液有波动,会影响曲线的稳定性。但是,如果电极界面有气泡产生(比如析氢或者吸氧反应),电极界面会不断的析出气泡。如果不搅拌,气泡就会吸附在电极表面,造成电极与溶液隔离,测出来的CV曲线就会不准,这个时候就可以通过搅拌来促进气泡快速逸出。 三、极化控制与扩散控制 极化可分为浓差极化和电化学极化。 浓差极化:可逆且快速的电极反应使电极表面液层内反应离子的浓度迅速降低(或升高)--->电极表面与溶液本体之间的反应离子浓度不一样,形成一定的浓度梯度--->产生浓差极化--->电极表面液层的离子浓度决定了电极的电位,此电位偏离了电极的平衡电位,偏离值称为浓差过电位。 电化学极化 电极的反应速度较慢―――>当电流密度较大时,引起电极上电荷的累积―――>产生电化学极化―――>电极的电位取决于电极上所累积的电荷,此电位偏离了电极的平衡电位。但是与反应活化能有关的极化都是不可消除。 扩散控制:它是化学反应速率因反应速度过快,无法由分子完成而是由扩散来控制的现象。扩散控制是由于化学反应太快,扩散来不及供给反应以足够的分子所致。 本文由许飞提供,材料牛编辑整理。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |