阿尔茨海默氏症(AD)与帕金森氏症(PD)药物研发进展 |
您所在的位置:网站首页 › 帕金森综合症的治疗药物 › 阿尔茨海默氏症(AD)与帕金森氏症(PD)药物研发进展 |
阿尔茨海默氏症(AD)与帕金森氏症(PD)药物研发进展
|
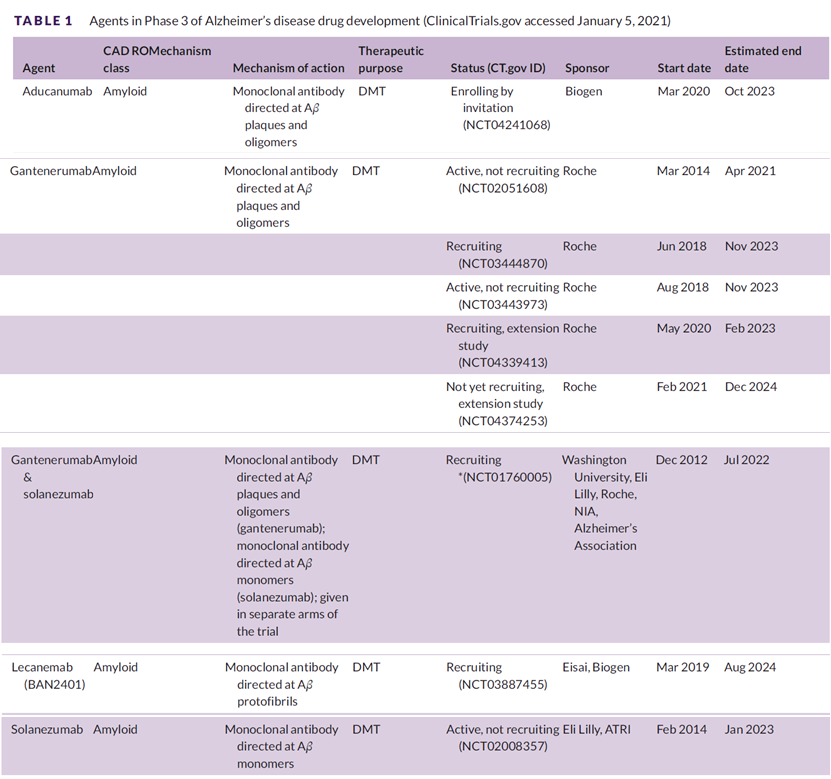
截至2021年1月份,针对AD药物目前临床Ⅲ期在研的抗体药物,全部靶向β-淀粉样蛋白。但是2021年全球前10大国际药企中,罗氏、诺华、艾伯维、强生、百时美施贵宝、默沙东、赛诺菲、葛兰素史克和武田在神经系统疾病领域均有布局,都曾向阿尔茨海默病发起挑战。不过,截止目前没有一家公司挑战成功。比如:2012年,强生/辉瑞的单抗药物bapineuzumab的III期临床试验失败;2014年,罗氏宣告gantenerumab的III期临床试验失败;2016年,礼来宣告III期临床药物Solanezumab没有达到主要临床终点;2017年,默沙东宣布停止开发BACE抑制剂药物verubecestat。2018年,强生宣布其终止了BACE抑制剂剂atabecestat II/III期临床试验。而百健的Aducanumab单抗获批,让全球药企和资本再拾信心,继续选择向阿尔茨海默病发起挑战。
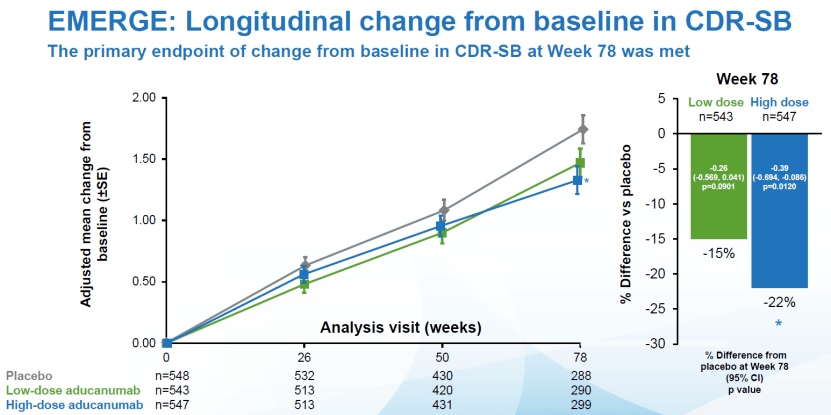
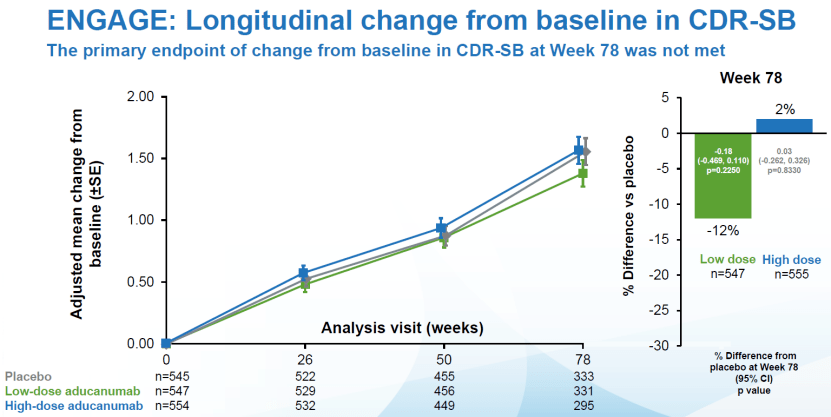
2021年6月7日,FDA宣布采用加速审批渠道批准了自2003年来第一个阿尔茨海默病新药-百健的Aducanumab,这一药是近20年来的第一个FDA批准治疗AD的药物,但同时也引发对FDA药物审批标准的重大争议[4]。 争议主要为两项III期临床试验EMERGE和ENGAGE结果不一致。EMERGE研究中,高剂量Aducanumab的患者其认知功能较安慰剂组表现更好,衡量认知能力CDR-SB评分降低22%。而ENGAGE临床试验中,同样高剂量Aducanumab治疗的患者组CDR-SB评分反而升高了2%。[5]
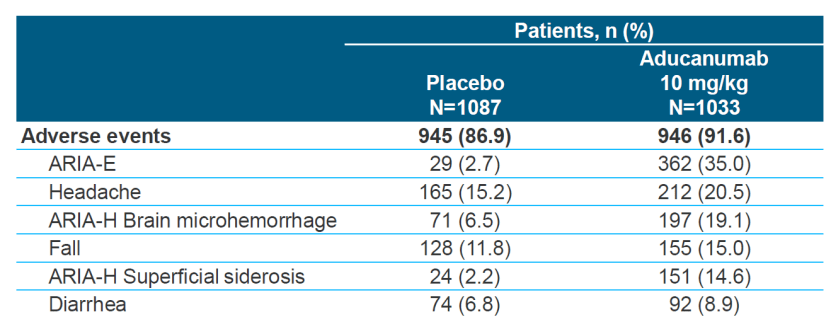
并且高剂量Aducanumab治疗的患者中,大约35%的患者会出现药物相关的脑部水肿等。所以基于其疗效的不确定性和潜在的安全隐患,外围咨询委员会一致不同意获批Aducanumab。【7】
而FDA力排众议,采用加速审批渠道获批Aducanumab,基于EMERGE研究中高剂量Aducanumab的患者认知改善数据和“清除β-淀粉样蛋白斑块就能缓解阿尔茨海默症”这一假说。并且要求百健展开临床Ⅳ试验,重点将改善患者认知能力作为临床终点。 2021年7月29日,百健和卫材宣布设计了临床Ⅳ期试验,称为 ICARE AD-US(NTC 待定),以评估 上个月获批的Aducanumab注射液 100 mg/mL 长期有效性和安全性。该研究打算在四年内,从美国大约 200 个地点,招募阿尔茨海默病患者,对患者进行长达五年的监测。整个项目为其9年,主要目的是评估接受Aducanumab治疗后认知水平在真实世界的长期变化,次要目标是进一步评测Aducanumab安全性【6】。 帕金森氏症研发现状 帕金森氏症 (Parkinson’s disease, PD) 是一种影响中枢神经系统的慢性神经退化疾病,主要影响运动神经系统,它的症状通常随时间缓慢出现,早期最明显的症状为颤抖、肢体僵硬、运动功能减退和步态异常等,超过三分之一的病例也会发生重性抑郁障碍和焦虑症,被认为是继AD后第二常见的神经退行性疾病。
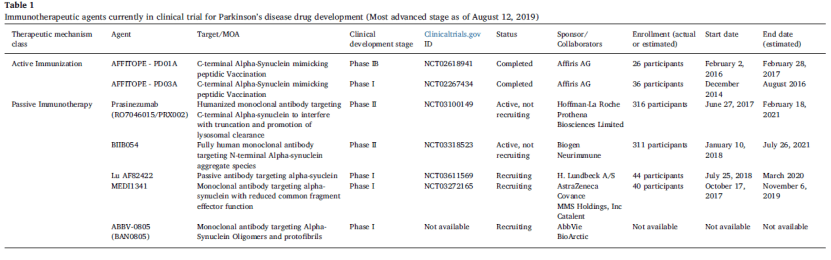
目前,用于治疗帕金森综合征的免疫疗法主要有两种:被动免疫治疗和主动免疫治疗。这些免疫疗法有望成为治疗帕金森综合征有效的治疗方式,但大多处于早期临床试验阶段【8】。 在用被动免疫疗法治疗帕金森综合征上,大部分抗体以α-突触核蛋白为靶点,通过抗体清除毒性形式的α-突触核蛋白。Prothena 是走在最前端的公司之一,即将与罗氏(Roche)合作开启 IIb 期临床试验。 同时,奥地利生物科技公司 AFFiRiS 正在尝试使用主动免疫疗法来降低有毒 α-突触核蛋白的毒性。这种疗法是通过为患者注射与毒性α-突触核蛋白类似的合成蛋白片段,以此来激发免疫系统生成能够结合并清除大脑中有毒α-突触核蛋白的抗体。
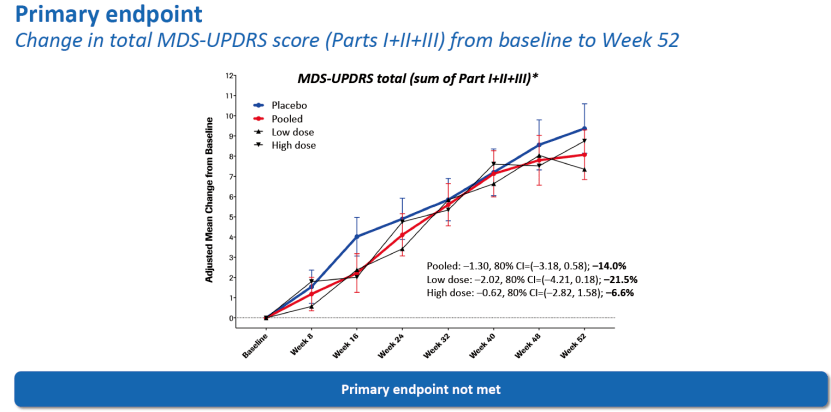
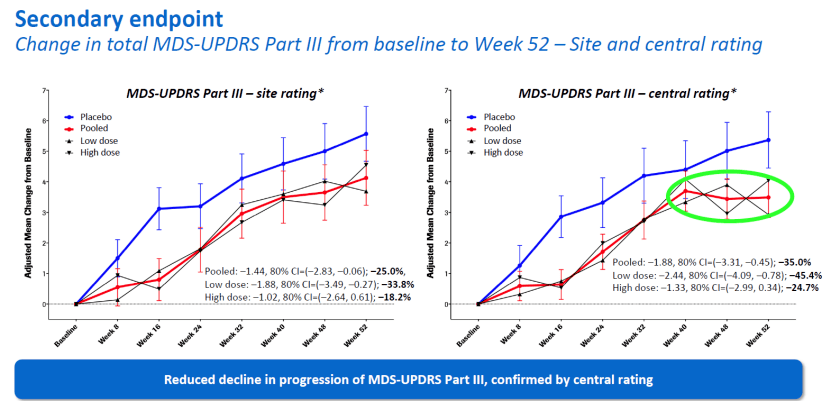
2020年9月15日,罗氏在国际帕金森会议MDS上,对Prasinezumab的Ⅱ期PASADENA研究结果进行公布,未达到减缓运动和非运动症状进展的主要终点,但与安慰剂相比,在两个Prasinezumab组中均观察到显示疾病进展缓解的信号。此外,使用运动障碍学会统一帕金森病评定量表(MDS-UPDRS)第III部分对患者进行评估,与安慰剂组相比,Prasinezumab治疗组的患者在接受治疗一年后其运动功能下降减少了35%[9]。
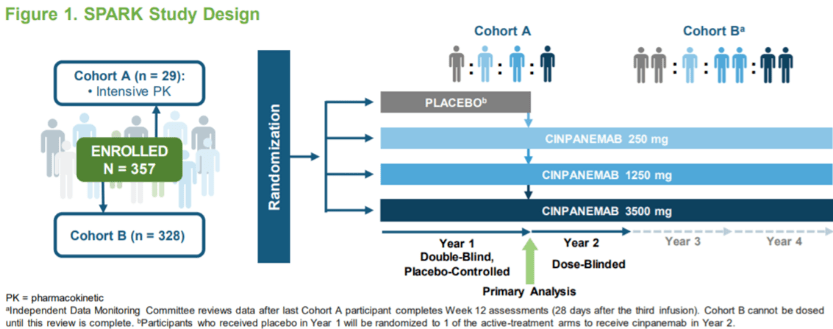
基于此,2021年3月22日,罗氏制药公司(Roche)和Prothena生物技术公司共同研发的帕金森病候选药物Prasinezumab将进入2b期(PADOVA)试验,继续进行Prasinezumab有效性探索[10]。 2021年2月3日,百健(Biogen)在其2020年度业绩和收益报告中宣布,帕金森病候选药物Cinpanemab(BIIB054)在Ⅱ期临床研究SPARK未达到主要和次要终点,停止继续研发。Ⅱ期临床研究SPARK分析了抗α-突触核蛋白单克隆抗体Cinpanemab与安慰剂相比减少帕金森病患者损伤和残疾的疗效,其主要终点是MDS-UPDRS总分的改善【11】。
小结 综上:阿尔茨海默氏症和帕金森氏症抗体药物的研发无疑是神经领域研究的重点,特别是上半年百健Aducanumab单抗的FDA获批,表明FDA可能有意推动神经领域疾病药物研发进展,这无疑会引入全球药企和资本的注入【12】。希望不久的将来,会有更加安全有效的阿尔茨海默氏症、帕金森氏症等疾病的药物获批,造福全球的神经退行性疾病患者。 参考文献: [1]Appel SH, Smith RG, Le WD. Immune-mediated cell death in neurodegenerative disease. Adv Neurol. 1996;69:153-9. Review. [2]Zhou M, Wang H, Zeng X, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2019;394(10204):1145-1158. doi:10.1016/S0140-6736(19)30427-1 [3]Jeffrey Cummings, et al. Alzheimer’s disease drug development pipeline: 2021. Alzheimer’s Dement. 2021;7:e12179. [4]Alexander G C, Emerson S, Kesselheim A S. Evaluation of aducanumab for Alzheimer disease: scientific evidence and regulatory review involving efficacy, safety, and futility[J]. JAMA, 2021, 325(17): 1717-1718. [5]Evaluation of aducanumab efficacy in early Alzheimer’s disease [6]https://investors.biogen.com/news-releases/news-release-details/biogen-and-eisai-announce-design-aduhelm-icare-ad-us-study-first [7]Biogen-Global Alzheimer’s Platform Foundation Webinar Aducanumab Data Review. [8]Diptaman Chatterjee, Jeffrey H. Kordower. Immunotherapy in Parkinson’s disease: Current status and future directions. Neurobiology of Disease 132 (2019) 104587 [9]Prasinezumab Slows Progression on Measures of Parkinson’s Disease in Phase 2 PASADENA Study [10]https://ir.prothena.com/news-releases/news-release-details/roche-and-prothena-will-advance-prasinezumab-late-stage-clinical [11]https://investors.biogen.com/static-files/6286c4fc-fc15-4b5b-9e78-11739f96a21c [12]Controversial Alzheimer’s drug approval could affect other diseases. nature NEWS返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |