mRNA纯化工艺:将RNA疗法全方位带入更好和更健康的新世界 |
您所在的位置:网站首页 › 如何纯化RNA › mRNA纯化工艺:将RNA疗法全方位带入更好和更健康的新世界 |
mRNA纯化工艺:将RNA疗法全方位带入更好和更健康的新世界
|
图1:市场上用于处理核酸的牛血清白蛋白(BSA)的分子尺寸排阻色谱(SEC);样品用 PicoGreen染料预染;TSKgel G4000SWXL,7.8mm×30cm,50mM MES,150mM NaCl,0.05% Pluronic F68,pH6.5;流速:0.5mL/min。 色谱图最明显的特征是DNA的严重污染。也就是说DNA样品不纯。它包含了牛染色质的残余物:含有各种大小的DNA片段的核小体碎片,与组蛋白和其他宿主蛋白结合。病毒往往与染色质有关,内毒素也是如此,染色质具有抗原性。DNA-蛋白质聚集体的大小也是一个问题,因为高分子量进一步促进了它们的免疫原性。 UV谱显示了染色质DNA相对应的高分子量聚集体。这个结果还揭示了BSA主峰前边的一系列峰。它们代表白蛋白均聚物和杂聚物。一部分白蛋白含有游离巯基,可与类似的血浆蛋白共价结合,包括IgA、α-1蛋白酶抑制剂和抗胰蛋白酶。这种蛋白质杂质在哺乳动物生理学中可能具有一些生物学作用,但在IVT混合物中则不需要这种作用。 下图2说明了市售T7 RNA聚合酶在TSKgel G3000SWXL色谱柱上的SEC分析结果。这种单亚基酶的质量为99kDa。样品用PicoGreen染料预染色,并另外监测内在色氨酸荧光。像许多酶一样,RNA聚合酶按活性单位的浓度出售,这会使蛋白质浓度过低,无法通过紫外线吸光度进行准确监测。色氨酸荧光可将UV蛋白质检测的灵敏度提高15-20倍,但是这种方法不检测核酸。
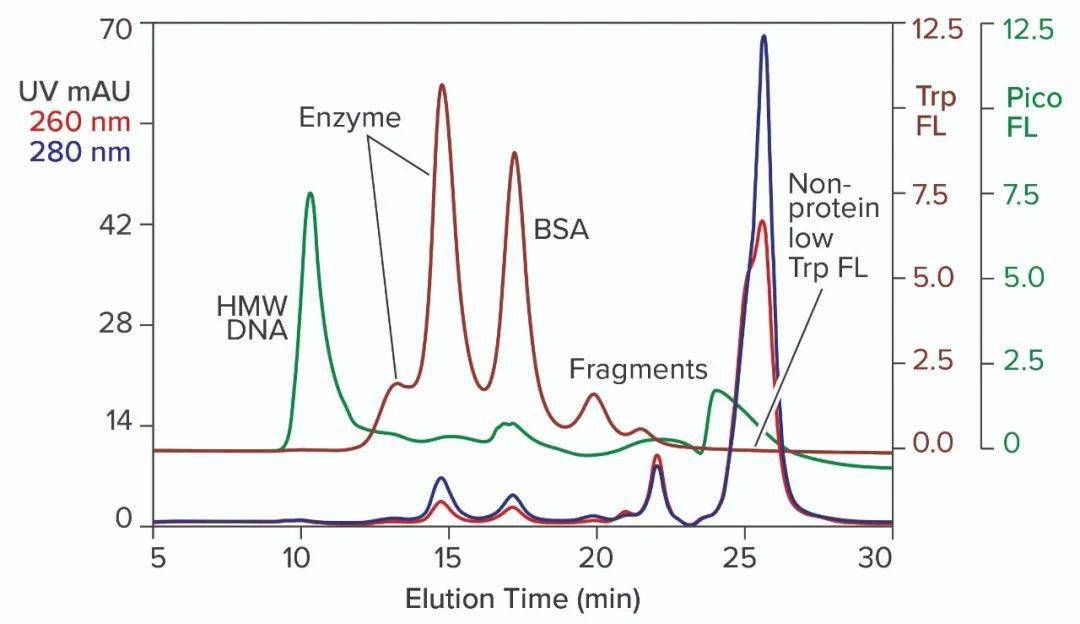
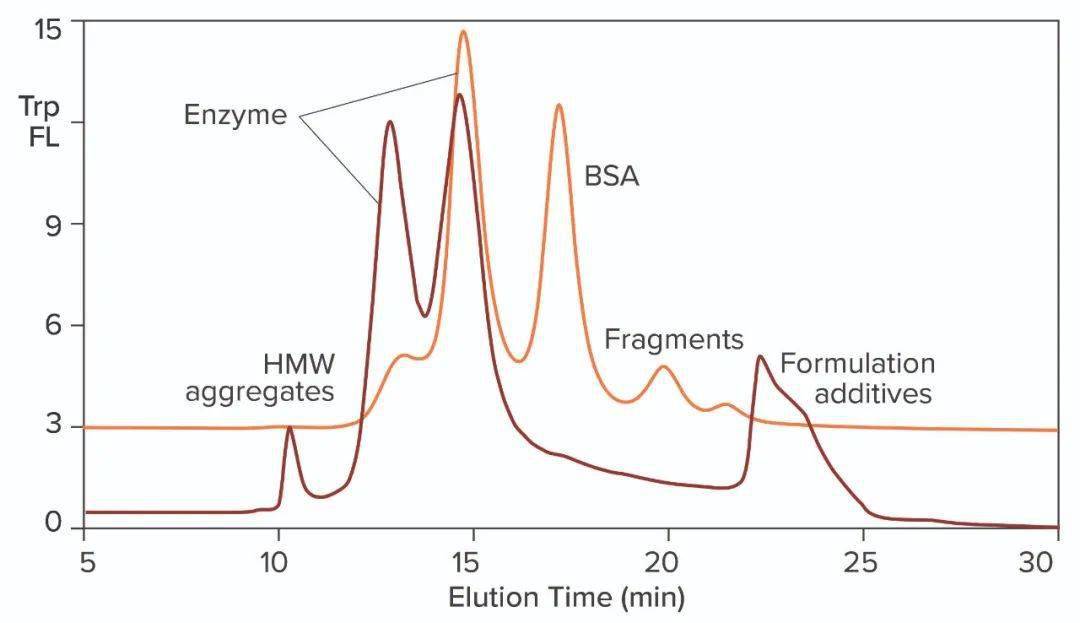
图2:用PicoGreen染料预染的商业T7 RNA聚合酶SEC分析;TSKgel G3000SWXL,7.8mm× 30cm,0.5mL/min;请注意,该色谱柱的分离范围低于 图1中的色谱柱。 DNA污染是显而易见的,但其来源尚不确定。它可能来自用于生产酶的宿主细胞,也可能来自BSA,或两者兼而有之。除此之外,酶不是均一的,而是分布在两个峰中,RNA聚合酶之间的异质性是已知的。尽管异质性影响活性,但它与SEC分离的两个峰的相关性尚不清楚。 下图3将来自第二个供应商的RNA聚合酶的色氨酸荧光谱叠加在第一个色谱图谱上。两个酶峰的相对分布明显不同,聚体和片段含量更高。BSA也不存在,数量也减少很多。考虑到细胞外染色质、非人蛋白质和聚体的免疫原性潜力,这是这一厂家酶的优势。这还得出了一些实际结论:该领域的酶在供应商之间不可互换,酶异质性的变化可能会影响体外转录的结果。强烈建议进行批对批测试,以得出供应的质量和一致性。
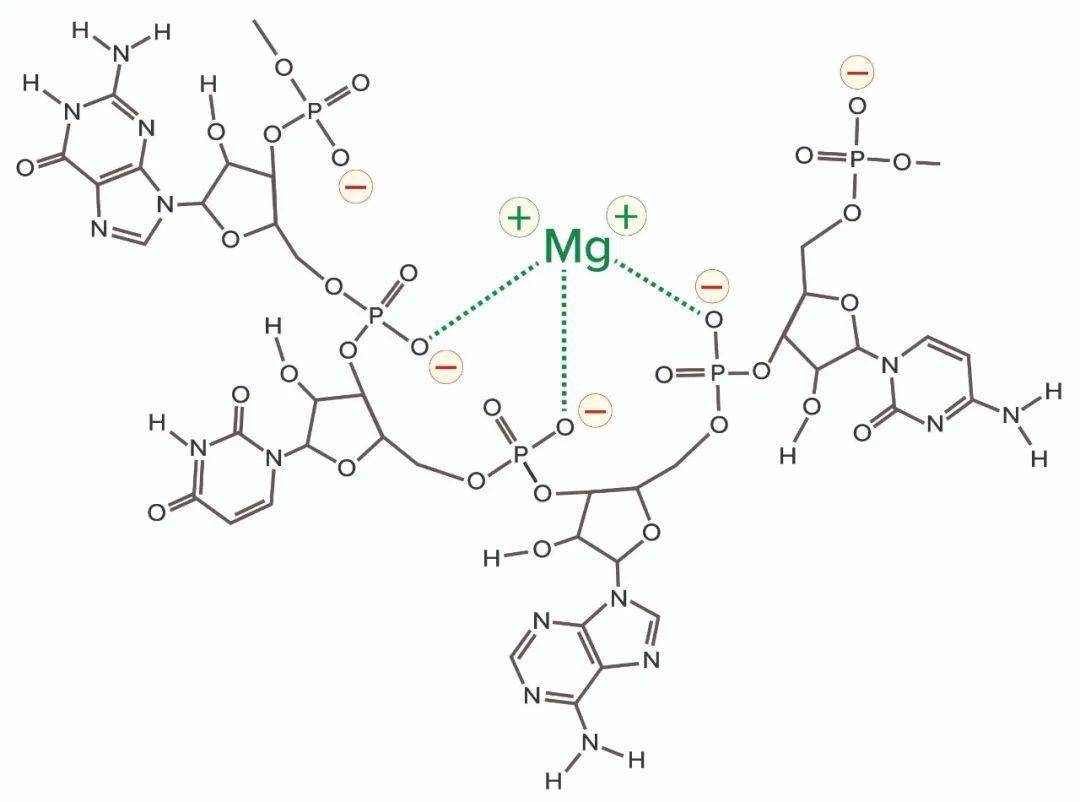
图3:来自两个不同供应商的T7 RNA聚合酶的SEC谱叠加图;橙色图来自 图2,TSKgel G3000SWXL。 需要考虑另一种污染物类别。作为转录酶辅助因子的多价金属阳离子成为最终IVT混合物中的污染物。RNA核糖骨架的磷脂酸残基对这些金属具有高亲和力。RNA金属结合可以改变电荷、构象、稳定性和功能(下图4)。
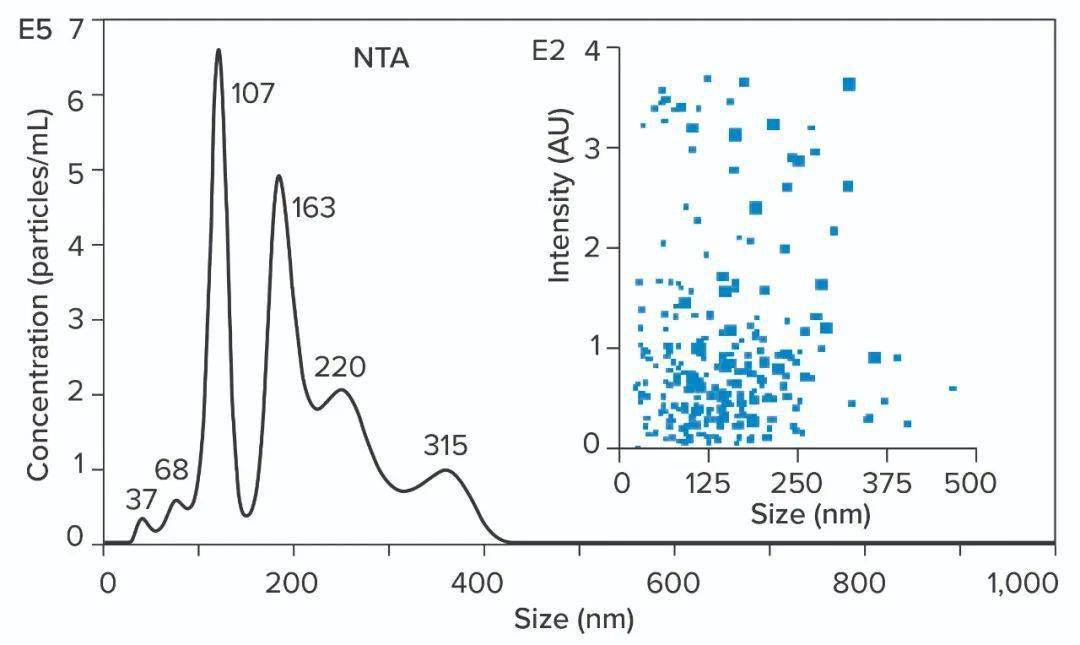
图4:镁离子与RNA上的磷脂酸残基的配位键合;带黄色晕圈的红色负电荷和绿色的配位键。金属离子正电荷可以吸引其他RNA并与它们产生配位键。 金属离子配位还能够与其他核酸和蛋白质产生交联,形成稳定的分子间杂合体,有助于聚体的形成。当RNA成为混合物中的主要物质时,它会与金属离子结合方面超过其他物质,或者以稳定的复合物与金属离子结合。这就是为什么在用于纯化核酸的色谱缓冲液中几乎普遍使用EDTA。 下图5说明了纳米粒子跟踪分析(Nanoparticle Tracking Analysis,NTA,使用NanoSight 仪器(Malvern Panalytical)对包含大小为1200个碱基(1.2kb)的ssRNA的IVT混合物的结果。我们希望这种混合物由单峰为主要成分,但是结果是有很多峰,大中小值分别为37、68和107nm处代表不完整的转录本。163nm处的峰代表游离ssRNA。后面的220和315nm处峰代表聚体,它们含有更多的RNA单体。就哺乳动物细胞培养收获中的核酸行为可以作为指导,这些聚体可能代表RNA、DNA、蛋白质和金属离子之间的稳定性。
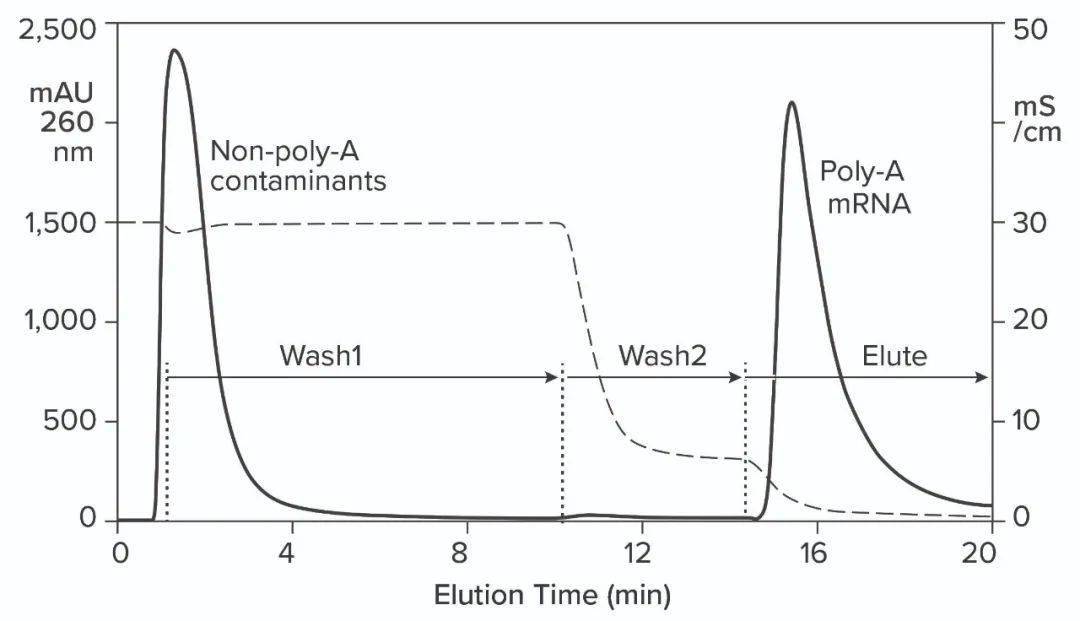
图5:含有1200个碱基ssRNA的体外转录混合物的纳米粒子追踪分析(NTA)结果。 NTA结果揭示了所有上述含有的杂质中最大的纯化挑战。如果样品中的所有成分都作为独立实体存在,那么纯化就很困难了。如果污染物与产品稳定关联,则变得更加困难,这就意味着产品不良概率也同时增加。ssRNA需要从其与污染物的关联中提取出来,然后才能从中分离出来。 现阶段用于工业化纯化mRNA方法 已经有一种用于RNA纯化的亲和方法。使用oligo dT(聚胸苷)配体的杂交亲和层析通过多腺嘌呤尾(poly-A tail)捕获mRNA。约250mM氯化钠可抑制配体和RNA上带负电荷的骨架磷脂酸残基之间的静电排斥。这使他们能够近距离接触。RNA被AT碱基配对捕获。除去盐重新建立它们的相互电荷排斥,去除AT氢键和洗脱的RNA(如下图6)
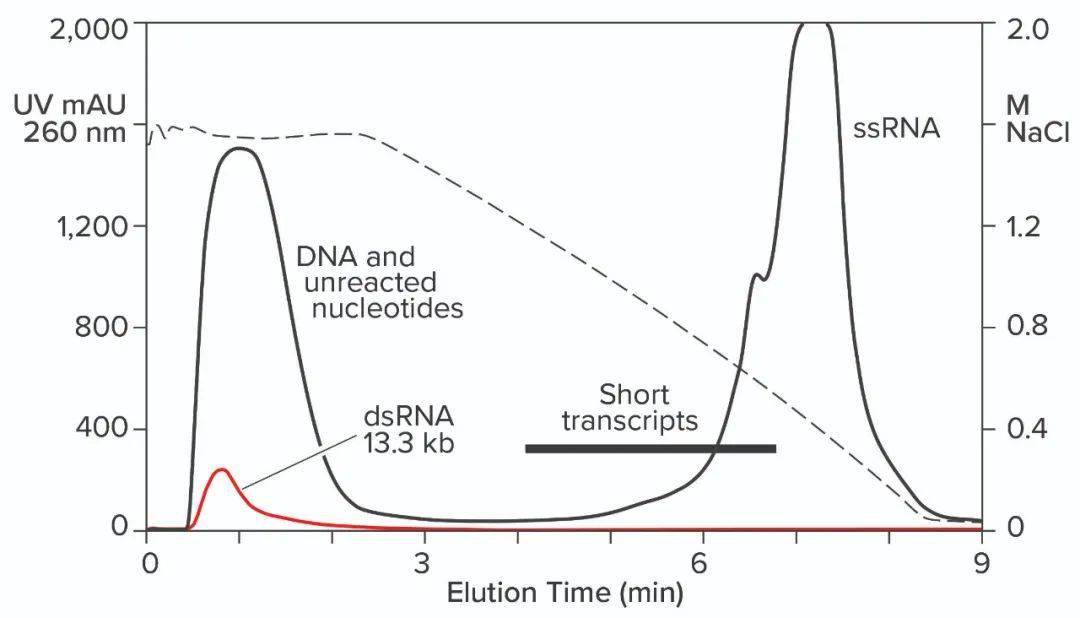
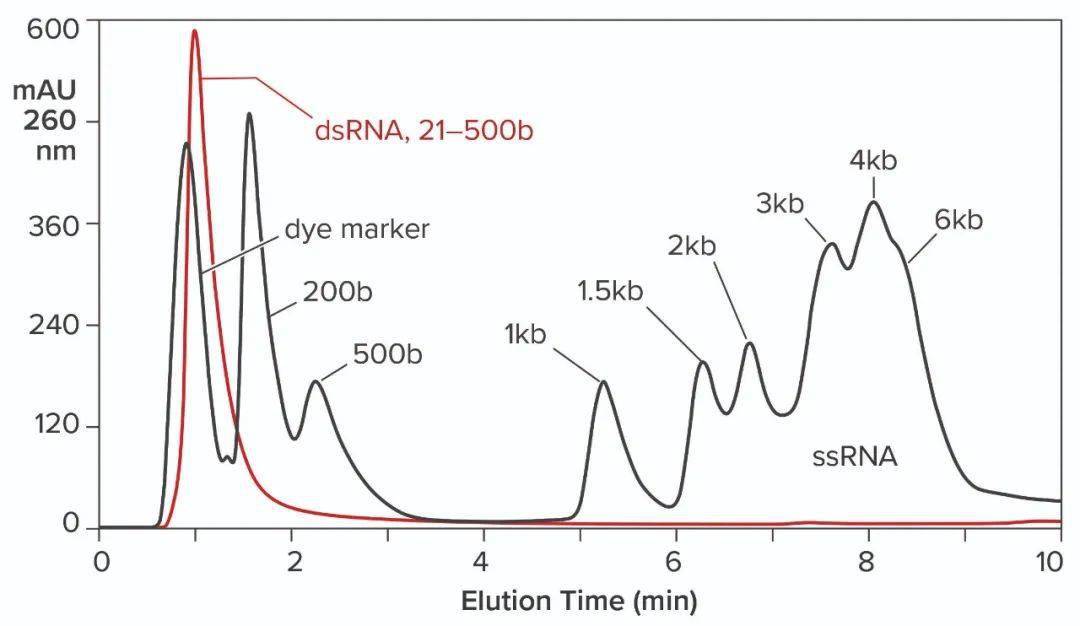
图6:在CIMmultus Oligo dT柱上对IVT混合物进行杂交亲和层析;用50mM磷酸钠、250mM氯化钠、5mM EDTA,pH7.0平衡/淋洗1;用50mM磷酸钠、5mM EDTA,pH7.0淋洗2;洗脱:10mM Tris,pH8.0。 与oligo dT的杂交亲和性可用于捕获,但它具有一些局限性。它无法区分ssRNA和dsRNA,也无法根据大小对mRNA进行分级分离。完整的产品、不完整的转录体、寡聚体、片段、聚体,任何具有可结合poly-A尾巴的物质都会与所有其他物种一起洗脱。Oligo dT可以用100mM NaOH清洗,但不推荐使用更高的浓度。这是一个令人担忧的问题,因为IVT混合物沉淀的可能性很高。 疏水相互作用色谱(HIC)已显示出对RNA纯化的良好效果。正确选择结合盐后,DNA和dsRNA无法结合(如下图7)。不完整的转录物在完整的ssRNA之前洗脱,需要NaOH去除大部分蛋白质。使用苯乙烯二乙烯基苯(SDVB)介质的反相色谱(RPC)也已被证明可用于去除dsRNA并按大小分离ssRNA(如下图8)。HIC和RPC介质容易被IVT混合物污染。它们都可以使用1M NaOH进行长时间的清洗,因此它们可以恢复到原始状态,但运行中的污垢会影响纯化性能,这使得这两种方法都更适合精纯。
图7:IVT混合物在CIMmultus C4 HLD柱上的疏水相互作用层析;样品装入1.8M NaCl,pH7.0,并用盐梯度洗脱。红色轨迹显示了在相同条件下加载的纯dsRNA样本。
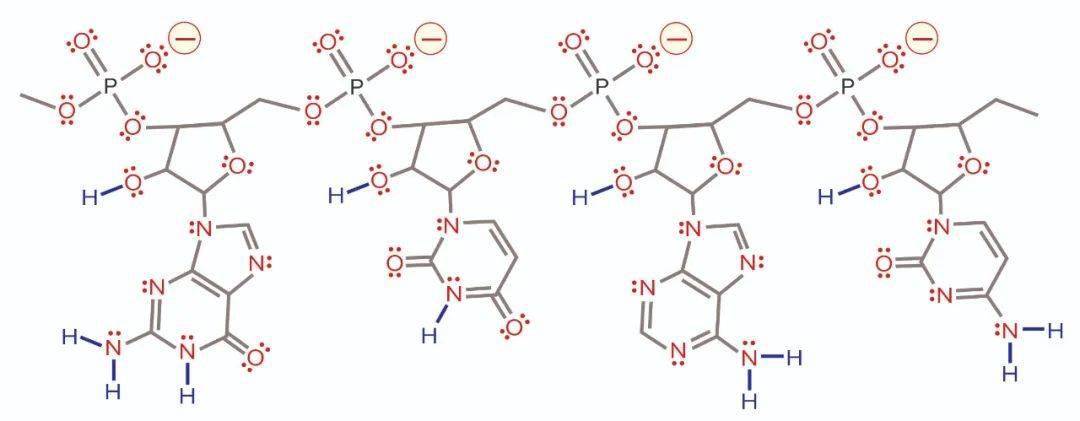
图8:65℃下CIMmultus SDVB柱上dsRNA和ssRNA梯度洗脱的反相色谱;平衡/淋洗缓冲液0.1M三乙氨基乙酸盐,pH7.0;洗脱缓冲液0.1M三乙氨基乙酸盐,25%乙腈,pH7.0。 阴离子交换色谱法纯化RNA 离子交换色谱法已经为蛋白质和质粒DNA纯化服务了几十年。传统的交换剂如二乙氨基乙基(DEAE)和季胺(QA)适用于小于500个碱基的RNA转录体,但不适用于大型转录体。在环境温度下,它们提高的氢键能力可防止它们被除氢氧化钠以外的任何物质洗脱(如下图9)。将缓冲液和色谱柱加热到50-70℃的范围内可以充分抑制氢键,从而能够使用氯化钠梯度进行洗脱。
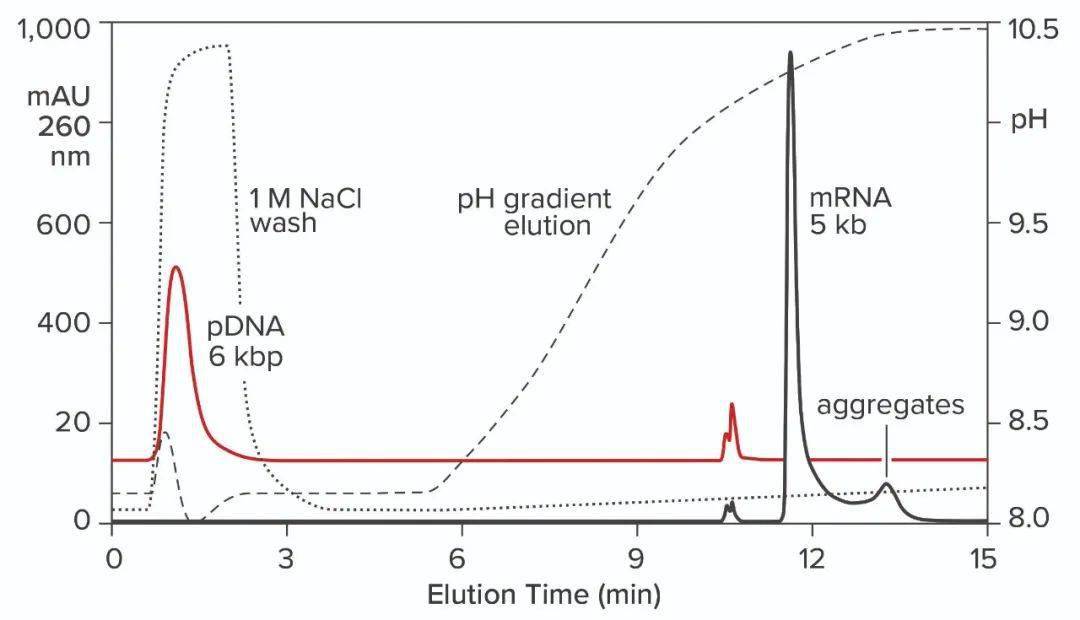
图9:RNA上带电残基、氢供体和氢受体的分布。负电荷以带有黄色光晕的红色表示。氢受体用红色表示,用红点对表示单个自由电子。氢供体为蓝色。与四个负电荷相比,有11个氢供体和75个受体。 加热给工艺开发和制造带来了负担,但它也提供了一个线索:氢键容量较小的交换器应该能够在环境温度下洗脱RNA。如下图10通过说明在环境温度下在CIMmultus PrimaS柱(BIA Separations)上从质粒DNA中阴离子交换分离mRNA来验证这一预测。样品在中性pH下结合,并用上升的pH梯度洗脱。DNA在之前洗脱并与ssRNA分离良好。双链RNA在DNA之后洗脱,但仍早于ssRNA。
图10:在CIMmultus PrimaS pH柱上通过pH梯度洗脱从ssRNA中阴离子交换分离质粒DNA;缓冲液A:20mM Tris、20mM双-三-丙烷、20mM甘氨酸、50mM NaCl、10mM EDTA,pH7.0;缓冲液B:20mM Tris、20mM双-Tris-丙烷、20 mM甘氨酸、50mMNaCl、10mM EDTA,pH11.0。 两种双链物质都可以通过使用1M NaCl和10mM乙二胺四乙酸(EDTA)进行中性pH洗涤步骤来去除,蛋白质与它们一起被去除,单链RNA保持结合。用另一种缓冲液洗涤柱子以清除多余的盐,然后用pH梯度洗脱。通过提前消除大部分污染物,提高了pH梯度的整体净化潜力。这使得渐变能够更好地打磨它们的最后痕迹。下图11显示了这种方法对上图中DNA质粒和ssRNA的结果。下图12显示了dsRNA和ssRNA梯度洗脱的结果。ssRNA的部分大小分级是明显的。
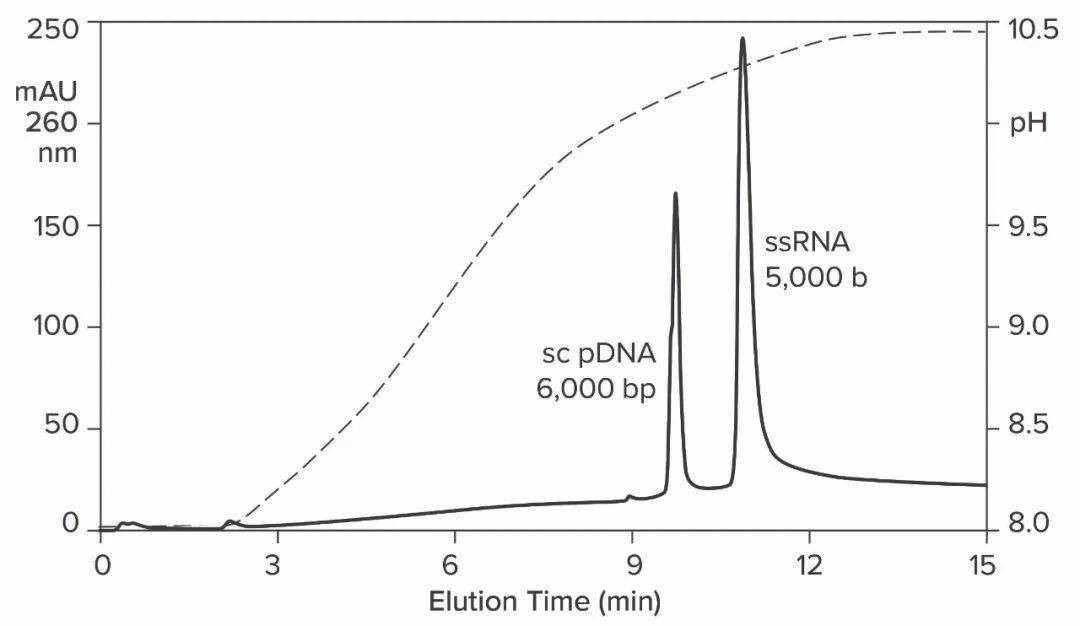
图11:从CIMmultus PrimaS柱中洗脱质粒DNA和ssRNA。在一项实验中,应用大小为5000b 的ssRNA并在pH梯度洗脱。在另一个实验中,质粒DNA被结合,然后用1M NaCl、10mMEDTA从柱子上洗掉。注意这种条件在pH梯度中不存在,除了在大约11分钟时出现小双峰。
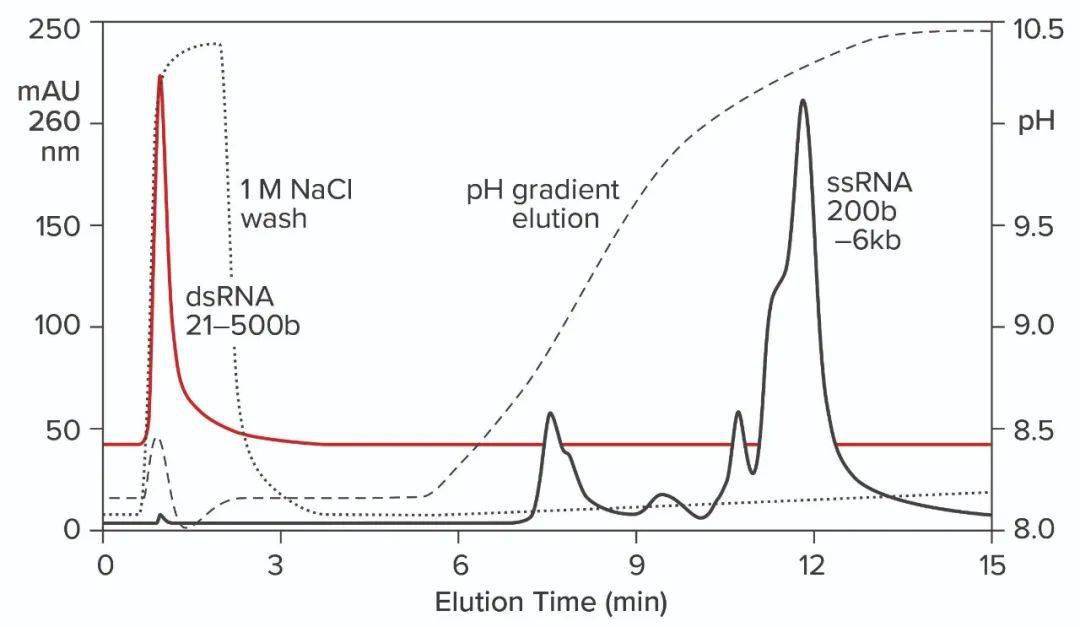
图12:从CIMmultus PrimaS柱中洗脱dsRNA梯度和ssRNA梯度。在一项实验中,应用了ssRNA梯度,其中包含大小从200到6000个碱基不等的物种,并在pH梯度中洗脱。在另一个实验中,结合了包含21到500个碱基种类的dsRNA梯度,然后用1M NaCl、10mM EDTA从柱子上洗掉。注意这种条件不存在于pH梯度中。 可以通过用盐酸胍代替氯化钠来加强洗涤步骤。将离液盐与EDTA结合,同时放松非特异性静电和疏水相互作用、氢键和金属配位。单链RNA保持结合状态,这为去除转录过程中可能与ssRNA相关的污染物创造了机会。 洗脱后应尽快中和洗脱的ssRNA的pH值。在蛋白质亲和层析领域,这很容易通过在馏分容器中预先等分中和缓冲液或在运行完成后立即中和ssRNA馏分来完成。短暂暴露于碱性pH值不会产生改变。 与大多数阴离子交换一样,可以使用1MNaOH长时间清洁色谱柱。接触大量IVT混合物通常需要处理至少一个小时。将1-3M NaCl和10-20mM EDTA与NaOH结合可增强清洁效果。严重污染的色谱柱可以通过处理16-24小时来恢复。 研究和临床级ssRNA的纯化 对于研究级ssRNA的纯化,在pH洗脱之前进行盐洗的CIMmultus PrimaS柱提供的一步纯化性能可与自1990年代以来为免疫学家提供的蛋白A亲和力相媲美。这为研究人员提供了一个简单的方案,可以快速轻松地获得少量优质ssRNA,以推进他们的研究。它为上游流程开发人员提供了一个简单的工具来评估不同变量在优化其IVT工艺方面的影响。 它为下游开发人员提供了纯化临床质量ssRNA所需的高性能捕获基础。它提供高初始纯度并去除可能干扰精纯方法的杂质。还支持去除dsRNA、DNA和蛋白质并实现大小分级的精纯方法表明自己是有效的配合工艺。从阴离子交换中分离出来的ssRNA的低盐浓度能够平稳过渡到RPC。它还为HIC提供了流畅的工作流程。两个平台都应始终如一地提供临床质量的ssRNA。 疫苗及其他治疗性RNA的未来 COVID-19大流行使国际生物制药界关注快速开发有效候选疫苗的必要性。与传统方法相比,基于RNA的疫苗具有加速开发、简化制造和降低成本的潜力。 基于RNA的疫苗的特殊好处之一是它们代表了最终的平台制造候选者。在化学和结构上,它们彼此非常相似,以至于可以将统一的开发模板应用于所有这些。这为多价疫苗奠定了基础,每个成分都可以通过基本相同的过程制备。事实上,一些此类产品包含多达六种成分,以确保对特定病原体产生广泛的免疫反应。这些RNA之间的相似性为在单个生产设施中制造所有组件提供了潜力。 临床试验已经表明对COVID-19和其他病毒(包括肝炎、寨卡病毒、流感和狂犬病)有效。超过50项临床试验也在使用RNA作为抗癌疫苗进行。这些正确地代表了免疫疗法而不是传统意义上的疫苗,但它们仍然有助于说明RNA的潜力,并且除了疫苗之外还有许多治疗候选药物。 关键蛋白质未翻译或功能失调的单基因疾病代表了另一种潜在的应用。血友病B(凝血因子 IX缺乏症)和α-1抗胰蛋白酶缺乏症会增加肝脏和肺部疾病的风险,是很好的候选者,特别是因为它们特别影响儿科患者。甲基丙二酸血症是一种遗传性疾病,可阻止蛋白质和脂质的正常加工。它出现在婴儿早期,症状轻微甚至危及生命。 FDA已经对此类RNA疗法的临床试验进行了快速跟踪。仅在美国,就有超过3000万人患有罕见疾病。由于其高昂的开发成本,基于重组蛋白的疗法往往无法解决这些问题。开发基于 RNA 的疗法的相对简单性带来了希望。 在任何有关生物制药行业的讨论中,抗体最终都会出现,对RNA的讨论也不例外。它使患者细胞能够产生具有人类糖基化的治疗性抗体。目前批准用于免疫疗法的每一种治疗性抗体、目前正在临床试验中的每一种抗体,以及每一种尚未出现的抗体,都是被RNA替代的潜在候选者。 然而,挑战依然存在。一项挑战是递送:将RNA送到治疗部位。游离RNA在体内迅速分解。并入更大的分子并包装在脂质体或纳米颗粒中已显示出前景。存储是另一个挑战。目前需要冷冻或冷藏。正在开发替代方案,以在无法使用冷藏的地区提供RNA疗法。纯化是第三个挑战。双链RNA构象异构体和带有残留合成试剂的RNA杂聚体可引发拮抗性免疫反应。开发可以简单、可扩展、可重复且具有良好工艺经济性的纯化平台仍然是一个重要目标。 在这种情况下,COVID-19可能仍会提供超过其负面影响的积极结果:通过提高解决这些剩余挑战的动力,它可以帮助将基于RNA的全方位疗法引入一种转变、更好的准备和更健康的新世界。 文章来源: 1 Gantier M, Williams B. The Response of Mammalian Cells to Double-Stranded RNA. Cytokine Growth Factor Rev. 18(5–6) 2007: 363–371; https://doi.org/10.1016/j.cytogfr.2007.06.016. 4 Knipe D, et al. Snapshots: Chromatin Control of Viral Infection. Virol. 435(1) 2013: 141–156; https://dx.doi.org/10.1016%2Fj.virol.2012.09.023. 5 Lieberman P. Chromatin Regulation of Virus Infection. Trends Microbiol. 14(3) 2006: 132–140; https://doi.org/10.1016/j.tim.2006.01.001. 7 Goldblatt D, Bustin M. Antigenicity of Histones in Various Chromatins. Biochim. Biophys. Acta 606(2) 1980: 304–315; https://doi.org/10.1016/0005-2787(80)90040-4. 8 Goldblatt D, Bustin M. Exposure of Histone Antigenic Determinants in Chromatin. Biochem. 14(8) 1975: 1689–1695; https://doi.org/10.1021/bi00679a022. 9 Rosenberg A. Effects of Protein Aggregates: An Immunologic Perspective. AAPS J. 8(3) 2006: E501–507; https://doi.org/10.1208/aapsj080359. 10 Schultze HE, Heremans JF. Molecular Biology of Human Proteins with Special Reference to Plasma Proteins, Vol. 1: Nature and Metabolism of Extracellular Proteins. Elsevier: Amsterdam, The Netherlands, 1966. 11 Gagnon P. Purification of Nucleic Acids: A Handbook for Purification of Plasmid DNA and mRNA for Gene Therapy and Vaccines. BIA Separations: Ajdovščina, Slovenia, 2020: https://www.biaseparations.com/en/products/monolithic-columns/books. 12 Coban O, et al. Conformational Heterogeneity in RNA Polymerase Observed By Single-Pair FRET Microscopy. Biophys. J. 90(12) 2006: 4605–4617; https://dx.doi.org/10.1529%2Fbiophysj.105.078840. 13 Fukuda R, Iwakura Y, Ishihama A. Heterogeneity of RNA Polymerase in Escherichia coli: A New Holoenzyme Containing a New Sigma Factor. J Mol Biol. 83(3) 1974: 361–367; https://doi.org/10.1016/0022-2836(74)90284-8. 15 Gagnon P, et al. Nonspecific Interactions of Chromatin with Immunoglobulin G and Protein A, and Their Impact on Purification. J. Chromat. A. 1340, 2014: 68–78; https://doi.org/10.1016/j.chroma.2014.03.010. 17 Slater R. The Purification of Poly(A)-Containing RNA By Affinity Chromatography. Meth. Molec. Biol. 2, 1984: 117–120; https://doi.org/10.1385/0-89603-064-4:117. 请注明:姓名+研究方向! 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |