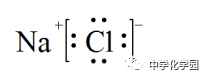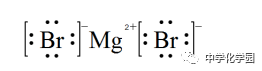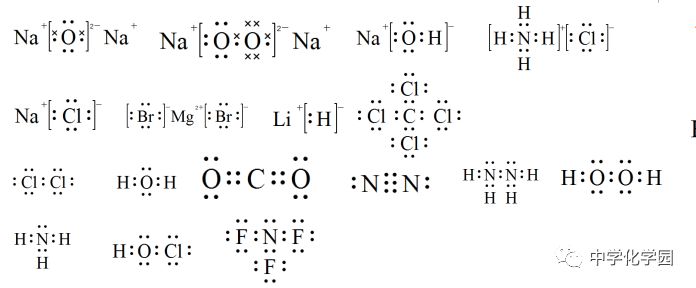高中化学必修2化学键必会知识点总结! |
您所在的位置:网站首页 › 原子团构成的离子 › 高中化学必修2化学键必会知识点总结! |
高中化学必修2化学键必会知识点总结!
|
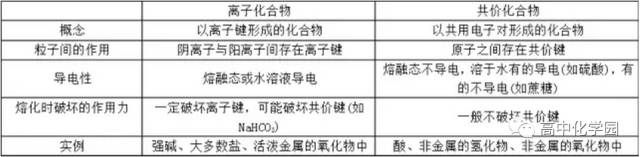
化学反应本质就是旧化学键断裂和新化学键形成的过程。 (1)离子化合物:由阳离子和阴离子构成的化合物。 大部分盐(包括所有铵盐),强碱,大部分金属氧化物,金属氢化物。 活泼的金属元素与活泼非金属元素形成的化合物中不一定都是以离子键结合的,如AICI3不是通过离子键结合的。非金属元素之间也可形成离子化合物,如铵盐都是离子化合物。 (2)共价化合物:主要以共价键结合形成的化合物,叫做共价化合物。 非金属氧化物,酸,弱碱,少部分盐,非金属氢化物。 (3)在离子化合物中一定含有离子键,可能含有共价键。在共价化合物中一定不存在离子键。 几组概念的对比 (1)离子键与共价键的比较
(2)离子化合物与共价化合物的比较
(3)化学键、分子间作用力、氢键的比较
物质中化学键的存在规律 (1)离子化合物中一定有离子键,可能还有共价键,简单离子组成的离子化合物中只有离子键,如:NaCl、Na2O等。复杂离子(原子团)组成的离子化合物中既有离子键又有共价键,如NH4Cl、NaOH等。 (2)既有离子键又有非极性键的物质,如Na2O2、CaC2等。 (3)共价化合物中只有共价键,一定没有离子键,如HCl、SiO2、C2H2等。 (4)同种非金属元素构成的单质中一般只含有非极性共价键,如I2、N2、P4等。 (5)由不同种非金属元素构成的化合物中含有极性键(如H2S、PCl3),或既有极性键又有非极性键(如H2O2、C2H2、C2H5OH),也可能既有离子键又有共价键(如铵盐)。 (6)稀有气体由单原子组成,无化学键,因此不是所有物质中都存在化学键。 电子式的书写 一、电子式 一、电子式 电子式是表示物质结构的一种式子。 在元素符号的周围用“·”或“×”等表示原子或离子的最外层电子的式子,叫电子式。 二、电子式的书写方法 二、电子式的书写方法 1、原子 在元素符号的周围用“·”或“×”等表示原子的最外层电子。 如:
2、离子 (1)金属阳离子的电子式就是离子符号。 如Mg2+既是镁离子符号,也是镁离子的电子式。 (2)阴离子的最外层大多为8电子结构,在表示离子的符号外加方括号,方括号的右上角标明所带电荷数及符号。 如Cl-的电子式:
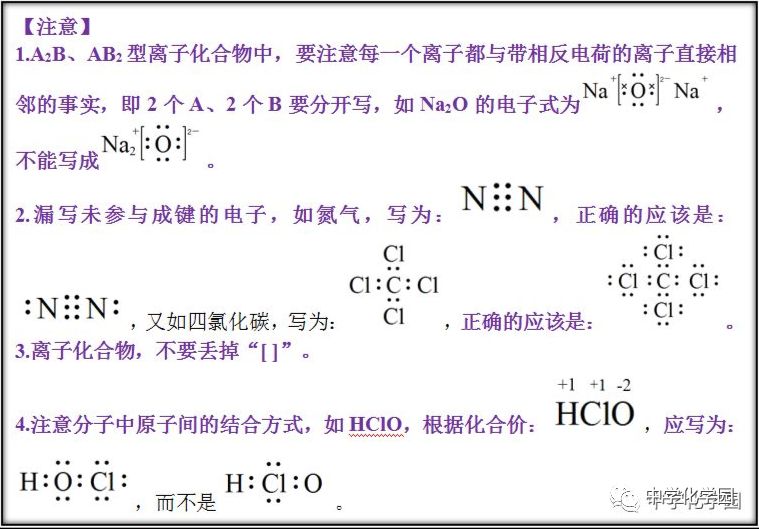
3、离子化合物 离子化合物的电子式由阴、阳离子的电子式合并而成。 如NaCl的电子式:
。 离子化合物中阴、阳离子个数比不是1∶1时,要注意同性离子不直接相邻的事实。 如MgBr2的电子式:
。 4、共价化合物 表示出原子之间形成共用电子对的情况,没有形成共用电子对的最外层电子也要标出。 如:Cl2的电子式:
; NH3的电子式:
。
三、高中常考化合物电子式汇总 三、高中常考化合物电子式汇总
说明:综合整理by中学化学园,转载请先联系并注明出处,违者必究~返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |