【高一化学】离子键和化学键的正确辨析 |
您所在的位置:网站首页 › 原子团构成的离子化合物 › 【高一化学】离子键和化学键的正确辨析 |
【高一化学】离子键和化学键的正确辨析
|
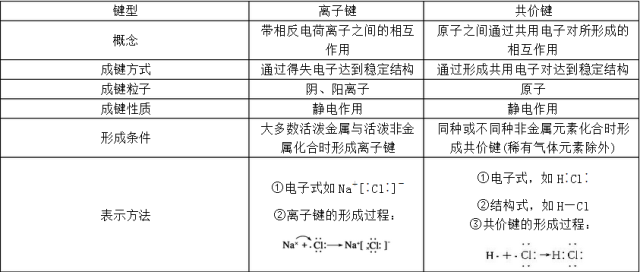
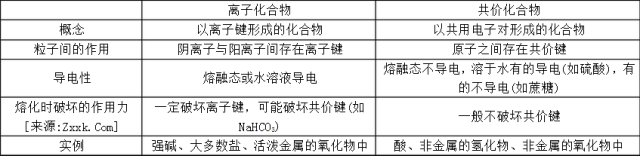
一、化学键 1.定义:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。 2.类型: Ⅰ离子键:由阴、阳离子之间通过静电作用所形成的化学键。 Ⅱ 共价键:原子之间通过共用电子对所形成的化学键。 ①极性键:在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。这样的共价键叫做极性共价键,简称极性键。 举例:HCl分子中的H-Cl键属于极性键。 ②非极性键:由同种元素的原子间形成的共价键,叫做非极性共价键。同种原子吸引共用电子对的能力相等,成键电子对匀称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。以非极性键结合形成的分子都是非极性分子。 Ⅲ 金属键:化学键的一种,主要在金属中存在。由自由电子及排列成晶格状的金属离子之间的静电吸引力组合而成。 二、化合物 1.离子化合物:由阳离子和阴离子构成的化合物。 大部分盐(包括所有铵盐),强碱,大部分金属氧化物,金属氢化物。 注意: 教材中在讲到离子键、共价键的形成条件时,一般讲“活泼金属与活泼非金属”元素间易形成离子键,而“非金属元素间”易形成共价键。 “活泼金属”一般指第IA族和第IIA族的钠、镁、钾、钙等金属,“活泼非金属”一般指第VIA族的氧元素和第VIIA族的氟、氯、溴等。 需要注意三个问题,一是“活泼金属”也可以与较不活泼的非金属形成离子键,如Na2S、KI等。二是金属元素与非金属元素也可以形成共价键,如氯化铝等,不过在中学阶段,一般考查到的金属元素与非金属元素形成的化学键均为离子键。三是非金属元素间也可以形成离子键,如NH4Cl等。 2.共价化合物:主要以共价键结合形成的化合物,叫做共价化合物。 非金属氧化物,酸,弱碱,少部分盐,非金属氢化物。 3.在离子化合物中一定含有离子键,可能含有共价键。在共价化合物中一定不存在离子键。 三、几组概念的对比 展开全文1.离子键与共价键的比较
2.离子化合物与共价化合物的比较
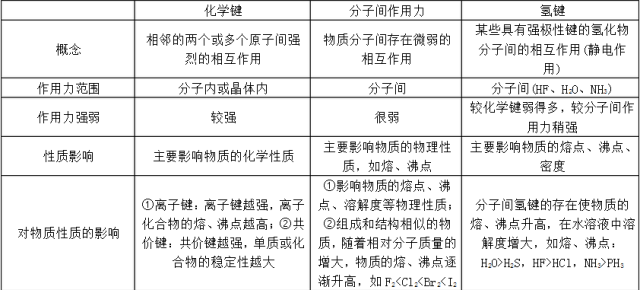
3.化学键、分子间作用力、氢键的比较
四、规律 离子化合物中一定有离子键,可能还有共价键,简单离子组成的离子化合物中只有离子键,如:NaCl、Na2O等。复杂离子(原子团)组成的离子化合物中既有离子键又有共价键,如NH4Cl、NaOH等。 既有离子键又有非极性键的物质,如Na2O2、CaC2等。 共价化合物中只有共价键,一定没有离子键,如HCl、SiO2、C2H2等。 同种非金属元素构成的单质中一般只含有非极性共价键,如I2、N2、P4等。 由不同种非金属元素构成的化合物中含有极性键(如H2S、PCl3),或既有极性键又有非极性键(如H2O2、C2H2、C2H5OH),也可能既有离子键又有共价键(如铵盐)。 稀有气体由单原子组成,无化学键,因此不是所有物质中都存在化学键 (来源:高中化学) “致贤教育”的两位主要创办者分别是 “四校”和老牌市重点中学的校长,他们不仅有着丰富的教育教学管理经验,而且本身都是市级学科名师、市教育考试院命题专家、学科竞赛辅导金牌教练。 “致贤教育”教师团队由 中小学学科竞赛辅导金牌教练、中高考命题专家、特级教师、学科带头人、市级名师组成,他们长期从事课堂教学工作,能够深刻理解课程标准;他们擅长于学习方法的总结提炼,他们 的教学效果非常优秀。 我是小编“小致” 如果您有任何想要了解的关于中高考备考信息以及致贤教育的事情,直接回复给本订阅号,我会很乐意为您服务噢! 长按下图并选择“识别二维码”关注我们的公众号,给我一个机会认识你,给你传递最新最快的沪上教育资讯!返回搜狐,查看更多 责任编辑: |
【本文地址】
今日新闻 |
推荐新闻 |