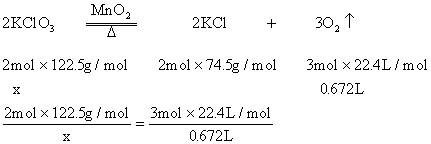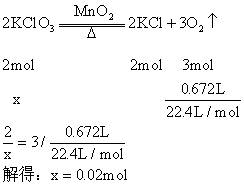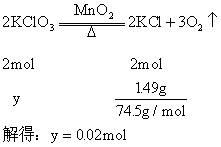高中化学:根据化学方程式计算的基本步骤 |
您所在的位置:网站首页 › xy方程式怎么解求步骤图解 › 高中化学:根据化学方程式计算的基本步骤 |
高中化学:根据化学方程式计算的基本步骤
|
原标题:高中化学:根据化学方程式计算的基本步骤 一、计算的基本步骤 1. 根据题意写出配平的化学方程式。 2. 求出已知物和未知物的摩尔质量(有时可用物质的量等分别写在化学方程式中有关的化学式下面,如果化学方程式中有关的化学式前面有化学计量数,必须用这个化学计量数去乘有关的摩尔质量)。 3. 把已知和要求的量(用x代表)分别写在化学方程式中有关化学式的下面。 4. 将有关的四个量列出比例式,求出未知数x。 5. 简明的写出答案。 二、应注意的问题 1. 化学方程式所表示的是纯净物之间的量的关系,因此不纯物质的量必须换算成纯净物的量,才能按化学方程式列出比例式进行计算。 2. 在比例式中,同一物质用同一单位,不同物质可以用两种不同的单位,只要注意它们成比例关系就行。 3. 如果是离子反应,可以根据离子方程式进行计算。如果是氧化还原反应,也可以利用电子转移关系进行有关计算。 例题:甲、乙两位学生用加热氯酸钾的方法制取氧气。甲取了一定质量的氯酸钾和0.10g二氧化锰,经混合后装入试管中加热,待收集到所需氧气时停止加热。试管冷却后,乙称得甲留下的反应混合物的质量为4.04g,将它继续加热,直到氯酸钾全部分解,得到氧气672mL(标准状况)。求甲实验时氯酸钾分解的百分率。 解析:从题给已知条件可知,解题时应从乙得到的氧气的量入手。 设乙分解的质量为x,甲分解的质量为y。
解得:x=2.45g 展开全文在4.04g混合物中:。即甲分解时得到的KCl质量为1.49g,由此可计算y: 解得:y=2.45g 故甲实验时分解的百分率为: 答:甲实验时氯酸钾分解的百分率为50%。 本题若从物质的量入手计算会更简便。 解:设乙分解的物质的量为x,甲分解的物质的量为y。
在4.04g混合物中:。即甲分解得到的的质量为1.49g,由此计算y:
故甲实验时分解的百分率为: 答:甲实验时氯酸钾分解的百分率为50%。 Tips: 大家在化学学习过程中还有哪方面知识学起来比较吃力,欢迎给化学姐留言,化学姐会尽力帮助大家。 精选文章推荐 知识点总结: | | | | | | | | | | | | | | | | | | 学习方法: | | | 本账号隶属于三好网,全国最具影响力的高中化学学习服务平台,每天提供最新的知识总结、学习方法、解题技巧、高考资讯、励志文章及在线答疑! ➲化学姐微信号:ziluolanzz ➲化学姐QQ:1656784903 ➲高中化学微信:gaozhonghuaxue100 感觉这篇文章对你有帮助的童鞋,点个吧!返回搜狐,查看更多 责任编辑: |
【本文地址】