药用植物质量标志物多糖生物合成通路及关键酶研究进展 |
您所在的位置:网站首页 › udp生物化学是什么意思 › 药用植物质量标志物多糖生物合成通路及关键酶研究进展 |
药用植物质量标志物多糖生物合成通路及关键酶研究进展
|
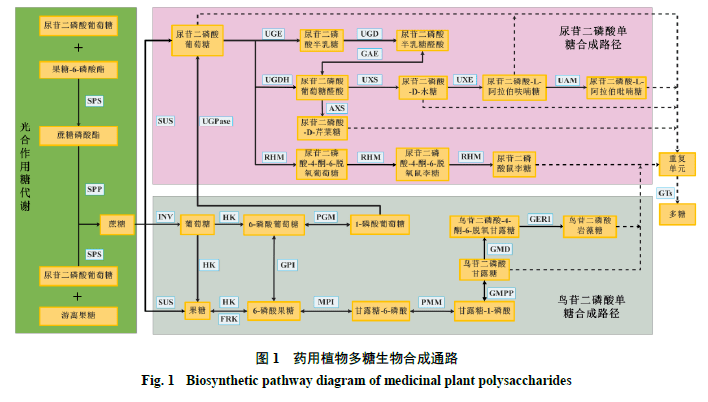
尽管植物多糖的结构千变万化,但合成通路基本保持一致。通过总结已发表的文献,发现植物多糖生物合成途径主要包括3个步骤:第1步为蔗糖经过一系列转化生成尿苷二磷酸葡萄糖(uridine diphosphate,UDP)-葡萄糖、鸟苷二磷酸甘露糖(guanosine diphosphate,GDP)-甘露糖和鸟苷二磷酸岩藻糖(guanosine diphosphate fucose,GDP)-岩藻糖;第2步为UDP-葡萄糖转化为其他NDP单糖;最后通过不同的糖基转移酶(glycosyl transferases,GTs)将单糖从糖核苷酸供体结合到生长中的多糖聚合物中,随后这些重复单元被聚合和输出,形成植物多糖(图1)[18-20]。UDP-葡萄糖是多糖合成途径中其他NDP单糖合成的基础,在整个合成的过程中起着至关重要的作用。
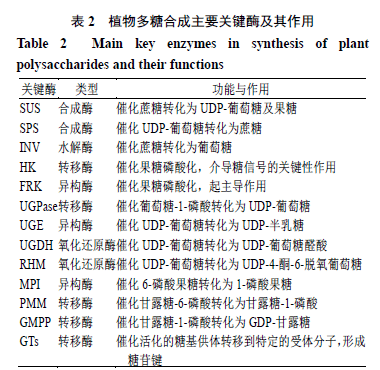
2.1蔗糖转化步骤 药用植物体内蔗糖主要通过光合作用形成。UDP-葡萄糖与果糖-6磷酸酯在蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)作用下合成蔗糖磷酸酯,再经过蔗糖磷酸酯酶(sucrose phosphate phoshatase,SPP)催化生成蔗糖或由游离果糖与UDP-葡萄糖在SPS催化下直接生成蔗糖。在多糖生物合成过程中,蔗糖转化部分包括3个不同方向:一个方向为在蔗糖合成酶(sucrose synthase,SUS)的作用下直接生成UDP-葡萄糖;另一个方向为蔗糖由转化酶(invertase,INV)催化生成葡萄糖,经己糖激酶(hexokinase,HK)催化生成6-磷酸葡萄糖,在磷酸葡萄糖变位酶(phosphoglucomutase,PGM)的作用下生成1-磷酸葡萄糖,再经UDP-葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGPase)生成UDP-葡萄糖;第3个方向为蔗糖由SUS催化生成果糖,经果糖激酶(fructokinase,FRK)转化为6-磷酸果糖,再由葡萄糖-6-磷酸异构酶(glucose-6- phosphate isomerase,GPI)转化为6-磷酸葡萄糖,然后在PGM的作用下转化为1-磷酸葡萄糖,最后由UGPase转化生成UDP-葡萄糖[21]。 此外,由蔗糖到GDP- 甘露糖和GDP- 岩藻糖的生物合成途径亦基本清楚。首先,由SUS 催化蔗糖生成果糖,再经HK 转化生成6- 磷酸果糖。而后6- 磷酸果糖经甘露糖-6- 磷酸异构酶(mannose-6- phosphate isomerase ,MPI )催化生成6- 磷酸甘露糖,再由磷酸甘露糖突变酶(phosphomannose isomerase ,PMM )转化为1- 磷酸甘露糖,最后在GDP- 甘露糖焦磷酸化酶(GDP-mannosepyrophosphorylase ,GMPP )的作用下形成GDP- 甘露糖。研究发现,GDP- 甘露糖可以通过2 个步骤形成GDP- 岩藻糖,首先在GDP- D - 甘露糖-4,6- 脱水酶(GDP- D -mannose-4,6-dehydratase ,GMD )的作用下将GDP- D - 甘露糖转化为GDP-4- 酮-6- 脱氧甘露糖,随之由GDP-4- 酮-6- 脱氧甘露糖-3,5- 表观酶-4- 还原酶(GDP-4-keto-6-deoxy- D -mannose-3,5- epimerase-4-reductase ,GER1 )催化形成GDP- 岩藻糖[22]。值得注意的是,GDP- 甘露糖也可以作为合成UDP- 鼠李糖、UDP- 岩藻糖、UDP- 半乳糖、UDP- 木糖等的前体物质[23]。 2.2 UDP-葡萄糖至其他NDP单糖转化步骤 2.2.1UDP- 半乳糖合成途径在UDP- 葡萄糖-4- 差向异构酶(UDP-glucose-4-epimerase ,UGE )作用下,UDP- 葡萄糖直接转化生成UDP- 半乳糖。而UDP 半乳糖又可经过半乳糖脱氢酶(UDP- D -galactosedehydrogenase ,UGD )催化生成尿苷二磷酸半乳糖醛酸,形成另一分支[24]。 2.2.2 UDP- 阿拉伯糖合成途径UDP- 葡萄糖经葡萄糖脱氢酶(UDP-glucose dehydrogenase ,UGDH )催化作用生成UDP- 葡萄糖醛酸之后再由UDP- 木糖合酶(UDP- D -xylose synthase ,UXS )作用下生成UDP- D - 木糖,随后继续由UDP- D - 木糖差向异构酶(UDP- D -xylosel-4-epimeras ,UXE )和阿拉伯吡喃糖变位酶(UDP-arabinopyranosemutase ,UAM )催化生成UDP- L - 阿拉伯呋喃糖,并可进一步催化为UDP- L - 阿拉伯吡喃糖。在该过程中,UDP- 葡萄糖醛酸也可经木糖合成酶(UDP- D -apiose/UDP- D -Xylose synthase ,AXS )催化生成UDP- D - 芹菜糖。此外,由于UDP- 葡萄糖醛酸和UDP- 半乳糖醛酸之间能够通过UDP- 葡萄糖醛酸异构酶(UDP- glucoseA-4- epimerase ,GAE )相互转化[25],故进一步增加了多糖构成的复杂性。 2.2.3UDP-鼠李糖合成途径以UDP-葡萄糖为底物,NAD + 和NADPH为辅因子,分3步反应催化UDP-鼠李糖[26],首先经鼠李糖合成酶(UDP-rhamnose synthase,RHM)催化生成UDP-葡萄糖-4-酮-6-脱氧葡萄糖,再由RHM催化生成UDP-4-酮-6-脱氧鼠李糖,最后在RHM催化下形成UDP-鼠李糖。 2.3 多糖聚合步骤 目前植物体内已知NDP 单糖有尿苷二磷酸单糖、鸟苷二磷酸单糖、胞苷二磷酸单糖等[27]。在天然产物生物合成的关键时刻,植物细胞质内形成UDP 单糖以及GDP 单糖之后,被核苷酸糖转运蛋白转运到高尔基体,在GTs 的作用下将这些单糖残基从活性核苷酸糖转移到延伸的多糖链上脱水、缩合从而形成多聚糖,并通过分泌囊泡的形式输送到不同部位进行积累[28-29]。 3多糖生物合成关键酶及作用机制 酶在多糖的合成途径中发挥着至关重要的作用,根据多糖合成通路步骤可将关键酶对应的分成3 个部分:第1 部分主要包括SUS 、SPS 、INV 、HK 、FRK 、UGPase 、MPI 、PMM 、GMPP ;第2 部分主要包括UGE 、UGDH 、URHM ;最后一部分主要是GTs ,其主要作用见表2 。
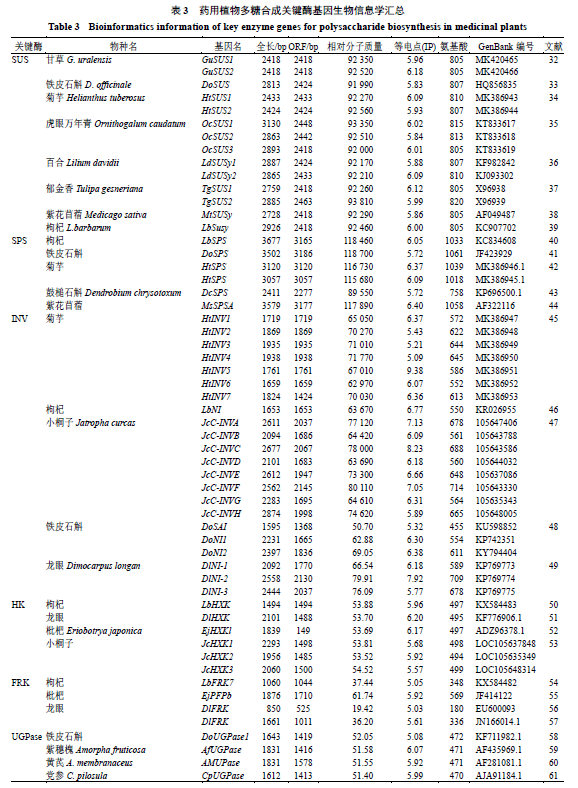
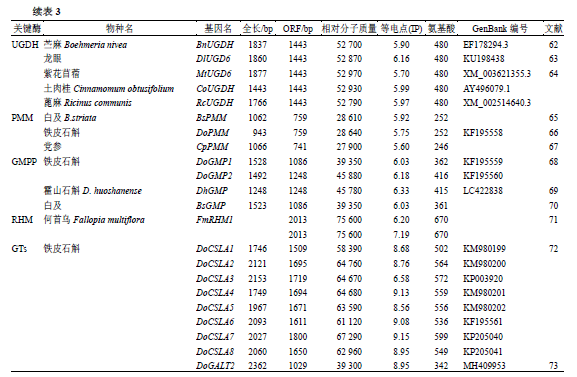
3.1SUS SUS 是植物体内参与蔗糖代谢的关键酶之一,在调控多糖合成中起到关键作用。SUS 能够催化蔗糖可逆裂解为果糖和UDP- 葡萄糖或腺苷二磷酸葡萄糖[30]。植物SUS 多肽链由N 端的细胞靶向结构域(cellular targeting domain ,CTD ),早期结瘤素(early nodulin ,ENOD )40 多肽结合结构域,典型的糖基转移酶折叠结构(GT-B )和C 末端组成[31]。目前已从8 种药用植物中克隆出了蔗糖合成酶基因,其开放阅读框约为2400 bp ,相对分子质量约为92 000 ,所编码的氨基酸序列为737 ~815 aa ,部分生物学信息见表3 。Zhang 等[32]从甘草中分别克隆出了GuSUS1 、GuSUS2 ,结合UDP 葡萄糖含量变化,说明两条基因编码的酶对蔗糖的裂解有催化作用,并且不同生长时期2 个基因的表达量存有差异。张园等[33]对铁皮石斛幼苗及二年生植株进行SUS 家族基因克隆,发现SUS 的结构和功能并未改变;二年生铁皮石斛SUS 基因表达量存在组织差异性,相对丰度为茎>叶>根。SUS 稳定性一直是该基因的关注点,对其进行稳定性进行分析,发现药用植物SUS 稳定性远低于细菌SUS ,原因可能是因为细菌N - 端截断所引起的[32],这为药用植物SUS 的应用提供了良好的思路。 3.2SPS 蔗糖磷酸合成酶被证明是多糖合成途径的第一个限速酶,在光合作用产物向蔗糖和淀粉的分配中起到关键调控作用[74]。目前已从5种药用植物中克隆获得了SPS基因,其开放阅读框约为3100 bp,所编码的氨基酸序列长度在758~1061 aa,相对分子质量约为110 000,见表3。王丽君等[40]从宁夏枸杞中获得了1个SPS基因(LbSPS),qRT-PCR结果显示,该基因在枸杞花中表达量最高,叶中表达水平较低。Aleman等[44]对紫花苜蓿中SPS基因进行了克隆及表达分析,发现MsSPSA表达增强在根瘤碳氮代谢中发挥着重要的作用。
3.3 INV INV 又称为β- 呋喃果糖苷酶,在药用植物中起到催化蔗糖降解为果糖和葡萄糖的作用,并参与细胞的渗透调节和贮藏器官中糖分的积累[75],为下游合成多糖提供底物,因此INV 是植物体内多糖合成的关键酶之一。目前已从5 种药用植物中克隆获得了INV 基因,其开放阅读框约为1900 bp ,所编码的氨基酸长度介于455 ~714 aa ,相对分子质量约为70 000 。INV 不可或缺的的保守结构域有NDPNG 、RDP 、WECVD [76],相关生物学信息见表3 。苗小荣等[48]从铁皮石斛中克隆出DoNI2 基因,qRT-PCR 结果发现DoNI2 基因在铁皮石斛根、茎和叶中均有表达,在茎中表达量最高,根中最低;且不同生长年限根茎中DoNI2 基因表达量与INV 酶活性呈显著正相关。Huang 等[77]研究表明通过Cu 胁迫中药羊蹄,发现根部酸性转化酶基因表达量与非胁迫条件下相比存在显著差异,且酸性转化酶活性与重金属耐性存在着一定关系。 3.4HK和FRK HK和FRK是植物体内催化果糖磷酸化的2个关键酶。HK和FRK在植物体是调节控制植物生长和发育的信号分子[78-79],是植物体内不可或缺的双功能酶[80],参与糖的信号传导,它对糖的调控贯穿了整个生长发育的过程,对植物体内许多基因的表达起到激活或阻遏的作用。目前报道的药用植物HK共有4种,多数HK基因含有9个外显子,开放阅读框约为1490 bp,共编码494~498 aa,相对分子质量在53 000左右,相对稳定。关于FRK,目前已从枸杞、龙眼、琵琶克隆获得,其放阅读框在1000~2000bp,共编码180~569aa氨基酸,相对分子质量约为36 000。部分生物学信息见表3。 Niu 等[12]对不同磷水平处理下的滇黄精进行了HiSeq2500 转录组测序,共筛选出20 种与黄精多糖生物合成相关的基因,其中黄精多糖含量与HK 基因的表达呈负相关。赵建华等[54]从枸杞中克隆获得了果糖激酶基因LbFRK7 ,发现LbFRK7 在不同组织中均有表达,果实中的表达量最高,根中最低;随着果实的发育,果实中LbFRK7 基因的表达量呈先升后降的变化趋势,这与果糖的磷酸化和积累密切相关。这些结果表明HK 和FRK 对药用植物多糖合成与积累发挥着重要作用。 3.5 UGPase UGPase是植物、动物和真菌体内葡萄糖代谢的关键酶,能够催化1-磷酸葡萄糖与尿苷三磷酸反应生成UDP-葡萄糖和焦磷酸盐,从而为药用植物合成纤维素、半纤维素、果胶、糖脂、糖蛋白等提供前体物质,因此也是多糖合成途径关键酶之一[81]。目前共从4 种药用植物中克隆获得了UGPase 基因,开放阅读框约为1500 bp ,编码465 ~510 aa ,相对分子质量在51 000 左右,部分生物学信息见表3 。孙晶等[58]研究了铁皮石斛不同组织部位中UGPase 基因的表达量,结果显示,石斛根和茎中UGPase 基因的表达量远高于叶中,且该基因的表达量在高年生石斛中随着木质化和糖分累积基本停止而降低。Wu 等[60]从膜荚黄芪中克隆了UGPase 基因AmUGPase ,并通过大肠杆菌异源表达功能验证发现,该酶能够在大肠杆菌中大量表达,表达量约为总细菌蛋白的40% ,Northern blotting 杂交结果表明AmUGPase 在黄芪的根、茎、叶及毛状根中均有表达,且在根和毛状根中的表达量较高。截至目前为止,UGPase 在多糖合成和积累中的作用机制仍不清楚,需进一步研究。 3.6 UGDH UGDH 广泛存在于动物、植物细胞中,是合成多种核苷酸糖的关键酶。UGDH 能够催化UDP- 葡萄糖转化为UDP- 葡萄糖醛酸,为细胞质膜上透明质酸、高尔基体中UDP- 木糖和蛋白多糖的合成及高等动物体内激素的葡萄糖醛酸化提供前体物质[82]。就药用植物而言,UGDH 的缺失会导致UDP- 木糖合成受限,进而影响UDP- 阿拉伯糖合成,导致严重的细胞壁组成缺陷,阻碍根系的发育。经统计,目前共从5 种药用植物中克隆获得了UGDH 基因,相对比较保守,其开放阅读框均为1443 bp ,由480 aa 编码而成,相对分子质量相对保持在52 000 ,相关生物学信息见表3 。刘峰等[62]、徐小萍等[63]分别从苎麻和龙眼中克隆了UGDH 基因BnUGDH 和DlUGD6 ,组织表达特性分析显示,BnUGDH 在根、茎、叶、皮中均有表达,且茎中的表达量最高;DlUGD6 在龙眼非胚性愈伤组织中表达量相对较高,推断DlUGD6 基因可能与龙眼生长发育各个阶段中细胞壁多糖合成密切相关。 3.7 PMM和GMPP PMM 和GMPP 是植物体内合成GDP- 甘露糖的关键酶,为GDP- 甘露糖的合成提供前体物质,在植物多糖合成中发挥着重要作用[83]。目前共从5 种药用植物体中克隆了PMM 家族基因,其开放阅读框在1000 bp 左右,编码246 ~258 aa ,相对分子质量约为28 000 ,相关生物学信息见表3 。He 等[66]从铁皮石斛中克隆了PMM 基因DoPMM ,其在根、茎、叶、花中均有表达,且处于营养期和生殖期时,茎中表达丰度较高,表明DoPMM 与石斛多糖合成密切相关;通过拟南芥中过表达实验发现,转基因 拟南芥中的多糖含量明显增加;此外,DoPMM在响应非生物胁迫中同样发挥着重要作用。曹守波等[67]发现霍山石斛PMM 基因CpPMM ,具有时空差异性,结果期表达量最高,且表达量与多糖含量呈显著相关性。 研究显示,目前已从白及、铁皮石斛、霍山石斛3 种药用植物中克隆出了GMPP 基因,开放阅读框在1086 ~1248 bp ,编码361 ~415 aa ,相对分子质量约为40 000 ,相关生物学信息见表3 。韩荣春等[69]从霍山石斛中克隆了DhGMP 基因,qPCR 实验结果显示,DhGMP 在霍山石斛根、茎、叶、花中均有表达,且茎中表达量最高,根中最低,且DhGMP 表达量与多糖的含量高度相关。以上结果表明PMM 和GMPP 基因在药用植物多糖生物合成中发挥着重要作用,但其作用机制仍需进一步研究。 3.8 RHM 在药用植物细胞内,RHM 是调控鼠李糖合成的关键酶之一,主要负责催化UDP- 葡萄糖转化为UDP- 鼠李糖。目前,关于植物RHM 研究报道较少,刘露等[71]从何首乌中克隆了RHM 基因FmRHM1 和FmRHM2 ,其开放阅读框均为2013 bp ,编码670 aa ,相对分子质量为75 000 ,qRT-PCR 实验结果显示,FmRHM1 和FmRHM2 基因在根中的表达量最低,与茎和叶相比均存在显著差异,说明FmRHM 基因可能与何首乌茎、叶中糖类生物代谢相关。 3.9 GTs 糖基化是大部分植物质量标志物生物合成的最后一步,GTs 作为该部分的关键酶,共有上百种酶参与了植物体内多糖的合成,起到催化形成糖苷键的作用。目前,CAZY 数据库(http://www.cazy.org/ )共注释了115 个GTs 基因家族,参与多糖的生物合成的GTs 主要有2 种类型:一种为含有单个跨膜结构域的GTs ,另一种为含有多个跨膜结构域的GTs [84]。药用植物多糖合成相关GTs 的研究主要集中于兰科植物石斛,先后克隆了9 条GTs 家族基因,开放阅读框为1000 ~2000 bp ,编码342 ~599 aa ,相对分子质量约为50 000 ,见表3 。He 等[72]克隆了8 条类纤维素合酶家族基因,其中将DoCSLA6 导入拟南芥之后,与野生型植株相比甘露糖的含量得到显著提高。Yu 等[73]所克隆的GT31 家族基因DoGALT2 ,在不同开花期该基因表达量与铁皮石斛花粉黏液多糖含量呈正相关,与野生型植株相比,DoGALT2 过表达植株半乳糖和含半乳糖的醇不溶性残基明显增高,并增强了对非生物胁迫的耐受性,表明该基因可能参与了半乳糖多糖的生物合成[73]。 4结语与展望 基于现有研究可知,光合作用糖代谢产物是植物多糖的合成基础物质,之后选择性的进入多糖合成通路,其中SUS 、INV 、UGPase 、FRK 、GTs 等关键酶在多糖聚合过程中发挥着重要作用;UGE 、UGDH 、RHM 在UDP- 葡萄糖的分配上作用显著;PMM 、PGM 则是鸟苷二磷酸单糖合成部分的关键酶。多糖作为诸多药用植物的质量标志物,因组成单糖的种类和组成方式不同,其相对分子质量和功能也大相径庭,相应的对关键酶基因的研究也不尽相同。横向比较发现,目前对以根茎为主要药用部位(黄精、玉竹、党参、白及、铁皮石斛等)植物多糖生物合成下游部分关键酶的研究多集中在GMPP 、PMM 。 质量标志物多糖是药用植物体内重要的代谢产物之一,具有显著的药理活性。由于难以从药用植物中获得足量且结构均一的多糖,满足生产和实践需求,通过化学合成、生物工程或者植物组织培养的方法来促进多糖生产已成为当下思考和研究的热点。比较发现生物代谢工程是发展多糖合成最具可行性的方法,但由于物质的合成是一个复杂的蛋白网络调控结果,故明确多糖生物合成中每一关键酶的作用机制和催化活性成为目前首要解决的问题。受限于技术手段和研究偏好,目前对多糖合成关键酶的研究多集中于基因生物信息学的分析、目标基因克隆和组织表达特性分析,对诸多关键酶的作用机制则鲜有报道。在后续研究中,可以通过异源表达、体外酶促催化、基因敲除、RNA 干扰等技术来明确多糖合成关键酶的作用机制和催化活性,为人工合成目标多糖奠定基础。 利益冲突所有作者均声明不存在利益冲突 参考文献(略) 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |