配合物的生成和性质 |
您所在的位置:网站首页 › 配位化合物实验报告结论是什么 › 配合物的生成和性质 |
配合物的生成和性质
|
配合物的生成和性质
时间:2024.7.5
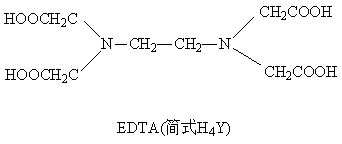
配合物的生成和性质 一、实验目的 1、比较并解释配离子的稳定性; 2、了解配位离解平衡与其它平衡之间的关系; 3. 了解配合物的一些应用。 二. 实验原理 中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体。配位个体处于配合物的内界。若带有电荷就称为配离子,带正电荷称为配阳离子,带负电荷称为配阴离子。配离子与带有相同数目的相反电荷的离子(外界)组成配位化合物,简称配合物。 简单金属离子在形成配离子后,其颜色,酸碱性,溶解性及氧化还原性都会变化。 配离子之间也可转化,又一种配离子转化为另一种稳定的配离子。 具有环状结构的配合物称为螯合物,螯合物的稳定性更大,且具有特征颜色。 三. 实验内容 1. 简单离子与配离子的区别 铁氰化钾 K3[Fe(CN)6]加SCN-无血红色 Fe3+ + nSCN- = [Fe(NCS)n]3-n有血红色 结论:FeCl3为离子型简单化合物,在水中可解离出大量的Fe3+,K3[Fe(CN)6]为配合物,配离子[Fe(CN)6]3-比较稳定,难以解离出大量的Fe3+。 2. 配离子稳定性的比较 (1) Fe3+ + n SCN- = [Fe(NCS)n]3-n(有血红色) [Fe(NCS)n]3-n+ (C2O4)22- → [Fe(C2O4)3]3- +SCN- 稳定性 [Fe(C2O4)3]3->[Fe(NCS)n]3-n (2)AgNO3+ NaCl →AgCl ↓(白) + NH3×H2O→ [Ag(NH3)2]+ [Ag(NH3)2]++ KBr →AgBr↓(淡黄色), 再滴加Na2S2O3溶液→ 沉淀溶解[Ag(S2O3)2]3-,滴加KI溶液→AgI↓ AgBr + 2S2O32- →[Ag(S2O3)2]3- + Br-; [Ag(S2O3)2]3- + I- → AgI↓+ 2S2O32- 比较:KSP?: AgCl >AgBr >AgI; 稳定性: [Ag(S2O3)2]3-> [Ag(NH3)2]+(3) I2 + [Fe(CN)6]4- = I- + [Fe(CN)6]3- E? (Fe3+/Fe2+) > E? (I2/I-) > E? ([Fe(CN)6]3-/[Fe(CN)6]4-) 稳定性[Fe(CN)6]3- >[Fe(CN)6]4- 3. 配位离解平衡的移动 2CuSO4 + 2NH3·H2O → Cu2(OH)2SO4↓+(NH4)2SO4 Cu2(OH)2SO4↓+8NH3·H2O→ [Cu(NH3)4]SO4 + [Cu(NH3)4](OH)2 + 4H2O (1) 利用酸碱反应破坏[Cu(NH3)4]2+ SO42- + 2[Cu(NH3)4]2+ + 6H+ + 2H2O = Cu2(OH)2SO4↓ + 8NH4+ (2) 利用沉淀反应破坏[Cu(NH3)4]2+ [Cu(NH3)4]2+ + S2- → CuS↓ + 4NH3 (3) 利用氧化还原反应破坏[Cu(NH3)4]2+ [Cu(NH3)4]2+ + Zn = [Zn(NH3)4]2+ + Cu (4) 利用生成更稳定配合物(螯合物)的方法破坏[Cu(NH3)4]2+ [Cu(NH3)4]2+ + edta4- → [Cu(edta)]2- + 4NH3 4. 配合物的某些应用 (1) 利用生成有色配合物定性鉴定某些离子 pH控制为5-10:Ni2+ + NH3×H20 +二乙酰二肟 → 鲜红色沉淀
(2) 利用生成配合物掩蔽干扰离子 Co2+ + 4SCN- → [Co(NCS)4]2- (溶于有机溶剂戊醇显蓝绿色) 而Fe3+ + n SCN- = [Fe(NCS)n]3-n(血红色) 会产生干扰 Fe3+掩蔽方法:Fe3+ + 6F- → [FeF6]3- (无色) (3) 硬水软化
问题:为什么加入edta二钠盐的溶液没有白色悬浮物产生? Ca2+ + edta4- = [Ca(edta)]2- Mg2+ + edta4- = [Mg(edta)]2- 基本操作: 1. 固体的取用(角匙(大头、小头)、纸条的使用、放入试管的方法) 2. 液体的取用 (胶头滴管的操作、勿弄混) 3. 离心机的使用 第二篇:4.配合物的生成和性质实验四 配合物的生成和性质 一、 实验目的 1. 加深理解配合物的组成和稳定性,了解配合物形成时的特性。 2. 初步学习利用配位溶解的方法分离常见混合阳离子。 3. 学习电动离心机的使用和固-液分离操作。 二、 实验原理 配位化合物与配位平衡 配位化合物的内、外层之间是靠离子键结合的,在水中是完全解离。而配位个体在水中是部分的、分步的解离,因此就存在解离平衡。 配合物的标准平衡常数 形成配合物时,常伴有溶液颜色、酸碱性、难溶电解质溶解度、中心离子氧化还原性的改变等特征。 利用配位溶解可以分离溶液中的某些离子。 三、实验内容 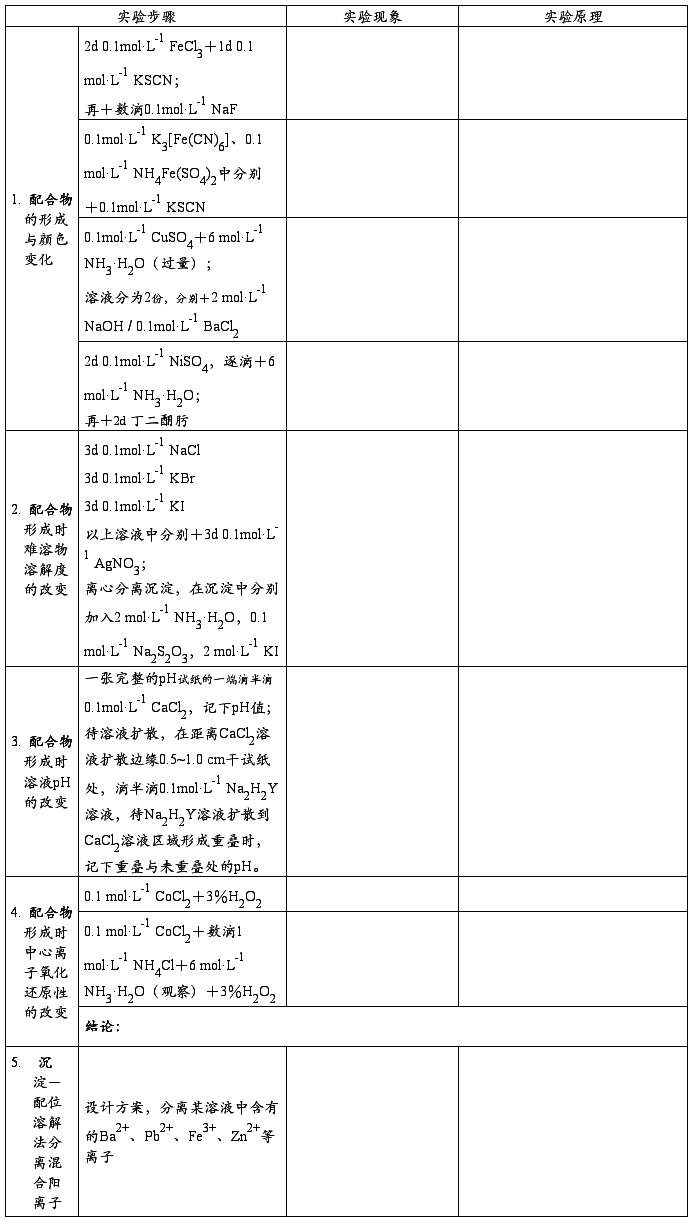
四、 注意事项 1. 使用离心机时要注意安全。 2. 及时记录实验过程中配合物的特征颜色。 3. 节约药品,废液倒入废液缸。 更多相关推荐: 配合物的生成和性质.新doc实验6配合物的生成与性质一实验目的1了解有关配合物的生成与性质2熟悉不稳定常数和稳定常数的意义3了解利用配合物的掩蔽效应鉴别离子的方法二实验原理中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体... 实验四 配合物的生成和性质(免费)实验四配合物的生成和性质1简单离子与配离子的区别铁氰化钾K3FeCN6加SCN无血红色Fe3nSCNFeNCSn3n有血红色结论FeCl3为离子型简单化合物在水中可解离出大量的Fe3K3FeCN6为配合物配离子... 配合物的生成和性质实验6配合物的生成与性质一实验目的1了解有关配合物的生成与性质2熟悉不稳定常数和稳定常数的意义3了解利用配合物的掩蔽效应鉴别离子的方法二实验原理中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体... 实验十一 配合物的生成、性质与应用实验十一配合物的生成性质和应用一实验目的1了解配合物的生成和组成2了解配合物与简单化合物的区别3了解配位平衡及其影响因素4了解螯合物的形成条件及稳定性二实验原理由中心离子或原子与配体按一定组成和空间构型以配位键... 配合物的生成和性质实验四配合物的生成和性质一实验目的1比较并解释配离子的稳定性2了解配位离解平衡与其它平衡之间的关系3了解配合物的一些应用二实验原理中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体配位个体处于配... 实验三_配合物的生成、性质与应用实验三配合物的生成性质和应用一实验目的1了解配合物的生成和组成2了解配合物与简单化合物合复盐的区别3了解配位平衡及其影响因素4了解螯合物的形成条件及稳定性5熟悉过滤盒试管的使用等基本操作二实验原理由中心离子或原... 配合物的生成和性质配合物的生成和性质一实验目的1了解有关配合物的生成配离子及简单离子的区别2比较配离子的稳定性了解配位平衡与沉淀反应氧化还原反应以及溶液酸度的关系二实验原理由一个简单的正离子和几个中性分子或其它离子结合而成的复杂... 实验六、配合物的生成、性质与应用实验六配合物的生成性质与应用一实验目的1了解几种不同类型的配合物的生成比较配合物与简单化合物和复盐的区别2了解影响配合平衡移动的因素3了解螯和物的形成条件4熟悉过滤和试管的使用等基本操作二实验原理由中心离子或原... 新编实验报告4(人教版高一)-碱金属单质及化合物的性质高中化学实验四碱金属单质及化合物的性质实验目的1认识金属钠的物理性质探究钠与氧气水反应2了解过氧化钠的物理性质探究过氧化钠与水二氧化碳的反应3实验碳酸钠与碳酸氢钠的重要性质4掌握焰色反应的实验操作实验器具仪器玻... 钠及其化合物的性质实验报告天水一中化学实验报告班级姓名同组人指导教师日期实验题目钠及其化合物的性质实验目的1通过钠及其化合物的性质实验加深对碱金属及其化合物性质的认识2初步学会利用焰色反应检验钾离子和钠离子实验器材及试剂器材试剂实验步骤... Ds区元素重要化合物的性质实验ds区元素铜银锌镉汞的性质一实验目的1掌握铜锌氢氧化物的酸碱性2掌握铜银锌汞的配合物的生成和性质6掌握铜银锌汞离子的分离与鉴定方法二实验原理IBIIBCuZnCu21Zn2AgCdAg1Cd2AuHgAu13H... 羧酸及其衍生物的物理性质目前位置首页gt羧酸及其衍生物gtK2羧酸及其衍生物的物理性质羧酸及其衍生物的物理性质教学目标1了解羧酸一般物理性质及其影响因素2掌握羧酸及其衍生物IR特征教学重点IR特征教学安排B5K1gtK210min一一... 配合物的生成和性质实验报告(18篇) |
【本文地址】
今日新闻 |
推荐新闻 |
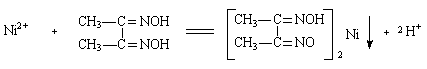
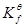 ,也被称为稳定平衡常数。
,也被称为稳定平衡常数。