2021年度CKD |
您所在的位置:网站首页 › 血管钙化图片高清 › 2021年度CKD |
2021年度CKD
|
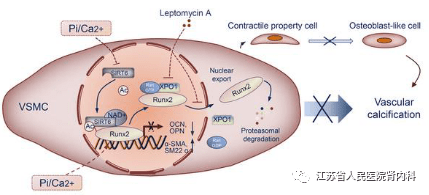
SIRT6 通过调控Runx2抑制慢性肾脏病中血管平滑肌的成骨转分化 IF:14.8 血管钙化(VC)是一种重要的病理改变,目前临床上缺乏有效的治疗方法,死亡率高。Sirtuin 6 (SIRT6) 是 Sirtuin 家族的成员,是III类组蛋白去乙酰化酶和关键的表观遗传调节因子。SIRT6在慢性肾脏病(CKD)患者中具有保护作用,但SIRT6在CKD患者VC中的确切作用及分子机制尚不清楚。黄辉教授团队证明SIRT6在CKD伴VC患者的外周血单个核细胞(PBMCs)和桡动脉组织中明显下调。在 CKD 中,SIRT6转基因(SIRT6-Tg)小鼠表现出VC的减轻,而血管平滑肌细胞(VSMCs)特异性敲除SIRT6小鼠表现出VC加重。SIRT6通过调控Runt相关转录因子2 (Runx2)抑制VSMCs的成骨转分化。免疫共沉淀(co-IP)和免疫沉淀(IP)实验证实SIRT6与Runx2结合。此外,Runx2被SIRT6去乙酰化,通过输出蛋白1 (XPO1)进一步促进核输出,进而通过泛素-蛋白酶体系统降解Runx2。这些结果表明SIRT6通过抑制VSMCs的成骨转分化来抑制VC的发生,因此靶向SIRT6可能成为CKD患者VC治疗的潜在靶点。
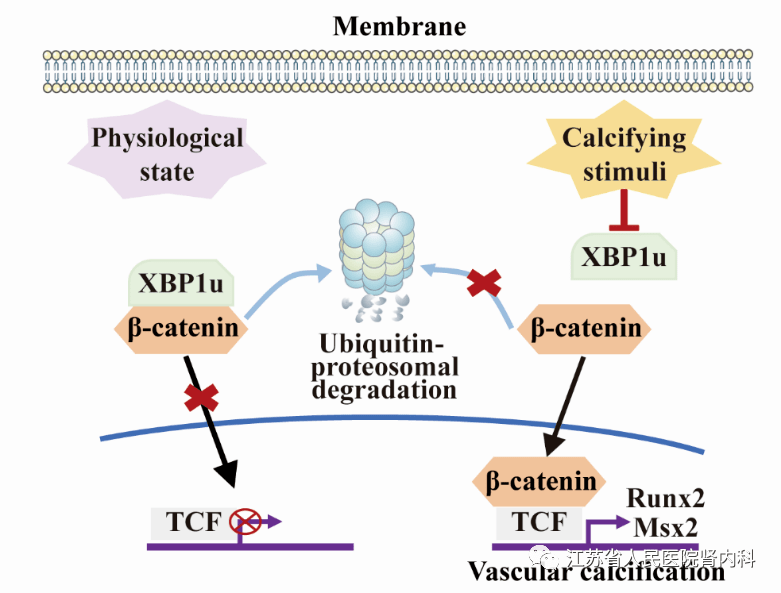
参考文献 03 非剪接型XBP1通过促进β-catenin降解抑制血管钙化 IF:17.4 血管钙化是慢性肾病的常见并发症,会增加心血管发病率和死亡率。XBP1(X-box)结合蛋白1以未剪接(XBP1u)和剪接(XBP1s)形式存在,是血管疾病中内质网应激的重要组成部分。然而,XBP1u是否参与血管钙化的发展尚不清楚。北京大学生理学与病理生理学系孔炜教授团队研究证实:XBP1u蛋白在高磷酸盐( Pi )诱导的钙化血管平滑肌细胞( VSMCs )、腺嘌呤饮食诱导的慢性肾功能衰竭( CRF )小鼠钙化主动脉和CRF患者钙化桡动脉中含量降低。结果:抑制XBP1u上调Runx2和Msx2的表达,并加剧高磷诱导的VSMC钙化。相反,高磷诱导的VSMC中XBP1u过表达显著抑制成骨分化和钙化。在腺嘌呤饮食喂养或5/6肾切诱导的小鼠慢性肾病小鼠模型中,平滑肌细胞特异性缺失XBP1小鼠血管钙化较对照组更严重。进一步的相互作用组分析表明,XBP1u通过其C端的降解结构域中的aa205-230直接结合β-catenin,促进β-catenin的泛素-蛋白酶体降解,抑制β-catenin/T细胞因子 (TCF)介导的Runx2和Msx2转录。敲除β-catenin消除了XBP1u缺乏对VSMC钙化的影响。该研究将XBP1u鉴定为一种新型的内源性血管钙化抑制剂,通过抑制β-catenin并促进其泛素-蛋白酶体降解,这代表了β-catenin的新调控途径和血管钙化治疗有希望的靶点。
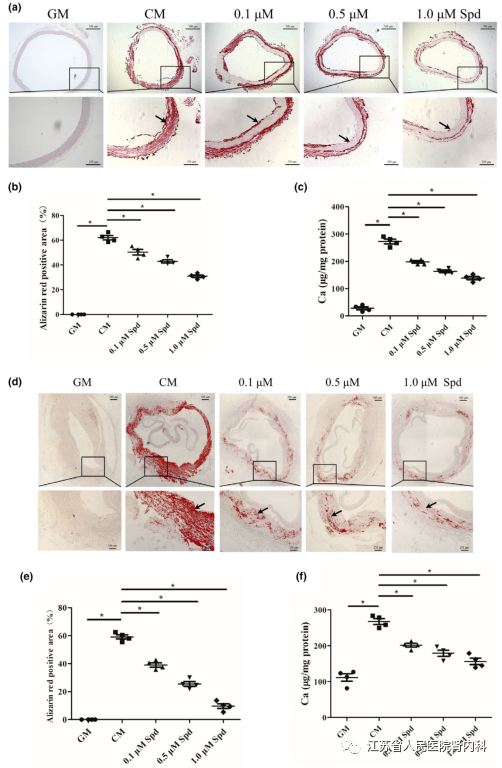
参考文献 04 亚精胺通过调控SIRT1信号通路抑制慢性肾病的血管钙化 IF:9.3 血管钙化是慢性肾脏病( CKD )患者和老年人常见的病理状态。已有研究证实,血管钙化是一种基因调控的生物学过程,类似于涉及成骨分化的成骨过程。但迄今为止,尚无针对血管钙化的有效治疗方法。天然多胺亚精胺已被证明能增加寿命,预防心血管疾病。补充亚精胺是否抑制CKD血管钙化尚不清楚。茜素红染色和钙含量测定显示,亚精胺处理显著减少了成骨条件下大鼠和人血管平滑肌细胞( VSMCs )的矿物质沉积。Western blot分析显示亚精胺处理抑制大鼠和人VSMCs的成骨分化。此外,亚精胺可显著降低CKD大鼠体内外动脉环钙化和主动脉钙化。亚精胺处理能诱导VSMC中Sirtuin 1(SIRT1)的上调,并导致内质网 (ER) 应激信号成分下调,如激活转录因子4 (ATF4)和CCAAT/增强子结合蛋白同源蛋白( CHOP )。无论是SIRT1抑制剂EX527对SIRT1的药理抑制还是siRNA敲低SIRT1均明显阻断了亚精胺对VSMC钙化的抑制作用。EX527解除了亚精胺对CKD大鼠主动脉钙化的抑制作用。该研究首次证明亚精胺通过上调SIRT1和抑制ER应激来减轻CKD血管钙化,这可能为CKD血管钙化提供了一种有前景的治疗方法。
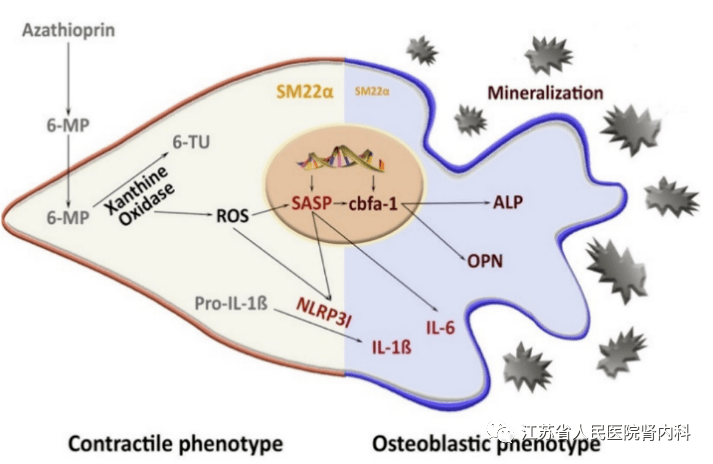
参考文献 05 大鼠硫唑嘌呤的长期治疗可诱导血管钙化IF:6.1 中膜血管钙化(mVC)与心血管疾病密切相关,尤其是慢性肾脏病(CKD)患者。即使肾移植成功后,患者心血管死亡率仍在增加。有证据表明免疫抑制药物可能影响血管壁的病理生理机制。此前,课题组体外研究表明,硫唑嘌呤(AZA)可以诱导血管平滑肌细胞(VSMCs)产生mVC。本研究在AZA处理24周的大鼠模型中证实了这种作用。AZA治疗后主动脉组织钙含量增加。其病理生理机制包括AZA通过黄嘌呤氧化酶(XO)催化6-硫氧嘧啶,随后诱导氧化应激。包括全身和主动脉组织中促炎性细胞因子如白介素(IL)-1β和IL-6,在AZA治疗后增加。此外,VSMC的核心结合因子α-1、碱性磷酸酶和骨桥蛋白的表达增加。在体外实验中,由于NLRP3-/-主动脉环中AZA效应可以减弱,因此信号通路可能至少部分依赖于NLRP3炎症小体。这些结果为AZA诱导VSMC钙化及其对血管结构的影响提供了进一步的证据,但后续有必要进行人体研究来证实AZA对血管硬化的有害影响。
参考文献 供稿|万慧婷 李凡 王宁宁 审核|王宁宁 张波 编辑|金鑫 潘艳艳【江苏省人民医院肾内科】返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |