Nature:单细胞RNA |
您所在的位置:网站首页 › 胎盘有哪些组织构成有何功能 › Nature:单细胞RNA |
Nature:单细胞RNA
|
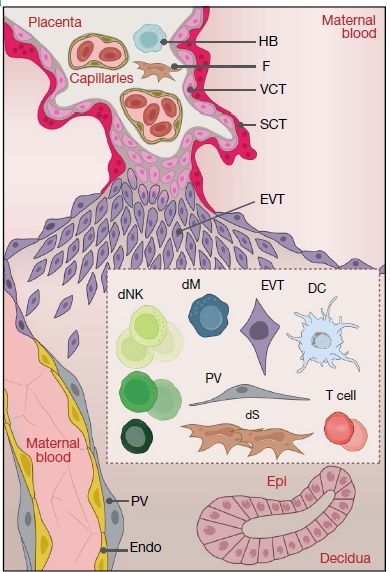
EVT具有独特的人类白细胞抗原(HLA)特性:它们不表达主要的T细胞配体,I类HLA-A、HLA-B或II类分子,但表达HLA-G、HLA-E和多态性HLA-C。这些滋养层HLA配体对应的受体由占主导地位的蜕膜免疫细胞(即dNK)表达,包括母体杀伤性免疫球蛋白样受体(KIR),其中一些与HLA-C分子结合。母体KIR和胎儿HLA-C基因变异的某些组合与妊娠疾病(如先兆子痫)有关,在先兆子痫中滋养细胞的侵袭能力不足。然而目前对孕早期蜕膜中细胞相互作用的了解不足。2018 年 11 月 15 日,桑格研究所、剑桥大学及纽卡斯尔大学的联合研究团队在 Nature 期刊发布重磅论文,展现了母胎界面的单细胞图谱,揭开了这些错综复杂的分子机制。
文章结果 1. 妊娠早期母体细胞图谱构建
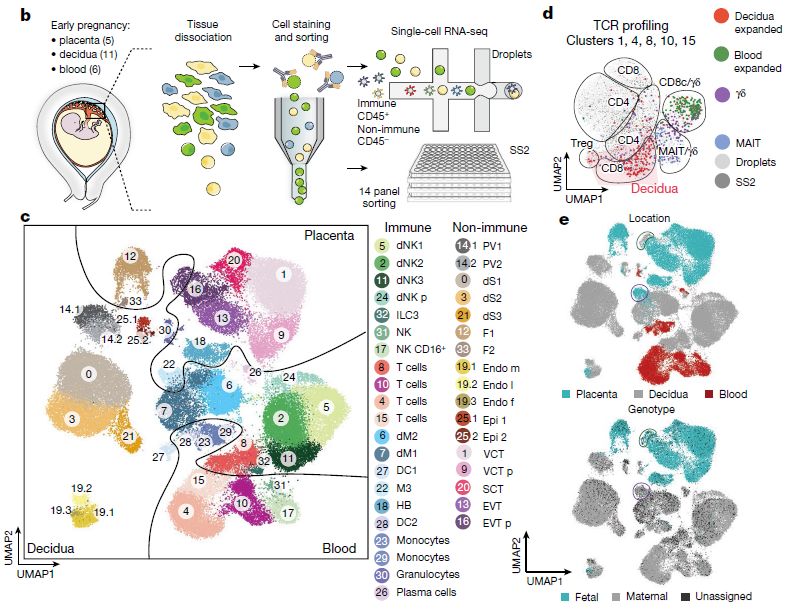
对来自早期(6-14孕周)母胎界面样本(11个蜕膜,5个胎盘,6个PBMC)的70000个单细胞进测序(10X Genomics)(上图b),构建母体-胎儿边界处的细胞图谱(DC:树突细胞;dM:蜕膜巨噬细胞;dS:蜕膜实质细胞;Endo:内皮细胞;Epi:腺上皮细胞;F:成纤维细胞;HB:霍夫包尔氏细胞;PV:血管周细胞;SCT:合体滋养细胞;VCT:绒毛细胞滋养层;EVT:绒毛外滋养细胞)(上图c); Smart-seq2 全长转录组研究T细胞组成和克隆扩增,其显示了蜕膜中 CD8 T 细胞的扩增(上图d); 单细胞RNA测序reads与母体和胎儿基因组进行mapping,通过分析SNP将细胞分配为胎儿源或母体源,发现其中蜕膜样品主要含有母体细胞以及少量胎儿HLA-G+EVT;胎盘样品中胎儿细胞占主导地位,但是也包含一些表达CD14、S100A9、CD163、CD68和CSF1R的母体巨噬细胞(上图e)。 2. CellPhoneDB数据库预测的细胞通信
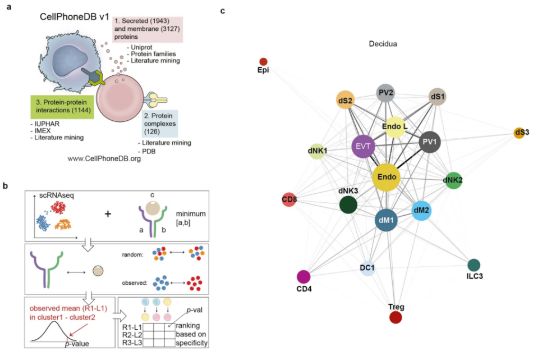
为了系统地研究蜕膜-胎盘界面中胎儿和母体细胞之间的相互作用,作者开发了一个配体-受体相互作用的数据库(www.CellPhoneDB.org),该数据库可以预测分析不同细胞类型之间的分子相互作用。数据库构建时考虑了每种细胞类型中配体和受体的表达水平,并凭借经验计算配体-受体关系对的细胞类型特异性,这种预测到的细胞群之间的分子相互作用是通过特定的蛋白质复合物实现的,并在蜕膜和胎盘中产生潜在的细胞-细胞通讯网络。 3. 单细胞测序分析滋养层分化
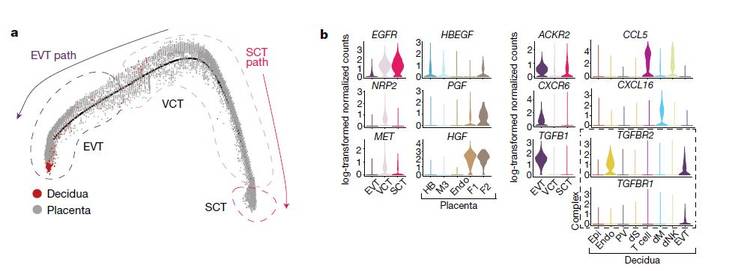
为了研究蜕膜-胎盘界面的母婴相互作用,研究人员首先分析了从胎盘和蜕膜样本中分离出来的胎儿滋养层细胞(后者包含侵入性EVT)。拟时序分析发现两种不同的滋养层分化途径,包括EVT路径(绒毛外滋养细胞)和SCT路径(合体滋养细胞),蜕膜EVT处于轨迹的末端,具有高水平的HLA-G表达并且不再表达细胞周期基因(上图a); 对于绒毛滋养层细胞,CellPhoneDB预测到其表达的细胞增殖和分化的受体(EGFR,NRP2和MET)与胎盘中其他细胞表达的相应配体存在相互作用,例如与EGFR相互作用的HBEGF由胎盘Hofbauer细胞表达,PGF和HGF(NRP2和MET的各自配体)由不同的胎盘成纤维细胞亚群表达(上图b); 在 EVT 分化期间,与免疫调节、细胞粘附和侵袭相关的受体表达上调,其配体由蜕膜细胞表达,例如ACKR2是由母体免疫细胞产生的炎性细胞因子的诱饵受体,其配体CCL5主要由蜕膜T细胞表达。CXCR6是趋化因子受体,可与母体蜕膜巨噬细胞表达的CXCL16结合,另外TGFB1(其功能是抑制免疫应答并激活上皮-间充质转化)自身其受体表达随着EVT的分化而增加(上图b)。另外上皮-间质转化过程中相关基因(例如PAPPA和PAPPA2,它们编码与细胞入侵有关的金属蛋白酶)在分化轨迹末端表达上调。在怀孕期间,PAPPA水平降低是先兆子痫和胎儿生长受限的生物标志物,这与EVT侵袭性缺陷有关。 4. 两个蜕膜层中的基质细胞分析
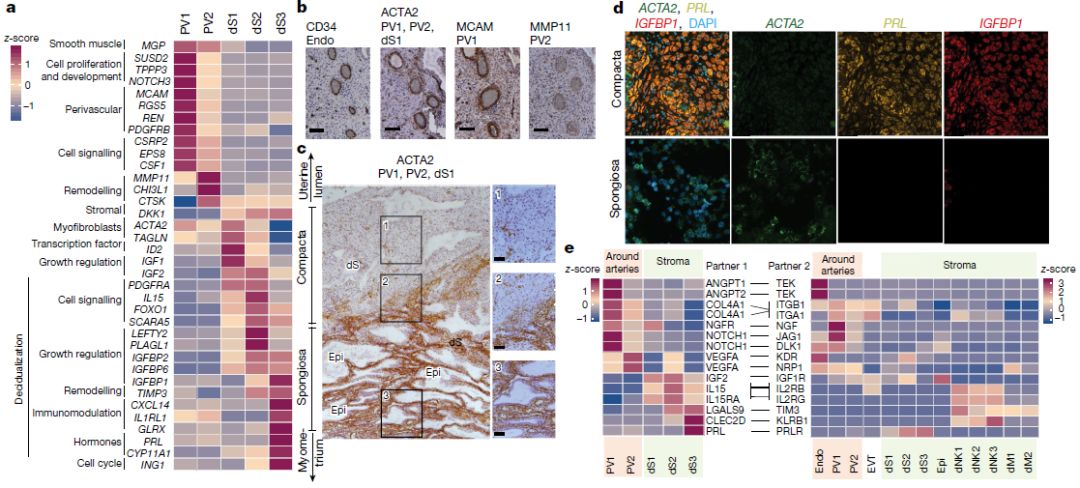
EVT开始是通过表面上皮侵入到紧密蜕膜中,蜕膜之下是含有分泌性腺体的海绵状蜕膜,为孕早期提供营养营养。单细胞测序在蜕膜基质细胞中鉴定了两组血管周细胞(PV1和PV2),它们均表达平滑肌标记物MGP,两种血管周细胞通过不同水平的MCAM区分, MCAM在PV1高表达而MMP11在PV2中高表达(上图a); 另外蜕膜基质细胞中鉴定了三种基质细胞(dS1,dS2和dS3),所有基质细胞均表达WNT抑制剂DKK1。dS1与PV1和PV2均表达ACTA2和TAGLN的,不表达经典蜕膜标记物催乳素(PRL)和IGFBP1,dS2和dS3表达IGFBP1、IGFBP2和IGFBP6,dS3表达PRL以及参与类固醇生物合成的基因(上图b); 免疫组织化学以及多重单分子荧光原位杂交(smFISH)实验证实,表达ACTA2和MCAM的细胞存在于螺旋动脉的平滑肌中,同时也监测到MMP11,这表明PV1和PV2均在血管周围(上图b、c、d)。ACTA2+dS1细胞存在于海绵体蜕膜的腺体之间,而IGFBP1+和PRL+dS2和dS3细胞位于紧密蜕膜中(上图c)。CYP11A1在致密蜕膜中比在海绵蜕膜中表达更高。 CellPhoneDB工具预测发现,由PV1和PV2表达的血管生成因子(例如ANGPT1和VEGFA)的同源受体位于内皮中(上图e)。EVT首先侵入了蜕膜,蜕膜中dS2和dS3高表达LGALS9和CLEC2D,这些分子可以与它们各自的抑制性受体TIM3(也称为HAVCR2)和KLRB1相互作用(二者均由dNK亚群表达),从而使基质能够抑制蜕膜中的炎症反应。 5. 蜕膜层NK细胞分析
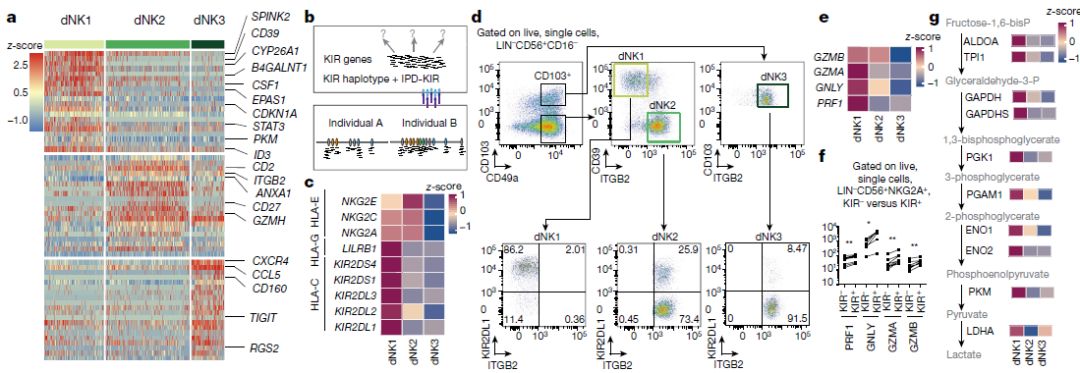
单细胞测序结果中鉴定到三个主要的 dNK 亚群(dNK1、dNK2 和 dNK3),它们共同表达CD49A (组织驻留标志物)和 CD9,dNK细胞表CD39(也称为ENTPD1),CYP26A1和B4GALNT1,而dNK2细胞的标志物是ANXA1和ITGB2,后者与dNK3细胞共享,另外dNK3细胞也表达CD160,KLRB1和CD103(也称为ITGAE),但不表达先天淋巴细胞标记CD127(也称为IL7R)(上图a); KIR家族的基因具有多态性且高度同源,这使得定量单个KIR基因的mRNA表达具有挑战性。研究人员以Smart-seq2全长转录本数据为参考,将每个样本的单细胞reads映射到各自KIR等位基因,开发了“ KIRid”方法对单个KIR基因表达进行定量。发现dNK1细胞高表达可以与HLA-C分子结合的KIR:抑制性受体KIR2DL1,KIR2DL2、KIR2DL3和活化受体KIR2DS1、KIR2DS4。LILRB1是与二聚体形式HLA-G分子具有高度亲和力的受体,仅由dNK1细胞表达。dNK1和dNK2都表达HLA-E的活化受体NKG2C(也称为KLRC2)和NKG2E(也称为KLRC3)以及抑制性受体NKG2A(也称为KLRC1),这些结果预示着可能的功能 dNK1在识别和响应EVT中的作用(上图c)。 使用CD49a(由常驻dNKs表达)并结合转录组学数据得到的CD39,ITGB2,CD103和KIR2DL1对6个蜕膜样本进行dNK分选,确定了三个dNK细胞群体的存在以及dNK1中KIR2DL1高表达(上图d)。对分选的dNK 细胞做 Giemsa 染色并分析它们的形态,发现 dNK1比 dNK2 和 dNK3 含有更多的细胞质颗粒,且PRF1,GNLY,GZMA和GZMB在dNK1高表达,与单细胞测序结果一致(上图e);与 KIR-dNK 细胞相比,在 KIR+dNK中发现更高水平的颗粒蛋白质表达(PRF1、GNLY、GZMA 和 GZMB)(上图f);dNK1 细胞也高表达参与糖酵解的酶(上图g)。因此,dNK1细胞的特征在于活跃的糖酵解代谢,并显示出较高的KIR基因(KIR2DS1,KIR2DS4,KIR2DL1,KIR2DL2和KIR2DL3)、LILRB1和细胞质颗粒蛋白的表达,表明dNK1细胞与EVT存在特别相互作用。 6. 孕早期免疫调节
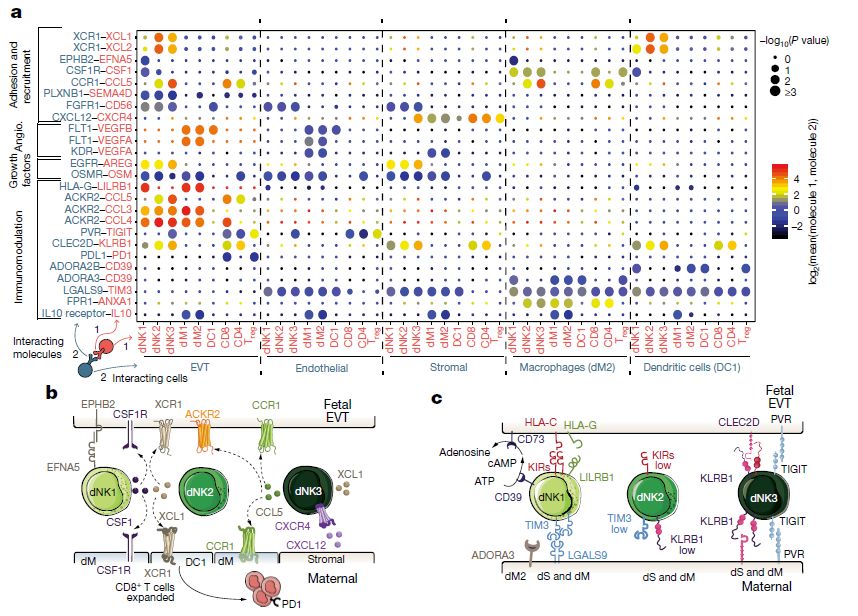
接下来,研究人员使用CellPhoneDB识别dNKs表达的细胞因子和趋化因子,并预测它们在母胎界面与其他细胞的相互作用(上图a)。首先与之前的研究相反,没有在体内发现大量VEGFA或IFNG表达的证据,这可能是因为以前的研究使用的是与IL-2或IL-15体外培养的dNK细胞。 dNK1细胞表达更高水平的 CSF1,其受体(CSF1R)由 EVT和巨噬细胞表达;dNK2 和 dNK3 表达高水平的 XCL1,CCL5在dNK3高度表达,其受体CCR1由EVT表达,表明 dNK3在调节EVT侵袭中起到作用。XCL1-XCR1配体-受体复合物的表达模式表明dNK2和dNK3与EVT和DC1之间存在功能性相互作用,与 DC2 相比, DC1 的比例增加,这可能导致蜕膜 CD8+ T 细胞的扩增;但 PD1 的共表达表明局部T细胞活化有限。 数据显示,在蜕膜微环境中所有破坏性的母体T细胞或NK细胞对胎儿滋养细胞的反应被阻止:在EVT中PDL1(CD274)高表达;另外除了先前讨论的KIR2DL1,KIR2DL2或KIR2DL3与HLA-C之间的受体-配体复合物外,还确定了dNK与EVT之间的推定抑制性相互作用,包括由dNK3细胞高表达的KLRB1和TIGIT,可能与由EVT表达的CLEC2D和PVR结合(上图b)。 研究人员还预测蜕膜的免疫微环境可防止滋养细胞侵入和由滋养层破坏螺旋动脉平滑肌介质引起的炎症反应(上图c),蜕膜巨噬细胞亚群表达免疫调节分子,例如IL10,其受体由EVT和母体内皮细胞、基质细胞和骨髓细胞表达。dNK1细胞高表达SPINK2,dNK2和dNK3细胞高表达ANXA1,这两种基因都编码具有抗炎作用的蛋白质,例如抑制激肽释放酶。dNK1表达CD39(由ENTPD1编码),其与CD73(由NT5E编码)一起将ATP转化为腺苷以防止免疫激活;CD73在上皮腺和EVT中高表达,并且腺苷受体(ADORA3)存在于巨噬细胞中。KIR2DL1+dNK1细胞与HLA-G+EVT紧密接触(,这表明它们可以将细胞外ATP(细胞死亡后释放的炎症信号)转化为腺苷。 总结 研究人员对来自孕早期(6-14孕周)的11例样本的 70000 个细胞进行了单细胞 RNA 测序,揭示了不同细胞类型的复杂性以及胎儿细胞与母体细胞之间的通讯方式。其中,细胞间通讯网络表明,母亲的免疫系统与胎盘植入之间的关系非常密切,为解决先兆子痫、流产等妊娠疾病提供了基础。此外,该研究对癌症领域也有一定意义:肿瘤细胞可以利用类似的机制逃避免疫系统,并提取新的血液供应,为肿瘤生长提供营养和氧气。正如文章通讯作者SarahTeichmann博士所述:“首个人类妊娠早期细胞图谱为我们提供了发育初始阶段的重要参考图,它将改变我们对健康发育的认识,并帮助我们了解胎盘和母体细胞如何更好的沟通以支持妊娠,这将有助于研究各种妊娠障碍和癌细胞逃逸途径(This first Human Cell Atlas of early pregnancy gives us a referencemap of this vital initial phase of development. It will transform ourunderstanding of healthy development, and is helping us understand how theplacental and maternal cells communicate with each other to support pregnancy.This will shed light on disorders of pregnancy, and could also help understandpathways that cancer cells exploit) 。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |