中国结直肠癌诊疗规范(2020年版) |
您所在的位置:网站首页 › 结直肠癌影像学诊断 › 中国结直肠癌诊疗规范(2020年版) |
中国结直肠癌诊疗规范(2020年版)
|
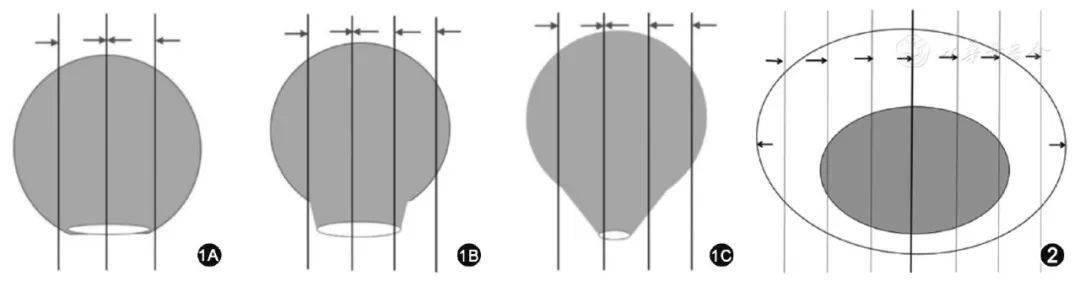
(4)腹部肿块。 (5)肠梗阻相关症状。 (6)全身症状,如贫血、消瘦、乏力、低热等。 2.2 疾病史和家族史 (1)结直肠癌发病可能与以下疾病相关:溃疡性结肠炎、结直肠息肉、克罗恩病、血吸虫病等,应详细询问患者相关病史。 (2)遗传性结直肠癌发病率约占结直肠癌总体发病率的6%,应详细询问患者相关家族史,包括遗传性非息肉病性结直肠癌、家族性腺瘤性息肉病等。 2.3 体格检查 (1)一般状况评价,了解全身浅表淋巴结特别是腹股沟及锁骨上淋巴结的情况。 (2)腹部视诊和触诊,检查有无肠型、肠蠕动波,腹部是否可触及肿块;腹部叩诊及听诊,了解有无移动性浊音及肠鸣音异常。 (3)直肠指检:对疑似结直肠癌者必须常规行直肠指检。了解直肠肿瘤大小、形状、质地、占肠壁周径的范围、基底部活动度、下缘距肛缘的距离、向肠外浸润情况、与周围器官的关系、有无盆底种植等。同时观察指套有无血染。 (4)三合诊:对女性直肠癌患者,如怀疑肿瘤侵犯阴道壁,推荐行三合诊,了解肿块与阴道后壁的关系。 2.4 实验室检查 (1)血常规:了解有无贫血。 (2)尿常规:观察有无血尿,结合泌尿系统影像学检查了解肿瘤是否侵犯泌尿系统。 (3)大便常规:注意有无红细胞、白细胞。 (4)大便隐血试验:对消化道少量出血的诊断有重要价值。 (5)血生化、电解质及肝肾功能。 (6)结直肠癌患者在诊断和治疗前,评价疗效和随访时必须检测外周血癌胚抗原、CA19-9;有肝转移患者建议检测甲胎蛋白;疑有腹膜、卵巢转移患者建议检测CA125。 2.5 内镜检查 直肠镜和乙状结肠镜适用于病变位置较低的结直肠病变。 疑似结直肠癌患者均推荐行全结肠镜检查,但以下情况除外。 (1)一般状况不佳,难以耐受。 (2)急性腹膜炎、肠穿孔、腹腔内广泛粘连。 (3)肛周或严重肠道感染。 内镜检查报告必须包括:进镜深度,肿物大小、距肛缘距离、形态、局部浸润的范围,对可疑病变必须行活检。 由于结肠肠管在检查时可能出现皱缩,因此内镜下所见肿物下缘距肛缘的距离可能存在误差,建议结合CT、MRI或钡剂灌肠明确病灶部位。 2.6 影像学检查 2.6.1 常用检查方法 (1)CT:推荐行胸部+全腹+盆腔CT增强扫描,用于以下几个方面。 ①结肠癌TNM分期:随访中筛查结直肠癌吻合口复发及远处转移。 ②判断结肠癌原发灶及转移瘤的新辅助治疗、转化治疗的效果。 ③鉴别钡剂灌肠或内镜发现的肠壁内和外在性压迫性病变的内部结构,明确其性质。 ④有MRI禁忌证的直肠癌患者;但CT评价直肠系膜筋膜状态的价值有限,尤其是低位直肠癌。 (2)MRI。 ①推荐MRI作为直肠癌常规检查项目。对于局部进展期直肠癌患者,需在新辅助治疗前后分别行基线和术前MRI检查,以评价新辅助治疗的效果。如无禁忌证,建议直肠癌行MRI扫描前肌注山莨菪碱抑制肠蠕动;建议行非抑脂、小视野轴位高分辨T2WI成像;推荐行磁共振弥散加权成像,尤其是新辅助治疗后的直肠癌患者;对于有MRI禁忌证的患者,可行CT增强扫描。 ②临床或超声、CT检查怀疑肝转移时,推荐行肝脏MRI增强成像(建议结合肝细胞特异性对比剂钆塞酸二钠)。 (3)超声影像学检查:推荐直肠腔内超声用于早期直肠癌(T2期及以下)分期诊断。 (4)X线检查:推荐气钡双重X线造影作为诊断结直肠癌的方法,但不能用于结直肠癌分期。疑有结肠梗阻的患者应谨慎选择。 (5)PET-CT:不推荐常规使用,但对于病情复杂、常规检查无法明确诊断的患者可作为有效的辅助检查手段。术前检查提示为Ⅲ期以上的结直肠癌,为了解有无远处转移,可推荐使用。 (6)排泄性尿路造影:不推荐术前常规检查,仅适用于肿瘤较大且可能侵及尿路的患者。 2.6.2 结肠癌临床关键问题的影像学评价 推荐行全腹+盆腔CT(平扫+增强)扫描,可以兼顾肿瘤本身及转移瘤好发部位肝脏。影像科医师需评价结肠癌TNM分期及有无壁外血管侵犯。其他远处转移瘤如肺转移瘤的筛查,推荐行胸部CT检查;PET-CT有助于筛查全身转移瘤。 2.6.3 直肠癌临床关键问题的影像学评价 (1)推荐直肠癌患者行盆腔MRI检查。需明确肿瘤的位置、TNM分期、直肠系膜筋膜状态、有无壁外血管侵犯。 (2)其他部位远处转移瘤的筛查,肺部推荐行胸部CT扫描;肝脏推荐行肝脏MRI增强成像、CT增强扫描或超声造影检查,如条件允许建议首选肝脏MRI增强成像;全身筛查建议行PET-CT。 2.6.4 推荐使用直肠癌MRI结构式报告,模板请参见附表2。 2.6.5 可使用结肠癌CT结构式报告,模板请参见附表3。 2.6.6 对于腹部检查考虑肝转移的病例,可使用结直肠癌肝转移瘤CT及MRI结构式报告,模板请参见附表4,5。 2.7 组织病理学检查 活检病理学报告是结直肠癌的治疗依据。活检诊断为浸润性癌的病例进行规范性结直肠癌治疗。因取材的限制,活检病理学检查不能确定有无黏膜下层浸润,诊断为高级别上皮内瘤变的病例,建议临床医师综合其他临床信息包括内镜或影像学检查评估的肿瘤大小、侵犯深度、是否可疑淋巴结转移等,确定治疗方案。低位直肠肿瘤可能涉及保肛决策时,建议病理科医师在报告中备注说明活检组织是否达到"癌变"程度。推荐对临床确诊为复发或转移性结直肠癌患者进行KRAS、NRAS基因突变检测,以指导肿瘤靶向治疗。BRAF V600E突变状态的评估应在RAS检测时同步进行,以对预后进行分层,指导临床治疗。推荐对所有结直肠癌患者进行错配修复蛋白表达或微卫星不稳定检测,用于遗传性非息肉病性结直肠癌筛查、预后分层及指导免疫治疗等。MLH1缺失的错配修复蛋白缺陷型肿瘤应行BRAF V600E突变分子和(或)MLH1甲基化检测,以评估发生遗传性非息肉病性结直肠癌的风险。结直肠癌抗人表皮生长因子受体2治疗的临床研究获得了可喜的成果,但目前尚无规范的检测判读标准,有条件的医疗中心可适当开展相关工作。 2.8 开腹或腹腔镜探查术 以下情况,建议行开腹或腹腔镜探查术。 (1)经过各种诊断手段尚不能明确诊断且高度怀疑结直肠肿瘤。 (2)出现肠梗阻,保守治疗无效。 (3)可疑出现肠穿孔。 (4)保守治疗无效的下消化道大出血。 2.9 结直肠癌的诊断步骤 结直肠癌诊断步骤参见附图1。诊断结束后推荐行cTNM分期(附录)。 三、标本取材与病理学评估 3.1 标本固定标准 (1)固定液:推荐使用10%中性缓冲甲醛水溶液,避免使用含有重金属的固定液。 (2)固定液量:必须大于或等于所固定标本体积的5倍。 (3)固定温度:正常室温。 (4)固定时间:标本应尽快剖开固定,离体到开始固定的时间不宜超过30 min。手术标本必须规范化剖开固定,建议由病理科医师进行。内镜下切除腺瘤或活检标本:推荐6~48 h;手术标本:12~48 h。 3.2 取材要求 3.2.1 活检标本 (1)核对临床送检标本数量,送检活检标本必须全部取材。 (2)将标本包于纱布或柔软的透水纸中以免丢失。 (3)每个蜡块内包含不超过5粒活检标本,并依据组织大小适当调整。 3.2.2 内镜切除标本 (1)标本固定建议由临床医师规范化处理:活检标本离体后,应由内镜医师及时将活检黏膜组织基底面黏附于滤纸上,立即浸入固定液中固定。内镜下黏膜切除标本离体后,内镜医师展开标本,黏膜面向上,使用大头针固定于软木板或泡沫板,标示口侧缘和肛侧缘,翻转令黏膜面朝下放入固定液中。息肉切除标本,有蒂息肉可直接放入固定液中,无蒂息肉用墨汁标记好切缘后放入固定液中。 (2)建议记录标本和肿瘤的大小、各方向距切缘的距离。 (3)息肉切除标本的取材:首先明确息肉的切缘、有无蒂部及蒂部的直径。建议用墨汁标涂蒂部切缘(有蒂)及烧灼切缘(无蒂)。取材时要考虑到能够客观正确地评价切缘和有蒂型息肉蒂部的浸润情况。 建议按如下方式取材:无蒂息肉以切缘基底部为中心向左、右两侧全部取材。有蒂息肉当蒂切缘最大径>2 mm时,略偏离蒂切缘中心处垂直于蒂切缘平面切开标本,再平行此切面,间隔2~3 mm将标本全部取材;蒂切缘最大径≤2 mm时,垂直于蒂切缘平面间隔2~3 mm将全部标本取材,将蒂部作为一个单独的蜡块(图1)。推荐按同一包埋方向全部取材。记录组织块对应的方位。
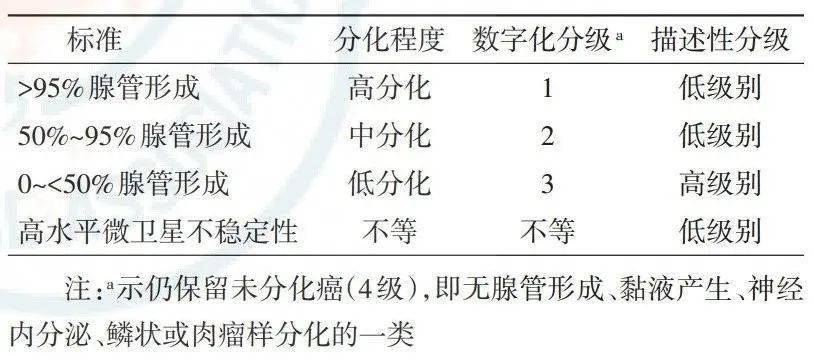
图1结直肠癌内镜切除标本取材方法示意图(箭头方向示推荐包埋方向):1A示无蒂息肉以切缘基底部为中心平行切开,向左、右两侧全部取材;1B示蒂切除最大径>2 mm的有蒂息肉垂直于蒂切缘平面,间隔2~3 mm将标本全部取材;1C示蒂切除最大径≤2 mm的有蒂息肉垂直于蒂切缘平面,间隔2~3 mm将全部标本取材,将蒂部作为一个单独的蜡块 图2内镜下黏膜切除术和黏膜剥离术标本取材示意图(箭头方向示推荐包埋方向):间隔2~3 mm平行切开标本,全部取材并按同一方向包埋 (4)内镜下黏膜切除术和黏膜剥离术标本的取材:由于肿物距切缘一般较近,切缘的评估尤其重要。建议涂以不同的颜料标记基底及侧切缘,以便在观察时能够对切缘做出定位,并评价肿瘤切缘情况。间隔2~3 mm平行切开标本(图2),如临床特别标记可适当调整,分成大小适宜的组织块,应全部取材并按同一方向包埋。 3.2.3 手术切除标本 (1)大体检查与记录:描述并记录肠管及肿瘤的大体特征,肿瘤与两侧切缘及放射状(环周)切缘的距离。推荐采用墨汁标记肿瘤对应的浆膜面及环周切缘,以准确评估肿瘤浸润深度及距切缘距离。淋巴结取材应按淋巴引流方向进行分组。建议临床医师将淋巴结分组送检(离体后病理科医师无法区分淋巴结分组)。 (2)取材。 ①沿肠壁长轴剪开肠管、垂直于肠壁切取肿瘤标本,肿瘤组织充分取材,视肿瘤大小、浸润深度,于不同质地、颜色的区域分别取材,肿瘤浸润最深处至少取1块全层厚度肿瘤及肠壁组织,以判断肿瘤侵犯的最深层次。仔细观察浆膜受累情况,当肿瘤临近或侵犯浆膜时,于可疑侵犯浆膜的区域取材,以便镜下准确判断浆膜受累情况。切取能够显示肿瘤与邻近黏膜关系的组织。 ②切取远侧、近侧手术切缘。推荐切取系膜及环周切缘,对于可疑系膜及环周切缘阳性的病例,建议于手术医师用墨汁标记的部分切取。建议尽量对不同切缘区分标记。 ③切除标本如包含回盲部或肛管、肛门,应当于回盲瓣、齿状线、肛缘切缘取材。如肿瘤累及上述部位,应切除充分显示病变程度的组织块。常规取材阑尾。 ④行中低位直肠癌根治术时需要完整切除直肠系膜,推荐病理科医师对手术标本进行系统检查及评价,包括系膜的完整性、环周切缘是否有肿瘤侵犯,病理学检查是评价直肠系膜完整性最直观的方法。 ⑤包埋所有检出的淋巴结,较大淋巴结应剖开包埋,未经新辅助治疗的根治术标本应至少检出12枚淋巴结。 ⑥新辅助治疗后的直肠癌手术标本,需仔细观察原肿瘤部位的改变并进行记录。如仍有较明显肿瘤,按常规方法进行取材。如肿瘤较小或肉眼无明显肿瘤,需根据治疗前肠镜等描述将原肿瘤所在范围全部取材。 (3)推荐取材组织块体积:小于或等于2.0 cm×1.5 cm×0.3 cm。 3.3 取材后标本处理原则和保留时限 (1)剩余标本的保存:取材剩余组织保存在标准固定液中,并始终保持充分的固定液量和甲醛浓度,避免标本干枯或因固定液量不足或甲醛浓度降低而发生组织腐变;以备根据镜下观察诊断需求而随时补充取材,或以备在病理学诊断报告签发后接到临床反馈信息时复查大体标本或补充取材。 (2)剩余标本处理的时限:建议在病理学诊断报告签发2周后,未接到临床反馈信息,未发生因外院会诊意见分歧而要求复审等情形后,由医疗中心自行处理。 (3)有条件的医疗中心最好低温保存新鲜组织,以备进一步研究使用。 3.4 病理学类型 3.4.1 早期(pT1期)结直肠癌 癌细胞穿透结直肠黏膜肌层浸润至黏膜下层,但未累及固有肌层,为早期结直肠癌(pT1期)。上皮重度异型增生及没有穿透黏膜肌层的癌称为高级别上皮内瘤变,包括局限于黏膜层、但有固有膜浸润的黏膜内癌。 如为内镜下或经肛的局部切除标本,建议对早期结直肠癌的黏膜下层浸润深度进行测量并分级。扁平病变当黏膜下层浸润深度≤1 000 μm时,为黏膜下层浅层浸润,是内镜治疗的适应证;当黏膜下层浸润深度>1 000 μm时,为黏膜下层深层浸润,需结合其他因素和临床情况考虑是否行外科手术扩大切除范围。黏膜肌层可以明确时,浸润深度为从黏膜肌层下缘至浸润最深处的距离,当黏膜肌层完全消失时,黏膜下层浸润深度从表面开始测量。有蒂病变分为两种情况,当黏膜肌层呈分支状生长时,以两侧肿瘤和非肿瘤交界点之间的连线为基线,基线以上的浸润视为头浸润,是内镜治疗的适应证;基线以下的浸润视为蒂浸润,相当于黏膜下层深层浸润,处理原则同上。当有蒂病变的黏膜肌层可以定位或不是呈分支状生长时,按扁平病变测量浸润深度。 3.4.2 进展期结直肠癌的大体类型 (1)隆起型。凡肿瘤的主体向肠腔内突出者,均属本型。 (2)溃疡型。肿瘤形成深达或贯穿肌层之溃疡者均属此型。 (3)浸润型。肿瘤向肠壁各层弥漫浸润,使局部肠壁增厚,但表面常无明显溃疡或隆起。 3.4.3 组织学类型 (1)腺癌,非特殊型。 (2)腺癌,特殊型,包括黏液腺癌、印戒细胞癌、锯齿状腺癌、微乳头状癌、髓样癌、筛状粉刺型腺癌。 (3)腺鳞癌。 (4)鳞状细胞癌。 (5)梭形细胞癌或肉瘤样癌。(6)未分化癌。 (7)其他特殊类型。 (8)癌,不能确定类型。 3.4.4 组织学分级 结直肠腺癌(非特殊型)组织学分级标准见表1。 表1结直肠腺癌(非特殊型)组织学分级标准(依据2010版WHO标准)
3.5 病理学报告内容 3.5.1 活检标本的病理学报告内容和要求 (1)患者基本信息及送检信息。 (2)如有上皮内瘤变(异型增生),报告分级。对于低位直肠肿瘤诊断为高级别上皮内瘤变时,因可能涉及治疗方案的决策,建议病理科医师在报告中备注说明活检组织有无达到"癌变"程度。 (3)如为浸润性癌,区分组织学类型。 (4)确定为结直肠癌时,推荐检测错配修复蛋白(MLH1、PMS2、MSH2、MSH6)表达情况。确定为无法手术切除的结直肠癌时,建议检测KRAS、NRAS、BRAF基因突变情况及其他相关基因状态。 临床医师应当了解活检标本的局限性,活检病理学检查不能完全确定有无黏膜下层浸润时,诊断为高级别上皮内瘤变,此时肿瘤主体可能为浸润性癌。 3.5.2 内镜切除标本的病理学报告内容和要求 (1)患者基本信息及送检信息。 (2)标本大小、肿瘤大小。 (3)上皮内瘤变(异型增生)的分级。 (4)如为穿透黏膜肌层浸润到黏膜下的浸润性癌,报告癌组织的组织学分型、分级、黏膜下层浸润深度、脉管侵犯情况、神经侵犯情况、水平切缘及垂直切缘情况,推荐检测错配修复蛋白(MLH1、PMS2、MSH2、MSH6)表达情况,建议报告肿瘤出芽分级。 如肿瘤具有3或4级分化、黏膜下深层浸润、脉管侵犯、基底切缘阳性(肿瘤距电灼切缘 |
【本文地址】
今日新闻 |
推荐新闻 |