免疫衰老的开始:T细胞衰老的 10 大特征 |
您所在的位置:网站首页 › 细胞衰老的5个特点 › 免疫衰老的开始:T细胞衰老的 10 大特征 |
免疫衰老的开始:T细胞衰老的 10 大特征
|
在这篇综述中,作者提出了十个可代表T细胞衰老的分子标志。这些标志分为四个主要标志(胸腺退化、线粒体功能障碍、遗传和表观遗传改变以及蛋白质稳态失衡)和四个次要标志(T细胞受体(T cell receptor,TCR)库的减少、原始记忆细胞失衡、T细胞衰老和效应细胞可塑性的丧失)。这些分子标志还共同解释了两个综合标志(免疫缺陷和炎症)的表征。现在的主要挑战之一是权衡这些标志对T细胞衰老的相对影响并了解它们的相互联系,最终目标是确定干预衰老过程的分子靶标。 生物体年龄的增长影响着机体的生理过程,并通过一系列机制从多个方面影响我们身体的大多数的细胞类型,比如从基因组稳定性丧失,表观遗传改变到蛋白质稳态的丧失、营养信号不足、线粒体功能障碍、细胞衰老、干细胞耗竭和异常的细胞间通讯。这些“衰老标志”中的大多数已在缺乏复杂适应性免疫系统的非脊椎动物模型(如线虫和果蝇)中被证实了,这表明衰老的主要机制的出现先于B和T细胞的进化,因此这些细胞类型的稳态功能并不涉及衰老过程的核心。 尽管有这种概念结构,但在小鼠身上有充分的证据表明,T细胞会经历主要的年龄依赖性变化,这会渐进性损害其生理功能,这与晚年发生自身免疫、自身炎症、感染和恶性疾病有关,甚至可以解释这些现象。因此,T细胞衰老可能是“免疫衰老”的主要特征之一,免疫系统活力的时间依赖性丧失会干扰有害元素(如微生物或恶性细胞)的消除,同时诱生导致自身炎症的非必要的过度反应和自身免疫性疾病。由于循环T细胞(肿瘤浸润性T细胞程度较轻)属于生物医学研究中容易获得的罕见细胞类型,人类循环T细胞的大量数据证实了这一观点,即随着健康状况的下降,T细胞经历了严重的功能恶化,这使得它成为了人类衰老研究的焦点。 最近在小鼠中进行的实验表明,在T细胞中进行加速其衰老的遗传操作,例如在T细胞中特异性敲除线粒体转录因子A(mitochondrial transcription factor A,TFAM),不仅会诱发导致T细胞衰老的免疫代谢功能障碍,而且还会导致全身健康状况恶化,并伴有多种与衰老相关的特征的改变,如代谢、肌肉骨骼、心血管和认知方面等。因此,T细胞的过早衰老可能具有“传染性”,即加速多个器官和系统的衰老。类似地,敲除穿孔素(该物质为T细胞和自然杀伤(NK)细胞的细胞毒性所需)导致的免疫缺陷会导致衰老细胞在多个小鼠器官中加速积累,从而加速衰老过程,这表明仅仅是免疫监视失效就可能导致机体出现全身衰老。 基于以上的思考,作者对T细胞衰老的具体机制以及T细胞的时间依赖性退化如何导致免疫衰老和一般衰老过程的问题产生了兴趣。在这里,作者提出了T细胞衰老的10个标志,包括四个主要标志(胸腺退化、线粒体功能障碍、遗传和表观遗传改变以及蛋白质稳态失衡)和四个次要标志(TCR库的减少、幼稚细胞记忆失衡、T细胞衰老、效应子可塑性降低),它们共同解释了两个综合特征(免疫缺陷和炎症)(图 1)。值得注意的是,T细胞衰老的这些特征是高度相关的,这意味着它们会相互影响并导致免疫系统衰老的共同特征出现。
胸腺退化 衰老过程中免疫系统发生的最有据可查的变化之一是胸腺的退化,胸腺是负责产生高度多样但经过选择的T细胞库的主要器官。人类的胸腺退化始于童年,在青春期前后达到顶峰。在小鼠中,胸腺退化似乎更缓慢,研究表明年老小鼠的胸腺依然可以发挥功能。与年龄相关的胸腺退化表现为组织结构的破坏、胸腺质量的减少以及胸腺细胞数量的下降(图 2)。这导致到达外围的幼稚T细胞的产生减少、记忆T细胞的代偿性克隆扩增以及外周T细胞库多样性的减少,从而影响病原体的检测。性类固醇水平的上升和生长因子(如生长激素、胰岛素样生长因子-1(insulin-like growth factor-1,IGF1)和角质形成细胞生长因子(keratinocyte growth factor,KGF))的产生减少都会导致与年龄相关的胸腺退化。因此,消除性类固醇的手术或化学阉割会诱导免疫系统的深度恢复。相反,身体压力、感染、肥胖、怀孕和抗肿瘤治疗会加速胸腺退化。外源性施用来自白细胞介素6(interleukin-6,IL-6)家族(如LIF、OSM和IL-6本身)的细胞因子或注射合成双链RNA聚肌苷酸(polycytidylic acid,pIC)等模拟病毒感染的方法均会触发年轻小鼠胸腺的退化。
图2 胸腺退化。随着年龄的增长,胸腺细胞的数量逐渐减少,伴随着组织结构的破坏、幼稚T细胞的减少和外周TCR的减少。Dn,CD4− CD8−双阴性胸腺细胞;DP,CD4+ CD8+双阳性胸腺细胞;DC,树突细胞;Ad,脂肪细胞。 老年人在受到化疗、电离辐射照射和感染(例如艾滋病毒-1)引起的损伤后无法恢复免疫功能,这导致了发病率和死亡率的增加。因此,增强胸腺输出功能和促进免疫重建便至关重要。长寿激素成纤维细胞生长因子21(fibroblast growthfactor-21,FGF21)可通过延迟与年龄相关的胸腺退化来抑制免疫衰老。在用KGF(也称为FGF7)处理的年轻小鼠中,胸腺上皮细胞(TEC) 隔室随着未成熟的TECs的分化而短暂扩张。这使胸腺生成和T细胞输出得到增强。 额外供应生长激素或瘦素或生长激素释放肽(ghrelin)等能量摄入调节激素可以防止压力介导的胸腺萎缩。注射Ghrelin可显著增大年老小鼠的胸腺、提升细胞数量和T细胞输出。白细胞介素-22(interleukin-22,IL-22)也能促进小鼠胸腺再生。值得注意的是,与不定期锻炼的年龄匹配的对照组相比,以一定的强度练习骑自行车的人在他们的生活表现出幼稚T细胞和近期胸腺移出 (recent thymic emigrants,RTE)的频率增加,以及胸腺保护细胞因子IL-7的循环水平升高(但促进胸腺萎缩的IL-6水平低)。在9名51至65岁的健康男性中进行的TRIIM临床试验中,在1年内通过生长激素、二甲双胍和脱氢表雄酮的组合成功实现胸腺再生和幼稚T细胞库的扩大。 除了激素和生长因子外,胸腺移植和适应性细胞转移可能会刺激小鼠的胸腺生成。当被移植到肾被膜下时,由过度表达FOXN1的胚胎成纤维细胞产生的TECs会刺激异位胸腺的新生。另一种方法是在胸腺内注射TECs来逆转衰老胸腺的萎缩,这一方法加强了自我反应性胸腺细胞的负向选择,从而减轻了炎症和T细胞衰老。 值得注意的是,导致正常的年龄相关性胸腺萎缩和胸腺输出丧失的确切机制仍然是很模糊的,阐明这些关键机制可能会为预防免疫衰老和延缓炎症的新策略的开发铺平道路。 线粒体退化 线粒体功能障碍发生在衰老的人类和小鼠的大多数组织和细胞类型中,包括T细胞。 尽管来自老年个体的T细胞比来自年轻对照个体的T细胞含有更丰富的线粒体蛋白,但它们被氧化磷酸化而受损,这表明细胞中累积着功能失调的线粒体,这可能由线粒体的自噬循环效率低下导致。慢性病毒感染中的持续抗原刺激也会损害ADP偶联的氧化磷酸化。线粒体不仅对生物能量学和细胞代谢(包括维持NAD/NADH比率)至关重要,对其他功能也至关重要。众所周知,线粒体是产生、传递和响应活性氧(ROS)或钙峰的信号中心。这些信号通路在老化的T细胞中失调。通过多种分子机制的组合, T细胞线粒体功能障碍通过多种分子机制的结合导致其出现促炎症表型,包括炎症代谢物的积累、表观遗传改变、转录后蛋白修饰、mtDNA释放到细胞质中,激活cGAS-STING通路,最终激活炎性小体和编码促炎细胞因子的基因的反式激活 。事实上,糖酵解代谢通过激活PI3K-AKT-FOXO信号通路来促进炎症反应,衰老的T细胞出现PI3K-AKT-mTOR和MAPK信号通路的激活。因此, 一种强制有氧糖酵解并减少氧化磷酸化的方法,缺失 Mpc1 基因(该基因编码线粒体丙酮酸载体的一个重要亚基)会改变胸腺细胞的分化并最终促进过度炎症性T细胞的扩增。此外,与许多其他细胞类型一样,在T细胞中,与年龄相关的线粒体衰退与衰老表型的获得有关。因此,抑制呼吸链复合物I的低剂量鱼藤酮可加速人类CD4 + T细胞的免疫衰老。此外,敲除T细胞中的TFAM会导致类似于年龄相关的T细胞功能障碍的早衰性线粒体功能障碍,并伴有紊乱的蛋白质沉积和1型辅助T(type1 helper T,TH1)促炎症表型的获得。重要的是,缺乏TFAM的T细胞会加速整体衰老并加重认知衰退和身体残疾的表型,诱发严重的心血管损伤,从而导致过早死亡。这些发现表明T细胞代谢在控制小鼠机体衰老和长寿方面发挥着核心作用。从机制上讲,TFAM缺陷型T细胞的 T H 1 表型似乎加剧了炎症,从而促进了多个组织的旁分泌衰老。 来自HIV感染者的调节性T(regulatory T,Treg)细胞的线粒体适应性降低可以被IL-15逆转,IL-15可以恢复PGC1α和TFAM的表达,从而刺激线粒体生物发生,并最终增强HIV特异性CD8+ T细胞的抗病毒效力。 使用目前正在临床试验中评估其延缓衰老作用的口服降糖药物二甲双胍治疗可增强小鼠CD8+ T细胞中的TFAM表达和线粒体功能,有利于解决结核分枝杆菌的感染。 同样,T细胞特异性过表达转基因PGC1α不仅维持线粒体的结构和功能适应度,而且促进CD8+ T细胞的持久性、记忆形成和抗原召回潜力。因此,来自过表达PGC1α的黑色素瘤浸润性CD8+ T细胞(melanoma-infiltrating CD8+ T lymphocytes,TIL)转移到无肿瘤宿主中时,其可保持更高的线粒体活性和更强的扩增能力,然后再被黑色素瘤细胞攻击。通过这些作用,PGC1α增强了抗肿瘤反应。线粒体增强策略已被用于恢复耗尽的TIL。 据报道,对于一小部分人来说,衰老与CD8+ T细胞产生的线粒体ROS增加之间存在相关性。此外,ROS清除剂处理可以在体外防止CD8+亚群中的端粒缩短,这可能指出了ROS和T细胞衰老之间存在联系。 生长分化因子15(growth differentiation factor 15,GDF15)是一种线粒体应激或功能障碍产生的线粒体因子。最近的临床前证据表明GDF15可以维持Treg细胞的免疫抑制功能并减缓炎症。这些数据支持了这样一个猜想,即干预内分泌因素(包括GDF15)可能为改善老年人免疫紧张提供一种新的策略。 总之,虽不完整,但这些证据支持恢复线粒体生物发生可能有助于避免或纠正与年龄相关的T细胞功能紊乱的想法。 遗传和表观遗传改变 与任何其他细胞类型一样,T细胞会随着年龄的增长而发生遗传和表观遗传改变。染色体改变在老化的T细胞中积累,表现出了T细胞白血病发病率的增加,这在日本人中比在欧洲人中更常见。造血干细胞突变(发生在克隆造血中)或低水平淋巴前体影响T细胞和其他血细胞类型,这取决于突变发生在干细胞层次的哪一级。显然,此类突变易倾向于或导致成人T细胞白血病和淋巴瘤的发展。 T细胞的基因组不稳定可能是由线粒体应激,ROS的过度产生和端粒磨损以及修复酶的活性降低导致。因此,与类风湿性关节炎(rheumatoid arthritis,RA)相关的T细胞过早老化与双链断裂修复核酸酶MRE11A的下调有因果关系,导致端粒损伤、近着丝粒异染色质展开和衰老标志物细胞周期蛋白依赖性激酶抑制剂1(cyclin-dependenTkinase inhibitor 1,CDKN1A,最广为人知的p21)和细胞周期蛋白依赖性激酶抑制剂2A(cyclin-dependenTkinase inhibitor 2A,CDKN2A,最广为人知的p16)的上调。此外,在携带人类滑膜的免疫缺陷小鼠中,来自RA患者的MRE11Alo T细胞的过继转移导致滑膜浸润和炎症,MRE11A重建减轻了这种现象。 所有主要的T细胞亚群,包括CD8+ α/β和γ/δ T细胞,都表现出与年龄相关的端粒长度减少,这在人类中受到慢性病毒感染的极大影响,尤其是巨细胞病毒(cytomegalovirus,CMV)。特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)是人类短端粒综合征最常见的表现。接受肺移植的IPF患者T细胞对CMV的免疫力受损,支持了端粒维持缺陷会损害T细胞功能的观点。因此,端粒酶突变的携带者可能会发展为T细胞免疫缺陷,这与内在和外在凋亡途径的上调有关,并导致危及生命的机会性感染。相反,与67至83岁的对照组和表现不佳的百岁老人相比,“高性能”接近健康的百岁老人的T细胞具有更长的端粒、更高的端粒酶活性和更高的增殖潜力。 表观遗传改变可能伴随着T细胞衰老,并在某种程度上解释了这一过程。这种表观遗传改变会影响DNA甲基化以及组蛋白状态及其多重翻译后修饰。DNA甲基化年龄在白细胞端粒长度(leukocyte-telomere length,LTL)短的个体中尤其提前,这与低水平的记忆CD8+ T细胞和高水平的幼稚CD8+ T细胞相关。在人类中,据报道,DNA甲基化组学中与年龄相关的表观遗传变化在约30岁晚期或40岁早期首次出现峰值,男性和女性出现的时间和幅度相似;男性的第二个峰值更早(提前5-6年)并且更强,这与男性的预期寿命缩短有关。其中一些表观遗传变化具有明确的功能后果,因为这已经被证明导致发生在记忆CD8+细胞中的IL-7R信号通路中断。 特定micro-RNA表达水平的改变也与衰老过程有关。例如,人类和小鼠T细胞都表现出与年龄相关的一种特定micro-RNA(miR-181a)的下降,这可能继发于转录因子YY1和TCF1的下降。成熟T细胞中miR-181a的条件性缺失的小鼠再现了多种类似于人类T细胞衰老中观察到的表型:负调节因子DUSP6-SIRT1的上调、T细胞扩增减少、由于抗病毒CD8+ T细胞反应受损导致的病毒清除失败,以及记忆CD4+ T细胞TCR库收缩导致的回忆反应不足。例如,缺乏miR-146的小鼠会出现慢性炎症,其中滤泡辅助性T(follicular helper T,TFH)细胞、生发中心(germinal center,GC)B细胞和自身抗体(针对双链DNA,但也针对多种器官特异性抗原)数量增加,这些抗体可以通过在CD4+ T细胞中特异性删除miR-155来逆转。值得注意的是,所有细胞中都缺乏miR-146的小鼠的寿命缩短可以通过CD4+ T细胞特异性敲除miR-155来挽救。与线粒体功能障碍对T细胞衰老的重要性一致(见上文),miR-146a–/– T细胞表现出增强的有氧糖酵解,在miR-155缺失后逆转。 总而言之,这些发现支持了这样一种观点,即多种遗传和表观遗传改变会导致T细胞衰老,进而可能影响整体健康状况和寿命。 蛋白稳态的丧失 去除错误折叠或老化的蛋白质是由蛋白水解酶(包括蛋白酶体)或自噬介导的。这两种系统中的任何一个出现缺陷都会导致T细胞老化。 在老年人中,钙蛋白酶和三肽基肽酶II(TPPII)的表达水平下降。TPPII的遗传缺陷(导致一种特定类型的免疫缺陷,埃文氏综合征(Evan综合征))与CD8+ T细胞的过早免疫衰老有关。在老年小鼠中,TCR信号对蛋白酶体的激活在CD4+ T细胞中下降。值得注意的是,蛋白酶体亚基Rpn13的T细胞特异性敲除可以增加衰老相关的PD-1+CD4+的T细胞的比例,这支持了蛋白酶体活性对T细胞具有有效延缓衰老作用的观点。 允许大蛋白聚集体和整个细胞器循环利用的唯一机制是巨噬(我们称之为“自噬”),其中部分细胞质被包裹在两层膜的囊泡中,自噬体随后与溶酶体融合以大量降解管腔内容物。随着年龄的增长,由于一系列因素,自噬趋于不足,这些因素可能包括:伴随代谢综合征的营养物质(葡萄糖和游离脂肪酸)和生长因子(胰岛素和IGF1)的增加,尤其是在肥胖的情况下,过度激活抑制自噬的mTORC1通路;由于烟酰胺二核苷酸(NAD)的年龄相关性下降,营养传感器(如Sirtuin-1)的激活水平降低;降低了促自噬蛋白的催眠依赖性翻译所需的亚精胺水平;并降低了自噬转染因子级联的激活,如FOXO1-TFEB轴。从逻辑上讲,自噬可以通过减少热量摄入(通过热量限制或间歇性禁食)和提供NAD前体如烟酰胺、精胺膳食补充剂来重建,从而增加健康寿命和寿命。 自噬的年龄依赖性下降也会影响T细胞。记忆T细胞和Treg细胞比效应T细胞更依赖氧化磷酸化,特别容易受到自噬抑制的影响,可能是因为自噬在线粒体质量控制中发挥重要作用。因此,获得性自噬缺陷可能导致伴随老年的免疫记忆和耐受性的下降,这与自噬对蛋白稳态和细胞器稳态、代谢、TCR触发的增殖和衰老和衰竭的的激活的多方面影响相关。自噬的药理学抑制会干扰人类记忆CD8+ T细胞的组织驻留重编程。此外,IGF1受体(IGF1R)的激活增强了mTORC1信号(抑制自噬)转导,增加了有氧糖酵解,并增加了Treg细胞的TH17分化,从而加剧了炎症和自身免疫表型。而用来抑制CD4+ T细胞自噬的基因操作,如敲除Atg16l1(自噬相关蛋白16-1)或Pik3c3(磷脂酰肌醇3-激酶催化亚基3,最普遍的是Vps34),会导致全身性炎症和肠道Treg细胞的丧失,这一现象可以通过Treg细胞特异性自噬基因的敲除来验证。因此,自噬具有至少部分由Treg细胞介导的抗炎作用。 根据这一结论,向分别在体外或体内分化的人或小鼠T细胞提供亚精胺,有利于原始CD4+ T细胞的自噬依赖性表型分化。在小鼠实验中,在饮用水中补充精氨酸也能促进肠道中Treg细胞的稳态分化。此外,mTORC1抑制剂雷帕霉素的短期给药可提高小鼠CD8+ T记忆细胞对病毒感染反应的质量和幅度,并提高老年人对流感病毒疫苗的免疫反应。对mTORC1的药理学抑制也降低了老年人的感染率(尤其是呼吸道感染)。在属于长寿家庭的个体中,与年龄匹配的对照组相比,CD4+ T细胞显示出改善激活诱导的自噬活性。 总之,这些结果表明,自噬是对抗T细胞衰老的有效靶点,诱导自噬可以减少炎症但同时提高免疫反应的灵敏度。 TCR库减少 TCR库随着年龄的变化而变化,这与随时间变化的多种因素有关:胸腺减少了原始T细胞的生成;克隆造血细胞赋予部分T细胞生长优势,无论其抗原特异性如何;外周抗原的持续选择,包括慢性病毒感染如巨细胞病毒CMV,导致“记忆膨胀”;以及可能由于克隆扩增的限制导致的T细胞亚群的衰老,这可能与端粒的侵蚀有关。后一种现象可能消除了识别CMV表位的高亲和力克隆的免疫优势,从而有利于向低亲和克隆的进化。此外,最近的研究表明,CD4+人类干细胞记忆T细胞(TSCM)库由于Wnt/β-catenin信号通路的丢失而经历年龄依赖性的损耗,这与Dickkopf相关蛋白1浓度的系统性增加有关,该蛋白是Wnt/β-catenin通路的天然抑制剂。 总之,现有的证据表明,内在和外在因素都有助于降低T细胞的TCR多样性(尤其在CD8+ T效应记忆器CD45RA+(TEMRA)亚群中),从而损害免疫功能,并导致自身抗原或持久性病毒(如CMV和Epstein-Barr病毒)特异性的T细胞不成比例的扩增。在纵向和横断面人口研究中都观察到TCR多样性的降低。 对大量TCR序列的详细分析表明,在衰老的个体中,原始T细胞的TCRβ CDR3长度、NDN插入和非模板添加N核苷酸的数量逐渐减少,以及CDR3环核心部分的物理化学性质的显著改变。这些改变在原始T细胞的CD4、CD8、富含RTE的细胞和成熟的CD4亚群中被发现。相比之下,在CD4+的原始T细胞库中观察到“公开性”(共享克隆型的一部分)的增加,但在CD8+的原始T细胞库中没有此变化。这些观察结果记录了α/βTCR库的部分收缩过程。值得注意的是,在人类中也存在与年龄相关的从Vγ9/ TEMRA 2到Vγ2/Vδ1记忆T细胞的年龄相关转变,这可能由外周选择或Vγ2/Vδ1细胞对衰老的固有抗性所驱动的。 因此,TCR库会随着年龄的增长而发生微妙的变化和部分收缩。然而,在这个阶段,这些变化是否会产生重大的功能影响,从而损害有效的外来抗原识别和避免自身免疫反应之间的微妙平衡,但这仍有待充分证明。向人类施用IL-7会增加体内TCR库的多样性,这可能是由于原始T细胞增殖水平的增加——这表明此类干预有可能导致了与年龄相关的TCR多样性的减少。这种干预是否能给临床实验带来益处仍有待确定。 原始记忆细胞失衡 T细胞能够识别的特异性抗原的数量与原始T细胞库中存在的克隆数量成正比,这是由人类和小鼠的物种特异性机制维持的。虽然RTEs的比例随着年龄的增长而下降,但在2岁的小鼠中也很容易检测到RTE,这表明它们有助于原始T细胞库的终身维持。事实上,在衰老过程中胸腺输出不足会导致隔室收缩,并最终导致小鼠T细胞库中出现漏洞。相比之下,人类的胸腺退化更为明显,这意味着原始T细胞库的维持依赖于现有克隆的外周分裂,而不是重新产生新的克隆细胞。因此,在没有胸腺输出的情况下,原始T细胞可以作为自身的干细胞发挥作用。随着年龄的增长,原始库随着高度分化记忆细胞的积累而收缩,这可能反映了T细胞谱系中干细胞样库的枯竭。Mold等人量化了基因组DNA中核弹试验衍生的14C,以确定CD4+和CD8+原始T细胞群的周转率,并发现这些动态变化在健康个体中随着年龄的增长而下降。值得注意的是,与CD4+原始T细胞相比,CD8+原始T细胞表现出体内稳态增殖减少。另外,关于人类T细胞原始记忆平衡的知识很大程度上局限于外周血,而外周血的研究远比组织驻留T细胞库要多得多。独立研究表明,肠道相关淋巴组织、淋巴结和脾脏中的原始T细胞随年龄的增加而减少。 如果将原始T细胞视为准干细胞,那么在衰老过程中损害干细胞功能的机制,如稳态失衡、分化增加和衰老,也可能会破坏原始T细胞的维持。除了T细胞的内在缺陷外,随着年龄的增长,次级淋巴器官的通路受损或结构改变也会影响稳态增殖。T细胞的外周稳态取决于它们向次级淋巴器官的募集,在那里它们遇到由成纤维母细胞网状细胞产生的IL-7。IL-7对原始T细胞周转的影响已经得到证实,即对人进行高水平的IL-7治疗性给药,短至1周即会促进原始T细胞的大量增加。IL-7治疗可诱导体内CD4+和CD8+ T细胞扩增,优先增加具有不同TCR库特异性的T细胞。这些效应主要是通过外周T细胞的增殖和存活的增加来介导的。 当稳态失衡时,原始T细胞向记忆T细胞分化。长期以来,人们一直认为记忆T细胞会因为终生的抗原刺激而随着年龄的增长不断积累。但由于大量证据发现细胞因子激活的T细胞(称为虚拟记忆T细胞),呈现出与传统抗原刺激产生的记忆细胞相似的表型,并随着小鼠衰老而积累,因此这一观点已被重新审视。但虚拟记忆T细胞缺乏抗原经验,对自身抗原具有高亲和力,并倾向于发展出细胞衰老的特征。某些细胞因子如IL-15和IL-4对虚拟记忆T细胞的分化至关重要。老化的CD8+ T细胞比CD4+ T细胞更容易分化成虚拟记忆细胞。因此,虚拟记忆T细胞的产生可能有利于原始CD8+ T细胞库的优先侵蚀。然而,仍然不确定这一机制是否充分解释了为什么CD4+ T细胞库比CD8+ T细胞库更有年龄弹性。 总之,现有数据表明,由于胸腺退化、持续的抗原刺激和炎症环境,记忆T细胞(其中一些缺乏抗原经验)富集,而原始库减少,这在CD8+库中更为明显。这种与记忆表型相关的过程损害了对新抗原的反应。因此,与年龄相关的原始T细胞数量、多样性和功能的下降为开发有效的老年人疫苗带来了重大挑战。与老年期产生的记忆反应相比,青年期或成年期产生的记忆反应似乎更持久。 T细胞衰老 衰老伴随着功能失调、终末分化的T细胞的积累。由于终生抗原刺激,尤其是在慢性病毒感染中,T细胞获得衰老或衰竭表型,从而限制了T细胞反应。虽然衰老和衰竭的T细胞具有重叠的特征,并且在TCR触发的增殖方面都有缺陷,但它们在分子信号传导和分泌表型方面是不同的。衰老的T细胞分泌大量的促炎因子,如肿瘤坏死因子(TNF)和骨钙蛋白,这与衰老相关的分泌表型(SASP)有关。 衰老T细胞具有额外的衰老特征,包括低端粒酶活性和短端粒、DNA损伤迹象如γH2AX病灶、抗凋亡和β-半乳糖苷酶活性。此外,衰老的T细胞失去了CD27和CD28的表达,并上调了如KLRG1等的终末分化标志物的表达。CD57是另一种用于识别人类衰老T细胞的终末分化标志物,这与CD57+ T细胞在体内大量增殖的事实相悖。与终末分化的T细胞获得衰老表型的观点一致,人类TEMRA细胞表现出了细胞衰老的许多特征,包括增殖减少、线粒体功能缺陷、TNF和干扰素-γ的分泌增加、强大的细胞毒性活性以及p38 MAPK信号传导的升高。 人类CD4+和CD8+ T细胞对衰老的敏感性不同,CD8+ T细胞能比CD4+ T细胞库更快地获得免疫衰老表型。TEMRA细胞存在于CD4+和CD8+ T细胞库中。虽然这两个亚群随着年龄的增长经历相同的表型和功能变化,但CD8+ TEMRA细胞的积累速度比CD4+细胞更快,这可能是由于代谢的差异。CD4 TEMRA细胞具有更健康的线粒体,而CD8+ TEMRA细胞更容易出现线粒体功能衰退。肿瘤抑制剂menin通过抑制细胞的代谢来阻止T细胞的衰老。Menin缺陷型CD8+ T细胞呈现衰老特征,包括β-半乳糖苷酶活性。在这些细胞中,mTORC1信号传导、糖酵解和谷氨酰胺分解增加,而使用雷帕霉素治疗可防止免疫衰老。Sestrins是调节T细胞衰老的应力感知蛋白。在CD8+ T细胞库中,sestrin诱导衰老样CD8+ T细胞重编程为先天样具有灭杀活性的细胞。因此,衰老样T细胞失去TCR的信号活性,并表达含有激活NK受体NKG2D和NK衔接分子DAP12的蛋白复合物,从而提高对表达NKG2D配体细胞的细胞毒性。在老年小鼠和超级百岁老人中发现了携带NK和NK受体KLRG1和,并产生高水平促炎因子(包括颗粒酶和穿孔素)的细胞毒性CD4+ T细胞。这种与年龄相关的T细胞亚群是否表现出额外的衰老特征,如增殖停滞、端粒缩短或DNA损伤,仍有待研究。 最近,有报道称Treg细胞在衰老过程中比效应T细胞衰老得更严重。DDB1和CUL4相关因子1(CAF1)在老年Treg细胞中的表达下调。该途径对于通过谷胱甘肽S-转移酶(GSTP1)缓冲ROS水平至关重要。因此,GSTP1和ROS清除剂的过表达重新激活了衰老Treg细胞的增殖和活性。 慢病毒感染可加速T细胞的衰老。重复的T细胞刺激和广泛的复制可诱导端粒消耗和DNA损伤,从而促进复制性衰老。事实上,CMV血清阳性个体的衰老T细胞的百分比明显高于CMV血清阴性个体。除了复制性衰老外,炎症应激信号、葡萄糖饥饿或线粒体功能障碍也可能导致T细胞的过早衰老。例如,虚拟记忆T细胞可以表达小鼠衰老表型标记物和衰老转录标记物。 衰老T细胞参与了某些年龄相关疾病的发病机制,如心血管、代谢和神经退行性疾病。将衰老T细胞转移到中年小鼠中可加速血管紧张素诱导的心血管损伤和肾纤维化。在肥胖小鼠中,具有CD4+CD44hiCD62LloPD-1+CD153+表型的衰老T细胞在内脏脂肪组织(VAT)中积累,它们在诱导慢性VAT炎症和代谢综合征中发挥关键作用。这种作用依赖于骨钙蛋白,因为在供体小鼠中敲除Spp1(编码骨钙蛋白的基因)消除了体内移植的衰老T细胞的致病作用。接种CD153肽疫苗可诱导产生抗CD153抗体,然后去除肥胖小鼠的衰老T细胞,提高葡萄糖耐受性。在阿尔茨海默病患者中,在外周血和脑脊液中发现TEMRA的比例增加,且此类T细胞通常对Epstein-Barr病毒抗原具有特异性。 PI3K和p38 MAPK信号通路参与诱导T细胞的衰老。原发性免疫缺陷中的高活性PI3激酶信号导致了PI3激酶delta综合征(APDS),促进了CD57+CD8+衰老T细胞群的过早积累。阻断p38 MAPK信号可以逆转TEMRA中的一些衰老相关缺陷,从而促进其增殖并增加端粒酶活性、线粒体生物发生和自噬。此外,使用抗KLRG1配体E-钙粘蛋白的抗体阻断KLRG1信号,通过AKT介导的诱导细胞周期蛋白D和E,和减少细胞周期蛋白抑制剂p27的表达来增强CD8+ T细胞的增殖。相比之下,KLRG1阻断剂不会影响端粒酶活性的降低。miR-155通过表观遗传抑制驱动终末分化和转录因子的耗竭来抑制CD8+ T细胞的衰老。据报道,多酚、益生菌和omega-3脂肪酸等植物化学物质也可以逆转免疫衰老。 总之,随着年龄的增长,免疫功能降低但促炎功能升高的衰老T细胞会不断积累,此类细胞的消耗(衰老溶解)可能为干预衰老和与年龄相关的疾病(包括代谢综合征和神经退行性疾病)提供靶点。 效应细胞可塑性的丧失 分化的CD4+ T细胞可以分为不同的亚型,包括TH1、TH2、TH9、TH17、TH22、TFH和Treg细胞。最近人们提出了新的谱系分类方式,即在抗原的诱导下,辅助T细胞会形成连续的极化表型进而发育成不同的谱系。随着年龄的增长,T细胞会失去静止状态并进入终末分化阶段,这可能会导致谱系发育的偏差,从而导致可塑性丧失,进而降低免疫系统应对新抗原刺激的能力。老年人的幼稚CD4+ T细胞中转化生长因子β受体3(TGFβR3)的表达增加,从而激活转录因子PU.1、BATF和IRF4,这会诱导T细胞向TH9分化。 在单细胞转录组学的基础上,衰老小鼠的CD4+ T细胞可以鉴定出耗竭的、细胞毒性的和激活的调节T细胞,这些细胞通常具有极端的抗炎和促炎特性,其中主要的亚群是TH1和TH17亚群。值得注意的是,这些亚群的出现与循环炎症细胞因子(主要是干扰素-β、IL-6和IL-27)升高有关,这个现象支持了炎症与CD4+ T细胞衰老相互作用的观点。在百岁老人中可以发现与衰老相关的细胞毒性CD4+ T细胞的扩增。在老年人或小鼠中,CD8+细胞群体的特征是T细胞的寡克隆和耗竭群体的扩增,这些T细胞分泌颗粒酶K(GZMK),这种因子可以刺激其他细胞的衰老,例如成纤维细胞。值得注意的是,这种CD8+GZMK+群体是由老化环境诱导的,如异体组织转移实验(将年轻的CD8+ T细胞注射到老年小鼠中)所示,并且与炎症标志物(如IL-6、IL-8和TNF)相关。 尽管老年小鼠的Treg细胞数量会增加,但它们在抑制常规T细胞功能方面的效率并不如年轻小鼠的Treg细胞。重要的是,淬灭ROS重新激活了衰老的Treg细胞的增殖和活性。类似地,在老年小鼠中,TFH细胞的数量也有所增加,然而,这些细胞变成了低效的B细胞助手,这可能是由于信号通路的缺陷导致的。 简而言之,T细胞的衰老与可塑性降低以及终末分化表型相关,从而损害了它们在应对新抗原刺激中的弹性。在肿瘤免疫学中,T细胞浸润肿瘤的功能功效可以被诱导多能干细胞(iPSC)技术恢复。是否可以选择类似的方法来恢复衰老T细胞的可塑性仍有待确定。 免疫缺陷 在老年人中T细胞表面受体减少、幼稚细胞、效应细胞/记忆细胞和Treg细胞之间比例发生变化,同时衰老或耗竭的T细胞会不断积累,这样一种进行性免疫缺陷可能会导致老年人容易被烈性的、甚至致命的细菌或病毒感染。此外,免疫功能缺陷也可能导致非传染性疾病(如癌症或动脉硬化)的发作。 事实上,数学模型表明,衰老过程中患癌风险的增加可能是由于胸腺功能的下降(随之而来的免疫功能下降)而不是体细胞DNA突变的积累。因此,由于T细胞免疫缺陷而逃逸免疫控制可能是衰老过程中癌症的主要驱动因素,这与免疫缺陷会加速致癌物诱导的癌症发病的观察结果一致。胸腺功能降低也与肾移植后长期死亡风险增加有关。然而,由于与终末期肾病相关的尿毒症本身会触发胸腺衰老以及外周白细胞的端粒缩短,因此这些现象之间可能是相互促进的。 可以推测,T细胞功能缺陷会导致衰老细胞不能及时清除,这会有助于衰老(非免疫)细胞在不同组织中的积累,但这仍有待证实。此外,衰老皮肤细胞避免免疫清除的主要策略之一是HLA-2的上调,HLA-2与抑制性受体NKG2A相互作用,这种抑制性受体由分化的CD8+ T细胞和NK细胞表达。因此,在这一点上,没有明确的证据表明衰老T细胞的特定功能损伤会影响衰老细胞的清除,从而加速衰老过程。因此,需要进一步的实验证据来证实T细胞特异的免疫监视缺陷会有助于衰老进程。 衰老相关慢性炎症 衰老相关慢性炎症是克劳迪奥·弗朗西斯(Claudio Franceschi)于2000年首次创造的术语,指的是随着年龄增长而发展的低度慢性炎症状态。它的特点是血清中具有高浓度的炎性细胞因子和介质,如C反应蛋白(CRP)、IL-6、IL-8和TNF。炎症发生与衰老相关的多种疾病和死亡率的风险增加有关。尽管炎症发生最初被认为是衰老相关疾病的生物标志物,但越来越多的证据表明炎症发生与年龄相关组织退化之间存在因果关系。临床试验表明,一些非甾体抗炎药以及IL-1和TNF的中和作用可以延缓心血管疾病的发展。 炎症发生被归因于与衰老相关的缺陷的组合,例如肠道通透性增加、慢性感染和衰老细胞的积累。最近的证据表明,T细胞的时间依赖性退化通过产生炎性细胞因子和未能消除衰老细胞,以及影响不同骨髓细胞(比如巨噬细胞亚型)的功能或通过调节肠道通透性,来直接或间接地促进炎症发生。 T细胞中的代谢应激可以加速炎症发生。由于TFAM缺陷,CD4+T细胞线粒体功能障碍的小鼠中炎症发生速度加快。Tfamfl/fl CD4Cre小鼠表现出低体重、驼背、代谢综合征、认知和身体残疾以及严重的心血管改变,包括心脏萎缩和主动脉壁重塑,导致过早死亡。值得注意的是,用依那西普阻断 TNF可防止全身衰老和肌肉、心血管和认知改变,这些改变通常可以在Tfamfl/fl CD4Cre小鼠中观察到。因此,TNF依赖性炎症导致Tfamfl/fl CD4Cre小鼠的衰弱和过早衰老。 除了导致与年龄相关的组织损伤外,炎症发生还可能抑制抗原特异性免疫以及降低疫苗接种效果。因此,可以通过使用p38 MAPK抑制剂短期抑制炎症发生来恢复老年人的组织特异性免疫。 但自相矛盾的是,除了炎症发生之外,IL-10(一种有效的抗炎细胞因子)的循环水平也在老年人中有所增加。IL-10可能在对抗炎症和促进健康衰老方面发挥重要作用。产生IL-10的T细胞具有TFH细胞的标志物,它在小鼠和人类中都有发现。IL-21对于维持这种平衡至关重要,因为缺乏IL-21的小鼠降低了IL-10(并失去了产生IL-10的TFH细胞)但增加了IL-6的表达,这表明细胞因子与炎症调控之间存在复杂的串扰。 显然,人们对开发抑制炎症的药物很感兴趣。线粒体信号GDF15由线粒体功能障碍和器官损伤诱导,并协调对炎症损伤的耐受性。在GDF15缺陷小鼠中,衰老伴随着严重的肥胖、肝损伤和肝脏脂肪沉积。尽管TH17细胞分化不需要GDF15,但GDF15有助于Treg介导的常规T细胞活化和炎性细胞因子的抑制。GDF15可以被二甲双胍诱导产生,这或许可以解释(部分)二甲双胍的抗糖尿病和抗衰老作用。二甲双胍可激活AMP激活的蛋白激酶信号通路从而用作糖尿病患者的长期治疗。最近,有报道称二甲双胍通过在体外和人体中增加T细胞的自噬和改善线粒体生物能量学来改善TH17炎症特征。作为替代策略,长期、低剂量的白藜芦醇逆转了老年小鼠的免疫衰老和炎症表型,因为它纠正了8-羟基-2'-脱氧鸟苷(一种氧化性DNA损伤的标志物)与年龄相关的升高。正在尝试结合不同的策略,包括抗炎药、衰老细胞裂解和免疫检查点抑制剂,以最佳阻断炎症。简而言之,炎症发生可部分归因于功能障碍或衰老的T细胞。改善炎症应该是未来几年的一个研究重点,以防止衰老相关的疾病的发生和免疫反应的下降。 总结 随着年龄的增长,免疫系统失去了对新的抗原性、感染性或肿瘤性刺激做出快速而准确的反应的能力,免疫系统形成记忆细胞以及刺激记忆细胞分化的能力也降低了;相反,衰老的免疫系统还会促进炎症反应和自身免疫反应的发生。衰老的T细胞处于促炎状态,持续发炎,从而加速人类衰弱和死亡相关的病理特征的出现,如心血管和代谢疾病、慢性肾病、非酒精性脂肪肝和神经退行性疾病。最近的证据也支持了T细胞适合性与阿尔茨海默病的预防以及心血管和新陈代谢疾病之间的相关性。了解T细胞衰老的十个标志之间的相互联系,将有助于开发新的临床策略,以提高老年人免疫力和预防慢性炎症带来的不良后果。 T细胞衰老的标志可分为三个不同的类别,基于它们的层次互连。四个主要标志(胸腺退化、线粒体功能障碍、遗传和表观遗传改变以及蛋白质稳态失衡)导致了最初的损伤。四个次要标志(TCR的减少、记忆库的扩大、效应细胞可塑性丧失和T细胞衰老)是主要标志的结果。最后,这两个综合特征(免疫缺陷和炎症发生)使与年龄相关的T细胞紊乱的后果具体化,从而将它们导向功能缺陷(图 3)。例如,胸腺退化是主要标志之一,有助于出现至少两个次要标志、TCR的缺失和记忆细胞以及幼稚T细胞的分化功能的下降,它也可能促进衰老T细胞的积累。其他主要标志——线粒体功能障碍、蛋白质稳态失衡和基因改变,在某种程度上是相互关联的,尽管没有明确的等级制度。因此,线粒体功能障碍可以促进自噬下降,反之亦然。次要标志是T细胞固有的,会影响它们的功能,即它们的克隆性/特异性(TCR库)、它们的时间序列分化水平(幼稚/记忆失衡)、它们的增殖能力和功能(免疫衰老),以及它们的活动偏差(可塑性丧失)等,这些不同的方面之间是相互关联的。例如,不同类别的幼稚/记忆、衰老和非衰老的T细胞亚群中的每一个都可能受到TCR库减少的不同影响。同样,SASP可能既是可塑性损失的原因,也是其后果。综合特征很可能参与前馈循环,突出主要和次要特征,从而推动衰老过程,将其锁定在一个长期前进的步伐中。因此,炎症可以加速胸腺退化并诱导次要标志(图 4)。因此,一个主要的挑战是了解T细胞衰老的每个标志的相对重要性并阐明它们的相互联系,最终目标是确定减弱或中断衰老过程的最佳分子靶标。事实上,一些导致T细胞衰老的过程是可药物化的(图 5)。然而,仍需确定哪种策略最有效以及如何将它们有利地结合起来。
从理论上讲,T细胞衰老可能涉及内源性免疫过程、淋巴器官的改变、宿主内在代谢或淋巴器官外的神经内分泌因子、感染风险的增加和肠道微生物群的变化——这意味着本质上很难区分与衰老相关的T细胞功能障碍的确切原因,它们是相互关联的。为了阐明这个问题,异体组织转移实验(即用年轻T细胞重建老年小鼠或反之),不同年龄小鼠之间淋巴器官移植,异体共生(即循环系统的连接)年轻和年老小鼠之间的系统,粪便微生物移植等多种实验应以系统的方式进行整合探索。同样,需要通过构建T细胞加速衰老体系的遗传策略,以及阻断或逆转T细胞衰老表型的策略,来更详细地研究T细胞对机体的影响。T细胞亚群的重新激活是否足以延缓整个机体衰老,或至少延缓衰老的部分表型,这个问题的答案将对免疫学的研究和实践产生巨大的影响。
|
【本文地址】
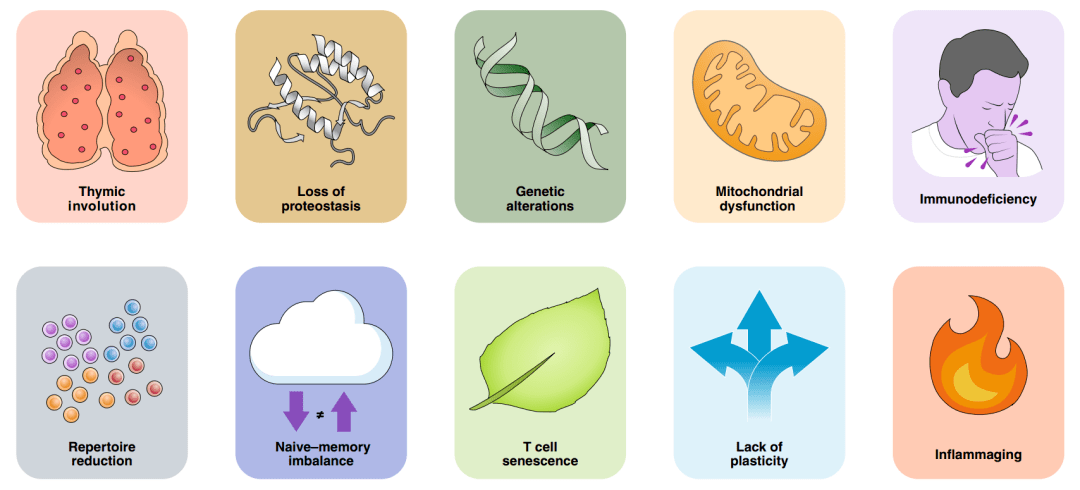 图1 T细胞衰老的标志。定义T细胞衰老的分子特征。
图1 T细胞衰老的标志。定义T细胞衰老的分子特征。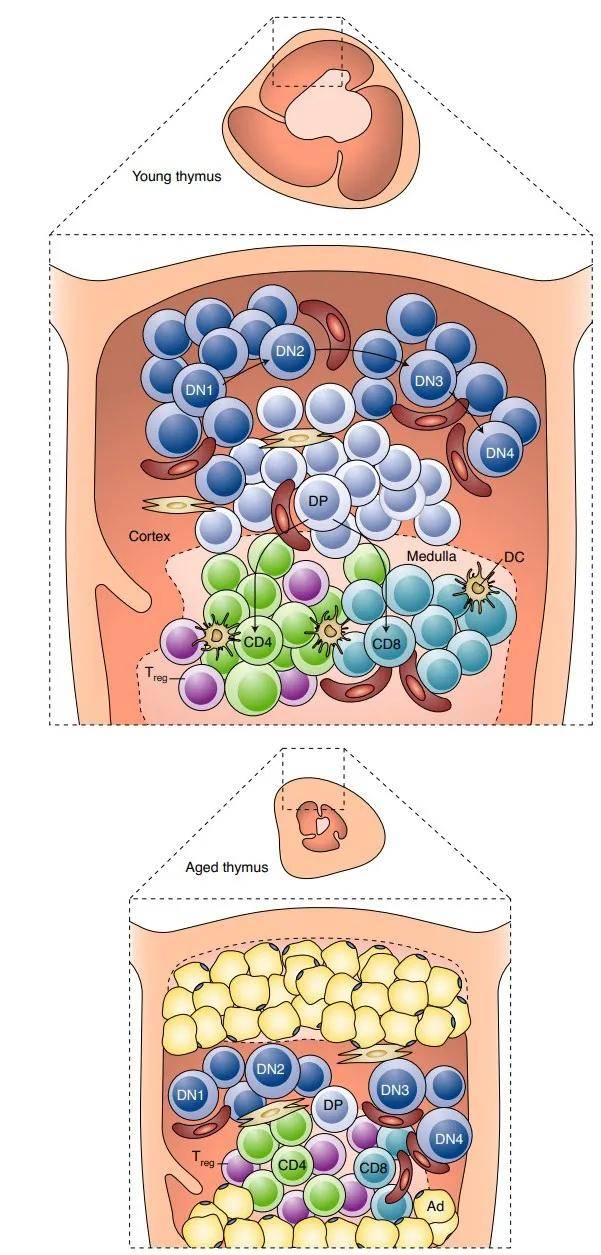
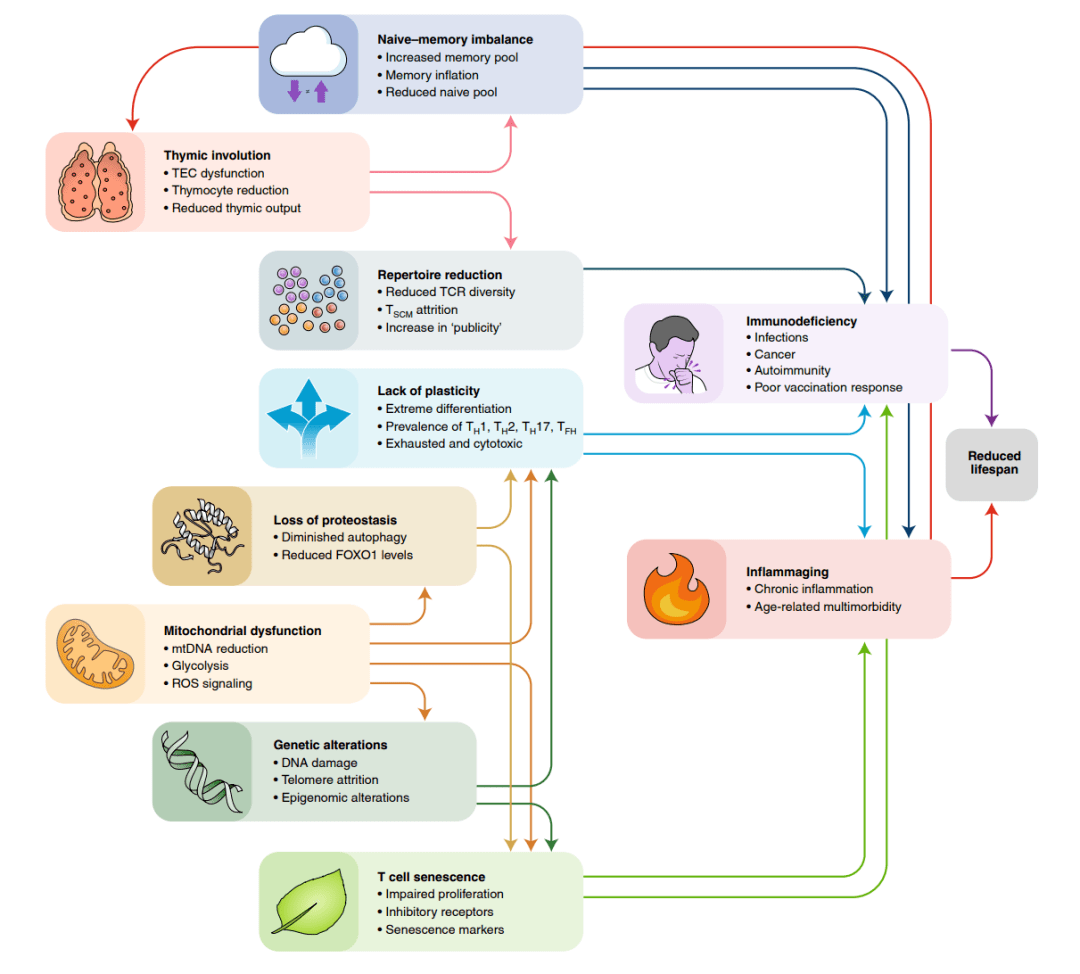 图3 T细胞衰老的特征及其效应。列出了每个标志的显著特征,最重要的相互关联用箭头表示。
图3 T细胞衰老的特征及其效应。列出了每个标志的显著特征,最重要的相互关联用箭头表示。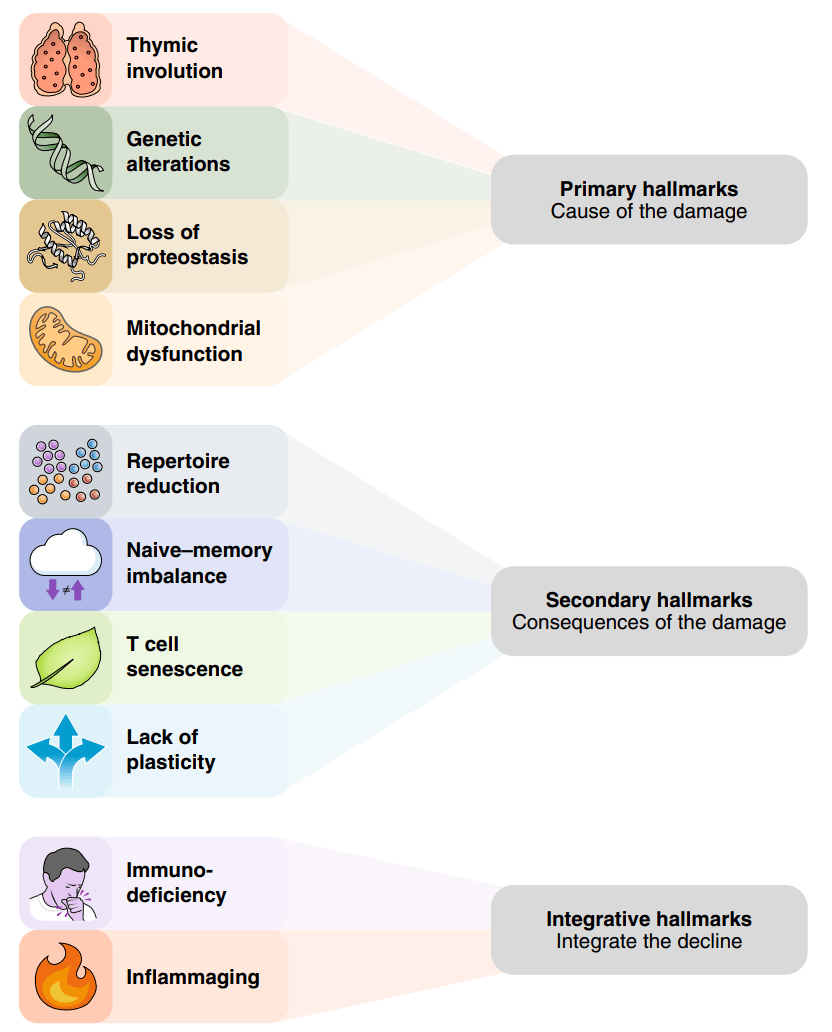 图4 特征的分类。T细胞衰老的特征根据它们在过程中的层次位置可以分为三个不同的类别。
图4 特征的分类。T细胞衰老的特征根据它们在过程中的层次位置可以分为三个不同的类别。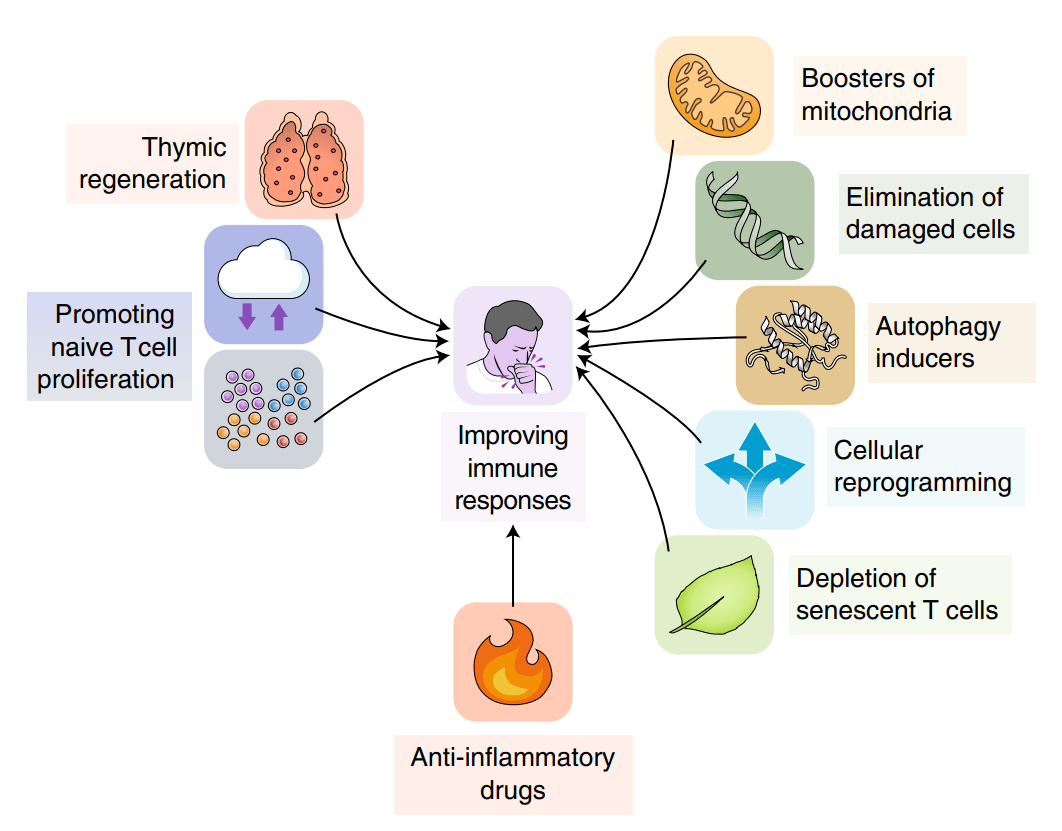 图5 可能会改善T细胞衰老的干预措施。可能延缓某些T细胞衰老指标的治疗方法。
图5 可能会改善T细胞衰老的干预措施。可能延缓某些T细胞衰老指标的治疗方法。 返回搜狐,查看更多
返回搜狐,查看更多