一文告诉您如何选择合适的解离酶制备高质量细胞悬液 |
您所在的位置:网站首页 › 组织液蛋白质含量低后果 › 一文告诉您如何选择合适的解离酶制备高质量细胞悬液 |
一文告诉您如何选择合适的解离酶制备高质量细胞悬液
|
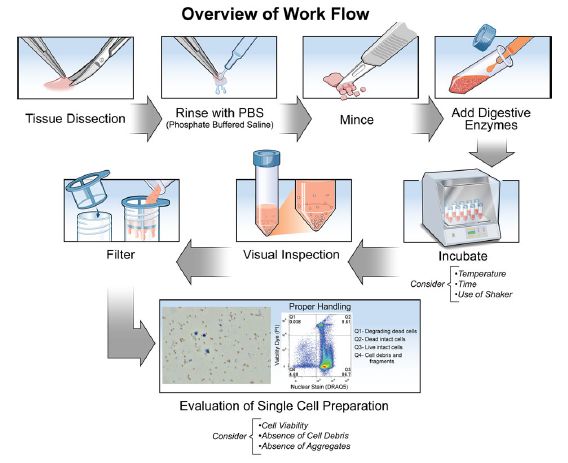
连接复合体 闭锁小带又称为“紧密连接”( tight junction),在相邻的单位膜有多个实际融合点,并散布着大约100-150Å的单位膜间隔短区域。连接为点状,斑状或带状,常见的为带状,位于细胞(如上皮细胞)的顶端,呈箍状围绕细胞。相邻细胞间的顶部细胞间隙被封闭,相邻细胞膜表面有呈网状的嵴,嵴与嵴相连处细胞膜紧贴而封闭细胞间隙,这种连接除有机械性的连接作用处,并封闭了细胞顶端的细胞间隙,可阻止大分子物质由外部进入细胞间隙,在胃肠道的上皮细胞顶部就广泛存在着这种连接。 粘着带又称为黏着连接 (adherens junctions) 、粘着带处相邻细胞质膜的间隙为20~30nm介于紧密连接和桥粒之间, 所以又叫中间连接(intermediate junction)或带状桥粒,此种连接多为长短不一的带状,将细胞粘着在一起,相邻邦细胞间有宽约 15-20 nm 的间隙,内充满密度较低的均质性物质。在细胞膜的胞质面,附着有薄层致密物质和微丝,粗约 5 nm ,一端附着于细胞膜的内层,另一端在细胞质内交织成网(终末网)。这种连接多见于上皮和心肌细胞。 粘着斑又称为“桥粒”( desmosome),由细胞外蛋白和糖蛋白基质组成,通常在其中可见电子致密条。细胞膜内侧有深暗的致密的较厚的板状结构,称为附着板(attachment plaqne)。胞质中有许多直径 10 nm袢状张力丝(tonofilament),附着其上,起一定的支持作用。桥粒的连接甚为牢固,多分布于易机械性刺激和磨擦较多的地方。某些上皮细胞的基底与深部结缔组织的相邻面,有半桥粒的结构,将上皮固着于基膜上。桥粒的完整性需要钙,并且它会被EDTA和无钙培养基分解。胶原酶,胰蛋白酶和透明质酸酶也可以使桥粒解离。 连接又称为“间隙连接”( gap junction),覆盖了大部分上皮细胞表面。细胞间隙为 2-3 nm ,相邻邦细胞膜间有间隔大致相等的连接点。连接点处细胞膜上有小管相通连,使相邻细胞相通,供细胞间交换离子,小分子物质等,此种连接处电阻低,易进行离子交换和传递电冲动,此种连接分布较广,上皮、肌细胞、骨细胞和神经细胞之间都有。 在上皮细胞覆盖结缔组织的基面,有一层细胞外结合层,又称为基板。基板由嵌在高分子量和低分子量糖蛋白的无定形基质中的胶原样网状纤维构成。 结缔组织 结缔组织由间充质细胞发育而来,形成皮肤的真皮、一些器官的被膜和间质、神经和肌肉细胞鞘、神经和肌肉束的鞘,粘液和浆膜,软骨,骨骼,肌腱,韧带和脂肪组织。 结缔组织由细胞和细胞外纤维组成,它们嵌在无定形的基质中,根据纤维的相对丰度,结缔组织可分为疏松结缔组织和致密结缔组织。这些细胞包括成纤维细胞、脂肪细胞、组织细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、中性粒细胞、巨噬细胞、肥大细胞和间充质细胞。 纤维有三种类型:胶原纤维、网状纤维和弹性纤维。细胞、纤维和基质在不同组织中的比例差异很大,在发育过程中也有明显的变化。胶原纤维在几乎所有结缔组织中都以不同的浓度存在。天然胶原蛋白是动物细胞外结缔组织、皮肤、肌腱、血管、骨骼等的主要纤维成分。网状纤维在疏松结缔组织中形成一个精细的分支网络。它们表现出一种规则的、重复的亚基结构,类似于胶原蛋白,可能是上述典型胶原纤维的一种形态变体。网状纤维在年轻动物的组织中更为普遍。弹性纤维不如胶原纤维丰富,它们与网状纤维相似,在结缔组织中形成分支网络。弹性纤维含有纵向排列的微纤维束,这些微纤维束嵌在一种叫做弹性蛋白的无定形物质中。和胶原蛋白一样,弹力蛋白含有高浓度的甘氨酸和脯氨酸,另外它还含有高含量的缬氨酸和两种不同寻常的氨基酸:桥丝氨酸和异桥丝氨酸。成纤维细胞和其他间充质细胞合成弹力素前体并将其释放到细胞外基质中,酶将赖氨酸残基转化为桥蛋白。弹性蛋白的聚合发生在后者的链间交联过程中。在这种状态下,弹性蛋白非常稳定,并且对大多数蛋白酶的水解攻击具有很强的抵抗力。 组织解离 想要获取单细胞悬液,首先需要破坏细胞外基质,将细胞从细胞外基质中释放出来,然后再破坏细胞与细胞之间连接,才能获得单细胞悬液。组织分解一般包括两个步骤:组织分离和酶消化。详细流程见下图:
酶消化 依照样本类型不同,需要配置不同的酶混合物,将切碎的组织块置于消化酶混合物中并在特定温度下孵育进行酶解离。不同的最佳酶活性一般具有温度特异性,因此在给定温度下能够以最高效率解离组织,通常酶解温度为37℃,也可以在4℃或冰上进行,这取决于所用酶的性质。一般较低的孵育温度会降低酶的反应速度从而延长酶解时间,但低温孵育可以减少细胞死亡。选择消化酶混合物用于制备用于单细胞悬液时,酶活强度、酶浓度以及孵育时间是最重要的三个考虑因素,三个因素间的变化可能导致细胞活性和细胞产量的波动。
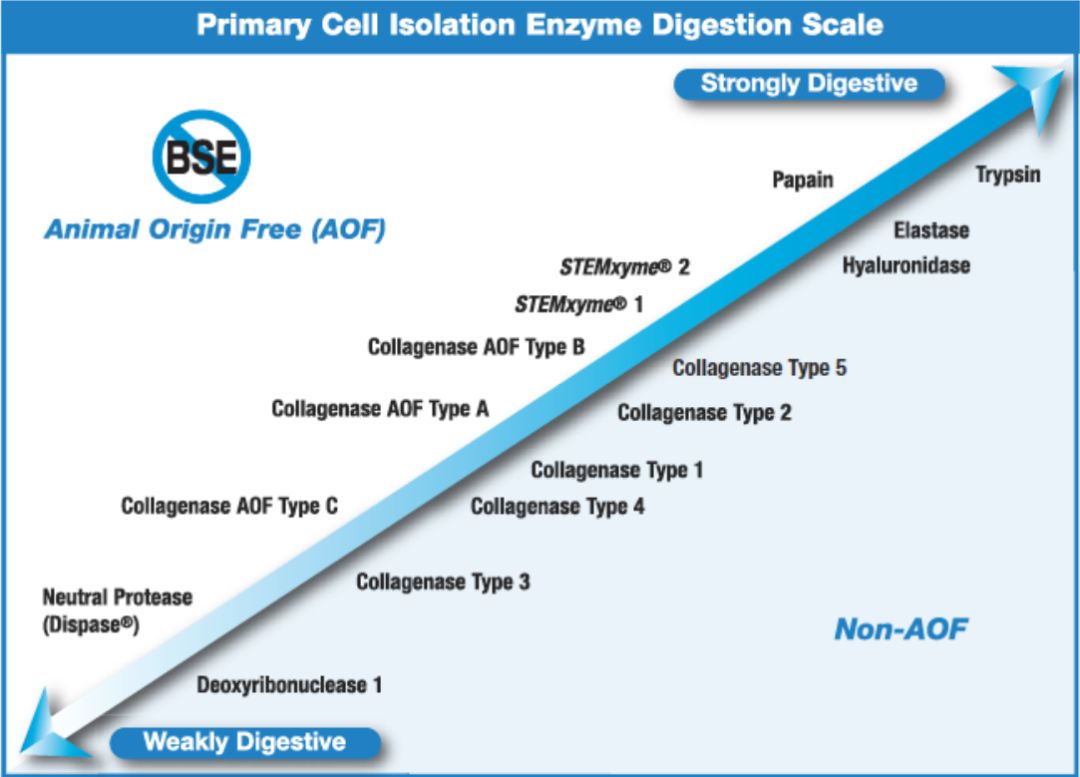
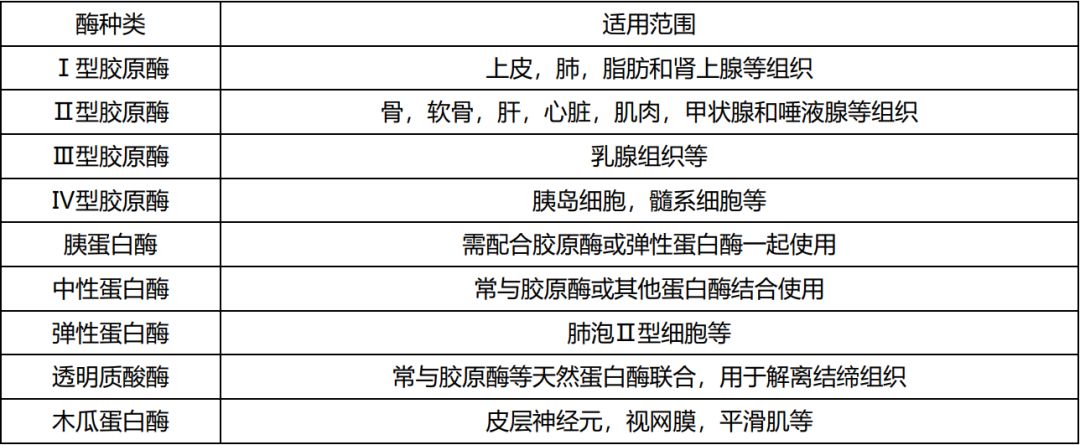
不同酶解离能力比较 解离酶的选择 组织中的细胞外基质与细胞之间的连接由一系列不同的蛋白质和其他生物分子组成,这些组织成分需要特定的酶消化,才能将组织制备成单细胞悬液。 分解细胞外基质的酶 胶原酶(Collagenase):胶原酶更准确地名称为梭菌肽酶A,在Pro(脯氨酸)-X-Gly(甘氨酸)-Pro序列中特异性破坏的X- Gly键(X通常是一种中性氨基酸)。这类序列常在胶原蛋白中发现,但在其他蛋白质中很少发现。虽然许多蛋白酶可以水解单链变性的胶原多肽,但胶原酶在众多蛋白酶中是独一无二的,它能够攻击和降解结缔组织中常见的三螺旋天然胶原纤维。胶原酶破坏胶原蛋白中存在的肽键,有助于消化细胞外基质,使细胞释放到悬浮液中。 中性蛋白酶(Dispase):中性蛋白酶是由多肉芽孢杆菌(Bacillus polymyxa)产生的一种细菌酶,水解非极性氨基酸残基的N端肽键,属于氨基内肽酶。中性蛋白酶只能破坏细胞外基质而不破坏细胞之间的连接,因此主要用于细胞集落的分离和将组织块分解成小块细胞,因为它保持细胞膜的完整性,其温和的蛋白水解作用使酶可以被特异性用于分离原代细胞和次级细胞(亚培养)。中性蛋白酶也常被用作与胶原酶和/或其他蛋白酶结合的次级酶,用于许多原代细胞的分离和组织解离。中性蛋白酶可以破坏细胞表面的分子或者抗原,例如与T细胞分析相关的抗原。因此,如果发现细胞某些表位蛋白的丢失,可以从消化液中将该酶去掉。 透明质酸酶(Hyaluronidase):透明质酸酶是一种具有2-乙酰氨基乙酰胺-2-脱氧-d -葡萄糖和d -葡萄糖醛酸盐之间存在的N -乙酰己糖氨基内键特异性的多糖酶。这些化学键在透明质酸和硫酸软骨素A和c中很常见。因为这些物质在几乎所有结缔组织的基质中浓度很高,所以透明质酸酶常被用来分解这些组织,通常与粗蛋白酶如胶原酶结合使用。 弹性蛋白酶(Elastase):弹性蛋白酶是一种丝氨酸蛋白酶,同时表现出酯酶和酰胺酶活性。尽管弹性蛋白酶可以水解多种蛋白底物,但其水解天然弹性蛋白的能力在蛋白酶中是独一无二的,天然弹性蛋白是一种不受胰蛋白酶、胰凝乳蛋白酶或胃蛋白酶攻击的底物。由于弹性蛋白在结缔组织的弹性纤维中含量最高,所以弹性酶常被用来分离含有大量细胞间纤维网络的组织。为此,它通常与其它酶如胶原酶、胰蛋白酶和糜蛋白酶一起使用。 破坏细胞连接的酶 胰蛋白酶(Trypsin):胰蛋白酶是一种胰脏丝氨酸蛋白酶,是已知的最高度特异性的蛋白酶之一,尽管它也表现出一定的酯酶和酰胺酶活性。单独纯化的胰蛋白酶对细胞外蛋白的选择性较低,通常对组织的解离效果不佳。纯化的胰蛋白酶和其它酶如弹性蛋白酶和/或胶原酶的组合已被证明对解离有效。胰酶能够降解细胞连接中存在的某些蛋白,但是胰酶对细胞膜上蛋白有很强的破坏作用,容易造成DNA的泄漏,游离DNA很有容易诱导细胞成聚体。 木瓜蛋白酶(papain):木瓜蛋白酶是一种来自木瓜胶乳的巯基蛋白酶。木瓜蛋白酶具有广泛的特异性,对大多数蛋白质底物的降解作用比胰腺蛋白酶更广泛,它还表现出酯酶活性。使用木瓜蛋白酶常用于神经组织等分离。木瓜蛋白酶与胰酶类似也能够使细胞溶解并释放游离DNA。 分解细胞外基质的酶 胶原酶(Collagenase):胶原酶更准确地名称为梭菌肽酶A,在Pro(脯氨酸)-X-Gly(甘氨酸)-Pro序列中特异性破坏的X- Gly键(X通常是一种中性氨基酸)。这类序列常在胶原蛋白中发现,但在其他蛋白质中很少发现。虽然许多蛋白酶可以水解单链变性的胶原多肽,但胶原酶在众多蛋白酶中是独一无二的,它能够攻击和降解结缔组织中常见的三螺旋天然胶原纤维。胶原酶破坏胶原蛋白中存在的肽键,有助于消化细胞外基质,使细胞释放到悬浮液中。 中性蛋白酶(Dispase):中性蛋白酶是由多肉芽孢杆菌(Bacillus polymyxa)产生的一种细菌酶,水解非极性氨基酸残基的N端肽键,属于氨基内肽酶。中性蛋白酶只能破坏细胞外基质而不破坏细胞之间的连接,因此主要用于细胞集落的分离和将组织块分解成小块细胞,因为它保持细胞膜的完整性,其温和的蛋白水解作用使酶可以被特异性用于分离原代细胞和次级细胞(亚培养)。中性蛋白酶也常被用作与胶原酶和/或其他蛋白酶结合的次级酶,用于许多原代细胞的分离和组织解离。中性蛋白酶可以破坏细胞表面的分子或者抗原,例如与T细胞分析相关的抗原。因此,如果发现细胞某些表位蛋白的丢失,可以从消化液中将该酶去掉。 透明质酸酶(Hyaluronidase):透明质酸酶是一种具有2-乙酰氨基乙酰胺-2-脱氧-d -葡萄糖和d -葡萄糖醛酸盐之间存在的N -乙酰己糖氨基内键特异性的多糖酶。这些化学键在透明质酸和硫酸软骨素A和c中很常见。因为这些物质在几乎所有结缔组织的基质中浓度很高,所以透明质酸酶常被用来分解这些组织,通常与粗蛋白酶如胶原酶结合使用。 弹性蛋白酶(Elastase):弹性蛋白酶是一种丝氨酸蛋白酶,同时表现出酯酶和酰胺酶活性。尽管弹性蛋白酶可以水解多种蛋白底物,但其水解天然弹性蛋白的能力在蛋白酶中是独一无二的,天然弹性蛋白是一种不受胰蛋白酶、胰凝乳蛋白酶或胃蛋白酶攻击的底物。由于弹性蛋白在结缔组织的弹性纤维中含量最高,所以弹性酶常被用来分离含有大量细胞间纤维网络的组织。为此,它通常与其它酶如胶原酶、胰蛋白酶和糜蛋白酶一起使用。 破坏细胞连接的酶 胰蛋白酶(Trypsin):胰蛋白酶是一种胰脏丝氨酸蛋白酶,是已知的最高度特异性的蛋白酶之一,尽管它也表现出一定的酯酶和酰胺酶活性。单独纯化的胰蛋白酶对细胞外蛋白的选择性较低,通常对组织的解离效果不佳。纯化的胰蛋白酶和其它酶如弹性蛋白酶和/或胶原酶的组合已被证明对解离有效。胰酶能够降解细胞连接中存在的某些蛋白,但是胰酶对细胞膜上蛋白有很强的破坏作用,容易造成DNA的泄漏,游离DNA很有容易诱导细胞成聚体。 木瓜蛋白酶(papain):木瓜蛋白酶是一种来自木瓜胶乳的巯基蛋白酶。木瓜蛋白酶具有广泛的特异性,对大多数蛋白质底物的降解作用比胰腺蛋白酶更广泛,它还表现出酯酶活性。使用木瓜蛋白酶常用于神经组织等分离。木瓜蛋白酶与胰酶类似也能够使细胞溶解并释放游离DNA。 DNA消化酶 细胞悬液中游离DNA的存在DNA存在会降低蛋白酶活性,同时游离DNA作为粘合剂会促使细胞聚团,因此需要使用DNA消化酶消化游离DNA。DNA消化酶主要有两种类型:DNase-I和DNase-II。DNase-II在降解DNA的同时,也会造成细胞凋亡,因此不适合制备单细胞悬液。DNase-I适用于组织消化和制备单细胞悬浮液,它可以通过降解死细胞裂解释放的游离DNA阻止细胞聚集,同时不会启动凋亡途径。 不同解离酶的使用范围
|
【本文地址】
今日新闻 |
推荐新闻 |
 返回搜狐,查看更多
返回搜狐,查看更多