药物研发流程 一款新药从研发到上市都需要经过哪些流程?这里以化学药为例,试着做了一个梳理。一款新药从研发到上市需经过五个阶段:化合物研... |
您所在的位置:网站首页 › 简述药物研究开发的意义 › 药物研发流程 一款新药从研发到上市都需要经过哪些流程?这里以化学药为例,试着做了一个梳理。一款新药从研发到上市需经过五个阶段:化合物研... |
药物研发流程 一款新药从研发到上市都需要经过哪些流程?这里以化学药为例,试着做了一个梳理。一款新药从研发到上市需经过五个阶段:化合物研...
|
来源:雪球App,作者: 夹头之路J,(https://xueqiu.com/3369210683/216344125) 一款新药从研发到上市都需要经过哪些流程?这里以化学药为例,试着做了一个梳理。 一款新药从研发到上市需经过五个阶段:化合物研究开发→临床前试验→IND 申报→临床Ⅰ、Ⅱ、Ⅲ 期试验→注册上市,药品获得批准后才能上市销售。 另外药品完成临床前研究后,申请临床试验获得受理,经过国家药监总局审评审批后可获得临床试验批件;企业按照临床试验批件要求组织完成-I期临床试验,并完成生产车间建设后可申报生产批件,经药监总局审评审批获得生产批件并生产车间通过GMP认证后可投入生产。其中生物药中的疫苗类产品最后需要经中检院批签发合格后可上市销售。
1、研究开发(2~3 年) 此阶段在实验室中进行,目的是寻找治疗特定疾病的具有潜力的新化合物(药物的初始状态)。 1)药物靶点的发现及确认 药物靶点可以是患者体内与疾病有关的蛋白质,可以是肿瘤细胞的蛋白分子,也可以是某个基因片段。只有确认了疾病的靶点,才能发现对应的治疗药物,后续所有的工作才有展开的依据,这是所有工作的起点。这里的挑战在于鉴别出哪些靶点与疾病有关,确定靶点的位置,确证靶点在疾病中的作用等。 2)先导化合物的筛选与合成 化合物为由二种或二种以上不同元素所组成的纯净物,在日常生活里,氯化钠(化学式:NaCl)及蒸馏水(化学式:H2O),均为常见的化合物。先导:开始,引路,先河。 先导化合物:即最开始的化合物(药物的初始状态)。是根据靶点的空间结构,从虚拟化合物库中筛选一系列可匹配的分子结构,合成而来的。如同根据靶点制作了一个筛网,只有满足相关标准的化合物才能晋级下一步。
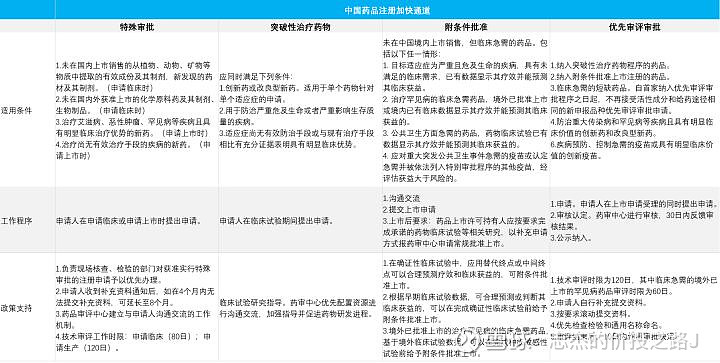
3)活性化合物的验证与优化 在经过不断的筛选后,科学家们可以获得一些具有药效的化合物,但是他们的活性低,毒性强。经过不断的验证和优化,得到一些活性高、毒性低的化合物,这些化合物称为药物候选物。 2、临床前实验(2~4 年) 1)药物效应动力学、药物毒理学、药物代谢动力学研究 用药物候选物在动物(一般是小白鼠)身上进行试验,目的是确定这些药物候选物的有效性,安全性,药物的吸收、分布、代谢和排泄情况。 2)制剂开发 进行生产工艺、杂质研究、质量研究、稳定性研究等研究(CMC:Chemical manufacturing control)。目的是全面了解化合物的性质,初步确定剂型、处方、规格,制备充足的原料和制剂以共临床试验的研究,提供试验药物的临床前研究资料。 二、IND 申报IND(Investigational New Drug)是指新药临床研究申报。简言之,就是向 NMPA 申报要进行临床试验,需要提供一系列临床前试验的资料,NMPA 会对 IND 的安全性和有效性进行审查,通过了就可以进行下一步的临床试验。 在中国上市的药物向 NMPA 申报,等待时间为 60 天。在美国上市的药物向 FDA 申报,等待时间为30天。过了时间后没收到通知就是默认批准。 除此之外,因为美国在创新药方面的科研水平及经验相对丰富,若 FDA 通过了新药 IND 审批,则对于企业在中国的 IND 及与 CDE 等监管机构的沟通有非常大的帮助,很大机率会加速IND审批。 三、临床试验(3~7 年)临床试验是在人身上做实验,共分三期: 1、Ⅰ期临床试验 试验对象为正常人,样本一般为 20~100 例。由于是首次在人体上进行药物实验,因此主要目的有两个,一是对药物的安全性和及在人体的耐受性进行研究,考察药物副反应与药物剂量递增之间的关系,二是考察药物的人体药物动力学性质,即药物在人体内的吸收、分布、代谢和排泄情况。 2、Ⅱ 期临床试验 试验对象为目标适应症患者,样本一般为 60~300 例。目的是初步评价药物的疗效和安全性,为 Ⅲ 期临床试验研究设计和给药剂量方案的确定提供依据。 3、Ⅲ 期临床试验 试验对象也为目标适应症患者,样本一般为 300~2000 例。目的是进一步验证药物的疗效和安全性,最终为药物注册申请的审查提供充分的依据。本期试验的样本量要远大于比前两期试验,更多样本量有助于获取更丰富的药物安全性和疗效方面的资料,对药物的益处和风险进行评估,为产品获批上市提供支撑。 传统意义上,新药的临床研究分为Ⅰ、Ⅱ、Ⅲ 期,后来 Ⅱ 期又分成 Ⅱa 和 Ⅱb(很大程度上是因为肿瘤药物研究),接着出现了 0 期临床的概念。这些期数再细分本质上是为了用更小的代价和更快的速度判断药物是否安全可行。 例如 0 期临床是使用微剂量药物在少量健康受试者或者病人进行试验,样本一般不超过20 个。与Ⅰ期临床试验相比,由于其开展研究的剂量很低,受试者数量少,给药时间短,可以尽早剔除无开发前景的化合物,以节省成本、时间和资源。 另外国外进口或者国内出口的药物想在当地上市,需要再做临床试验。至少要做 Ⅲ 期验证性临床试验,目的是确定用法和用量没有人群的种族差异。如果出现因种族差异影响药物效果等情况,可能还需要做Ⅰ期,看看在不容种族间的药代情况。但有些紧急批复药物是可以不用做临床试验,例如罕见病和重大灾情应急药物,审查后可以直接批准。 四、注册上市(0.5~2 年)1、NDA 或 BLA 在临床试验结束后,向 FDA 提交 NDA 或 BLA,申请批准上市。如果批准的话,新药就算是研发完成,可以商业化销售。 NDA(New Drug Application)是指向 NMPA 申报化学药和中药的注册申请;而 BLA(Biologic License Application) 是指向 NMPA 申报生物药的许可申请。所有的药物上市前需要递交一系列临床试验材料供新药评审。 2、ANDA ANDA(Abbreviated New Drug Application)指仿制药 NDA 注册申请。 仿制药是对创新药的复制,仿制药也要进行 NDA 申报,但仿制药不需要进行临床试验,因为所仿制的原研药生产商已经做了动物和人体的相关实验并证明了药物的安全性和有效性,所以仿制药的 NDA 要简单地多。 但仿制药需要进行仿制药一致性评价,目的是为了保证在疗效上与原研药一致,疗效一致的前提是包括主要成分、剂型、规格、给药途径、质量和适应症等方面都要一致。 在一致性评价过程中,BE(BE,Bioequivalence)试验是用来证明仿制药与原研药疗效一致的关键。BE 试验是指仿制药与原研药相同的剂量,在相似的条件下进入人体后,其活性药用成分到达作用位点的速度和程度是相当的。通常证明生物等效的一个常见的方法是测定仿制药到达健康人体(24-36 名)血液所需的时间和血液浓度,如果仿制药能够在同样的时间内将同样量的活性成分传输到人体的血液中,则视为二者等效。 3、IND 和 NDA 的区别 IND 申请就是向当局申请要进行药物的临床试验;NDA 和 BLA 申请是向当局申报药品注册上市,前者为化学药和中药,后者为生物药;而 ANDA 申报则是指仿制药注册上市的申报。在实务当中,经常用到相关的缩写,比如 IND 药物,即临床试验阶段的药物;NDA 数量,即正在申请上市的药物数量。另外 NDA 相比 IND 的申请更为耗时。 4、注册加快通道 这里需要提一下中国和美国的四条药品注册加快通道 ,如果被批准进入这几项通道,说明这款新药有一定的价值,有关部门会给予一定的政策支持,加快此药品的审评速度。例如 FDA 对新药申请(NDA/BLA)的目标批准日期,通常为自收到申报日起 10 个月,获得优先评审的可以缩短至 6 个月。
Ⅳ 期临床为上市后开放试验,也称上市后监察,样本为 2000 例以上。目的是考察药品在广泛使用条件下的疗效和不良反应,其目的是评价在普通或者特殊人群中使用的利益与风险关系以及改进给药剂量等。 过了 Ⅳ 期临床后药品才可以大批量生产,然后上架销售。从上市到药品上架,患者大概需要 3~5 个月才能买到。 六、上市后再审批(上市后4~10年)目的是重新审核 NDA 中的有效性和安全性,因为药物上市后仍有风险。 例如当年葛兰素史克公司旗下治疗糖尿病的明星药物——文迪雅,上市后出现服用者心脏病发作及猝死人数大幅增加,不得不撤市。 例如美国默克公司生产的治疗关节炎和急性疼痛的王牌药物——万络(VIOXX),自 1999 年上市以来,该药在全球超过 80 个国家销售,至2003年底,全球已开出超过 8400 万张处方,2003 年全球销售额达 25 亿美元。后来被证实大剂量服用万络者患心肌梗塞和心脏猝死的危险增加了3倍。致使默克制药公司主动回收万络,公司陷入了药品安全危机。 总结:新药研发是一项高风险、高投资、周期长的工程,一款新药平均研发周期大约 12 年,平均开发成本达到 26 亿美元,其中 60%~70% 投入在临床研究阶段,另外临床试验的失败率也是最高的。一款新药从最开始的研究开发走到注册上市的数量寥寥无几,成功率不足 10%(肿瘤抗癌药成功率更低),而且上市后还有诸多风险。 |
【本文地址】
今日新闻 |
推荐新闻 |