如何写任何元素原子的电子构型式 |
您所在的位置:网站首页 › 电子层klmn层 › 如何写任何元素原子的电子构型式 |
如何写任何元素原子的电子构型式
|
6 根据电子数,填入轨道中。比如想要写零电荷钙原子的原子构型,要找出元素周期表其原子序数,我们得到20,然后就把20个电子依次安排到各个轨道上。 根据上述顺序,把20个电子都填入。1s轨道有俩电子,2s有俩,2p有六个,3s也有俩,然后3p有6个,4s又有两个电子 2 (2 + 2 + 6 +2 +6 + 2 = 20)。因此钙原子的电子构型式: 1s2 2s2 2p6 3s2 3p6 4s2 注意:原子轨道越后,轨道能量越高。到了第四层,会变成 4s 先,3d后,第四层以后到第五层这个规律又出现了。这种规律只有在第三层以后才出现。 7 通过元素周期表走捷径。你可能已经了解到,元素周期表的形状是根据电子轨道系列编排的。比如左起第二列都以“s2”结尾,最右边的总是“d10”,等等。用周期表帮你写电子构型式,即通过元素在周期表中的位置,来相应地把电子加入某个轨道中。按下面来做: 最左侧的两列,构型结尾都是“s轨道”,周期表右侧都以p结尾,中间区域的元素以d结尾,下面区域的元素以f结尾。 比如要写氯元素的电子构型式,就想想:此元素在第三行(第三周期)位置,也在第五列,即周期表中p结尾的区域,因此其电子构型结尾是3p5。 注意:d、f轨道对应的能量等级和元素周期不一致。比如d区第一行,虽然是第四周期,但也以3d轨道结尾。而第六周期(f区第一行)能量对应到4f轨道。 8 学习电子构型式的速记法。最右边的一列,表示惰性气体。这些元素极其稳定。要简化长段的电子构型表达,只要先写出最近的之前的惰性气体元素的元素符号,然后就写出剩余的轨道系类。如: 我们写个例子来解释。比如写锌元素(30号),用惰性气体简写法,锌的完全电子构型式是: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 。不过注意1s2 2s2 2p6 3s2 3p6就是惰性气体氩元素的表达式,将氩放在锌的电子构型前,写中括号中。 ([Ar]) 因此可以简化锌元素的电子构型为: [Ar]4s2 3d10 方法 2 用ADOMAH 周期表写
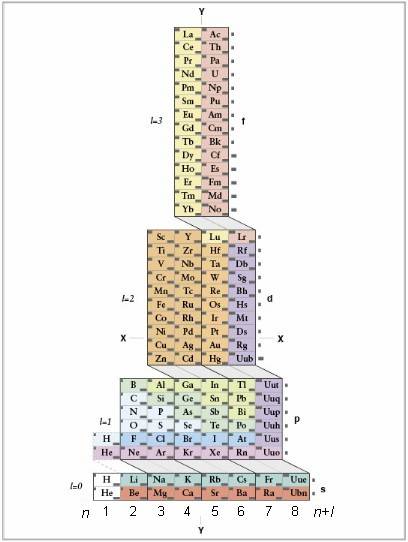
1 理解ADOMAH的意思。不需要记忆电子构型的写法了,不过这里需要用一个元素周期表的变形。因为传统元素周期表从第四行开始,周期数和电子层不对应了。你可以找找ADOMAH周期表,这个周期表是Valery Tsimmerman发明的,网上很容易可以找到。 ADOMAH周期表中,水平行代表元素组,比如卤素、惰性气体、碱金属、碱土金属等等。竖列对应各个电子层,也叫“串”(连接s、p、d、f区的斜线)和各周期对应。 氦在氢旁,两者都只有1s轨道。周期区域(s、p、d、f)在右边显示,电子层数在底部显示。元素列在长方形中,由1到120依次排列。这个原子序数和零电荷的元素所带电子数相等。 2 找出ADOMAH表中的元素原子。找出以后就把之后的元素都剔除掉。比如要找铒元素(68),就把69-120的元素都删掉。 注意底部数字1-8。这些表示电子层数,也是列数。把全部都是剔除的元素的一列忽略掉,比如铒元素,我们只看1、2、3、4、5和6列。 3 数轨道系列数。看看右边的字母(s、p、d、f),还有底部的列数,忽略掉不必要的列数以后,写下列数+字母的形式,如:1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (铒)。 注意:上述铒的电子构型,可以按电子层增加的顺序写轨道式,也可以根据能级关系来写。只要按照从上到下的“串”来写,而不是按照一列列来写: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12 4 计算每个轨道系列的电子数。数每个区的列中剩余的元素,每个元素代表一个电子,比如 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2 。本例子中这个就是铒元素的电子构型了。 5 了解不规则电子构型。有十八个常见基态元素原子的例外,这些例外元素有两三个电子排列和原规则不符。这些例子中,电子会待在相对能级更低的状态中,而不是按普通规律来排放电子。以下是这些例外: Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) 以及 Cm (..., 5f7, 6d1, 7s2)。 小提示 要根据某个原子的电子构型得出其原子序数,只要把字母(s、p、d、f)后的数字都加起来就行。不过这只适用于零电荷的原子,如果是离子就不行了,要根据电荷加减电子数。 字母后的数字实际上是上标,所以考试别写错了。 没有所谓的“半满轨道稳定态”的次能级,这样解释只是过分简化了电子排布规律。电子之所以在半满状态能稳定,是因为每个轨道正好只有单一电子,使得电子和电子之间的斥力达到最小程度。 所有元素都趋向稳定状态。最稳定的就是含有s、p两个满轨道的原子(s2和p6)。即惰性气体的电子分布。这也是为什么惰性气体很难反应,且出现在周期表最右边。如果一个电子构型尾部是3p4,则只需要两个电子就可以达到平衡(要失去包含3s轨道的总共6个电子需要更多能量,因此失去六个电子更难)。如果结尾是 4d3,则只需要失去3个电子达到稳定。同样半满轨道(s1、p3、d5)比像p4、p2这样的更稳定。不过s2和p6要更稳定得多。 如果原子是离子形式,则表示质子数和电子数不相等。电荷会在元素符号右上角写出来。如果锑元素(Sb)电荷为+2 ,则电子构型为:1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1 5p3 5p1 4s0 3d7 3d7 。注意这里的5p3 变成5p1。处理结尾不是s、p的电子构型的时候要小心,拿走电子的时候只能拿走价壳层轨域(s、p)的电子。因此如果一个电子构型是4s2 3d7,原子含有+2电荷,则要变为4s03d7,这里的3d7不变,拿走的是4s层的电子。 有些情况电子需要“迁移”。如果轨道系列只差一个电子就可以造成半满或全满状态,则要从最近的s、p轨道拿走一个电子,放在这个轨道上。 电子构型有两种写法。可以依能级次序写出所有的电子层,也可以简化之前的电子层,如上述铒的例子。 也可以只写出价电子的形式,即最后的s、p层电子。因此 锑 的价电子形式是:5s25p3 铁原子是个例外。铁原子情况比较复杂。前两层后面的情况要根据电子数目而定。.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |