细菌生物膜抑制伤口愈合机制详述 |
您所在的位置:网站首页 › 生物膜可以长期使用吗 › 细菌生物膜抑制伤口愈合机制详述 |
细菌生物膜抑制伤口愈合机制详述
|
这些发现导致了一些列有趣的问题。为什么生物膜会出现在慢性伤口?是否是慢性伤口的环境促进了生物膜的形成,还是生物膜的出现使得伤口变成了慢性伤口?目前针对与生物膜相关的慢性伤口的治疗方法有哪些?生物膜有哪些特点和特性使其能躲过各种治疗方法?对于慢性伤口的治疗,还有哪些方法可以尝试? 生物膜的一般背景
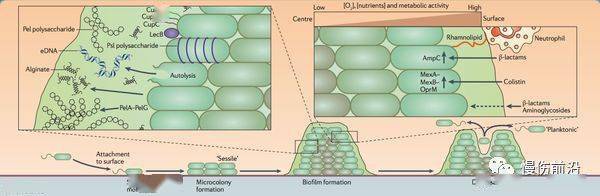
Figure 2. 绿脓杆菌生物膜生命周期。来源: Hauser et al. 2011. Nature Reviews Microbiology 9(3): 145. 自然界中大部分细菌都可以集聚形成三维、多细胞的社群,紧紧附着在基底层或物质表面,这些微生物社群即为生物膜。当自由游动、浮游细菌发现富有营养物质的适合环境时,它们就会形成生物膜固着在该环境中。 生物膜的生命周期包含4个阶段( Figure 2)。首先细菌细胞附着在表面、形成很多微菌落,然后向周围分泌多聚糖或糖蛋白,以便更多的细菌可以吸附。随着越来越多的细菌集聚在一起,化学信号的浓度达到了某种阈值,刺激菌落细胞发生基因变化,使得细菌细胞更牢固地附着在表面和与周围细菌更紧密的结合。菌落产生很厚的细胞外基质,由胞外多聚糖(EPS)、蛋白质、细胞外DNA(eDNA)和其他聚合物构成,在细菌周围形成了保护性的物理屏障,终使长成成熟的生物膜,在这种复杂的细菌社群中,个体间可以通过化学信号进行沟通,即群体效应(Quorum sensing, QS)。QS系统能够让细菌通过分泌和接受化学信号来感受其他细菌的存在。一旦生物膜达到了一定的细胞密度水平,即饱和度,生物膜即会关闭表达EPS的基因,重新激活鞭毛运动基因,得以向周围环境播散浮游细菌,去寻找新的适宜环境【8】。以绿脓杆菌为例,其生产的EPS包含藻酸盐、Pel和Psl【9】。当生物膜菌落的营养物质或氧气消耗殆尽时,绿脓杆菌就会分泌藻酸盐裂解酶,以溶解周围的EPS,为细菌播散做好准备。
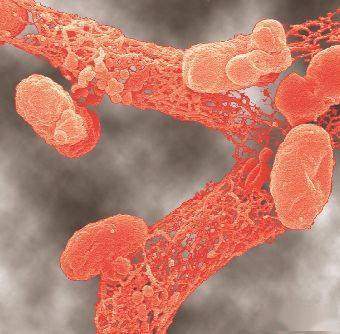
Figure 3. 葡萄球菌(左)、大肠杆菌(中)在尿管上形成的生物膜的扫描电镜下图像。生物膜形成复杂的晶体状结构(右)。来源: Kumar et al. 2013. JAPI 61. 切记虽然一些生物膜可能主要由单一种类微生物构成,大部分生物膜含有多种微生物。生物膜的多样性越高,这种多重微生物社群更能发展出有益的协同关系以获得更大的存活机会。 为什么生物膜经常发生在慢性伤口,而少见于急性伤口呢?是慢性伤口的环境促进了生物膜的形成,或是生物膜的存在造成了伤口的“慢性化”?研究显示答案是两者兼有。慢性伤口的环境非常适合机会致病菌形成生物膜,而生物膜的固有特性能造成伤口愈合停滞在炎症期,使得感染迁延不愈。 生物膜延迟伤口愈合的机制 生物膜的三个主要特性造成了伤口感染的慢性化。首先,生物膜的 微生物多样性使得发现适合的和最有效的治疗方法变得颇具挑战,因为在生物膜和周围耐药菌群的保护下,平时非致病的微生物也获得了抗生素耐药性。其次,生物膜细胞外EPS基质的结构和构成作为屏障阻止免疫细胞和抗生素的侵犯,同时通过群体感应中的化学信号沟通和DNA分享机制促进对清创(机械清除)和抗生素抵抗力的快速形成。最后,生物膜长久和持续存在造成了免疫系统的过度刺激,而后者则为细菌提供了进一步生长的养分。 #1 多重微生物生物膜中的致病协同
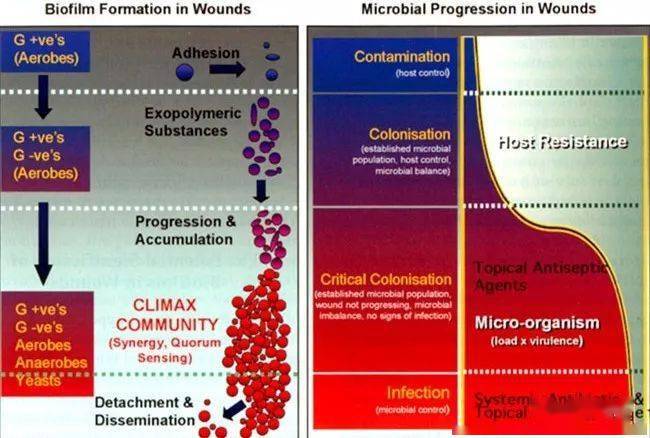
Figure 4. 伤口中微生物感染进展过程和生物膜形成过程具有一致性。来源: Wounds, 2004, Health Management Publications, Inc. 生物膜微生物多样性的构成似乎要经历一个随时间发展的模式,而这一发展模式与生物膜的形成过程相匹配(Figure 4)【13】。在伤口污染的最初阶段,在伤口变成慢性之前,正常皮肤菌群占主导,大部分为需氧的革兰氏阳性细菌。此时,生物膜不具有致病性,而被激活的宿主免疫系统可以使伤口在数周内愈合。然而,兼性厌氧革兰氏阴性菌开始侵入伤口,利用需氧菌消耗氧气而为其在伤口床创造的生存空间。在微生物和宿主免疫细胞间的平衡被打破,伤口到达“严重定植”状态。随着伤口进一步恶化,影响深层组织如肌肉和骨骼,更多的厌氧菌得以在低氧的伤口环境中生存。
生物膜的微生物多样性越大,基因库就越大,细菌间会有更多机会建立互惠互利的互助关系。 #2 EPS基质:抗生素屏障 形成生物膜后的细菌的抗生素耐药性比浮游细菌高500至5000倍,包括那些在正常情况下对抗生素敏感的菌种【7】。生物膜的形成如何使耐药性的提高成为可能?可能的机制有几种。 首先,生物膜中的细菌由于对生物膜环境中的营养物质和空间进行竞争而生长增殖放缓和代谢率下降;其次,EPS基质中的蛋白质和多糖成分能够妨碍和延缓抗生素穿透生物膜,从而给予位于基质深部的成熟细胞更多的时间发展耐药性;第三,一些细菌本身具有耐药性和产生抗生素耐药因子,从而增强整个生物膜社群的耐药性;这被称为被动耐药。 #3 横向基因转移诱导的抗生素耐药
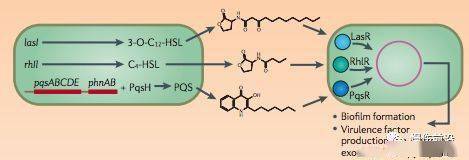
细菌间可以通过横向基因转移来分享抗生素耐药基因,这是不同菌株间交换基因的一种机制。生物膜中最常见的横向基因转移方式是转化和接合。 #4 群体感应:抵抗宿主免疫防御 或许一个最重要但最不为了解的生物膜细菌耐药机制是化学信号通讯(Chemical signaling)和群体感应(Quorum Sensing, QS)。QS调节生物膜发展和毒性因子的生产,增加对宿主免疫防御的抵抗力,允许狭小空间里容纳高密度细胞的生物膜基质结构能增强其效率。 研究发现QS是伤口“慢性化”的关键决定因素。 绿脓杆菌有三个QS系统,以一种复杂、分层的方式结合在一起,其中有三个关键的QS信号分子,即3-oxo-C12-homoserine lactone, C4-homoserine lactone, 和假单胞杆菌喹诺酮类信号(PQS),分别由Lasl, Rhl和Pqs系统控制(Figure 7)【22】。
Figure 7. 绿脓杆菌利用三种群体感应系统的复杂配合来调控生物膜基质和一些毒性因子的生产。来源: Hauser et al. 2011. Nature Reviews Microbiology 9(3): 145. 细菌生物膜的QS系统不仅仅能造成宿主免疫细胞的溶解。宿主自身的防御系统在伤口愈合的炎症期可以延迟愈合过程。在正常或急性伤口的愈合过程中,伤口中MMPs和TIMPs的水平处于平衡状态;但在慢性伤口中,平衡被破坏。慢性伤口感染使得MMPs的表达水平增高,而TIMPs的水平下降,进而减少了伤口修复所需要的生长因子的水平【26】。 结论 目前治疗生物膜相关慢性伤口的方法有很多,但科学家和医务人员还没有发现最有效和效率最高额治疗方法组合。目前的治疗方法主要有三大类:机械清创、抗生素和抗生物膜/生物膜破坏制剂如QS阻断剂。三类中单靠任何一种都无法提供足够的治疗效果。机械清创,如手术,常常无法完全去除生物膜,因为EPS基质会深入深部组织结构。任何残留都会使生物膜很快恢复。此外,清创需要持续进行,对于不规律清创的伤口仅有25%能愈合,而每周清创的伤口83%能愈合【6】。单独使用抗生素治疗也不足够,因为生物膜具有很多耐药机制(如前文所述)。将抗生素与机械清创联合使用展现出了一些好的结果,但关键是要在生物膜形成的早期使用,越早,效果越好。研究显示新形成的生物膜相比与成熟阶段对抗生素更敏感。生物膜形成细菌金葡菌和绿脓杆菌在清创后48小时内对抗生素的敏感性更高,但在此期间的后半段(24-48小时)已经开始形成耐药(100%对漂白剂和庆大霉素耐药),72小时后,绿脓杆菌恢复至清创前的耐药性【27】。该组合方法目前仍具有一些局限性。如前所述,通过清创完全清除生物膜是不可能的,而持续使用抗生素治疗残留细菌(可能是年老、成熟的生物膜)会使其发展出抗生素耐药性。 很多研究人员正在研发抗生物膜(Antibiofilm)制剂以代替抗生素来治疗生物膜。抗生素制剂不是抗生素,但可以影响生物膜的发展,其机制包括阻断QS系统、降解EPS基质、或阻断浮游菌的附着。Furanone是一种抗生物膜制剂,是一种QS阻断剂,它可以干扰化学信号分子乙酰高丝氨酸内酯(Acyl homoserine lactone, AHL),而AHL对于生物膜社群抗生素耐药性的增加发挥作用。当使用Furanone和妥布霉素治疗绿脓杆菌时,QS系统的关闭造成细菌对抗生素敏感性的增加(Figure 8)。QS阻断剂本身不能直接削弱或杀死细菌,但其可以增加细菌对妥布霉素的敏感性【8】。因此,QS阻断剂比须与抗生素配合使用以避免细菌产生对阻断剂的耐受性。 对于所有这些诊断和治疗方法来说,必要的前提是更好的了解和区分有害细菌和有益伤口愈合的细菌。Tuttle等对慢性伤口微生物构成的研究显示绿脓杆菌,尽管其众所周知的致病性,是能在6个月内愈合伤口中的主要菌种,而6个月内未愈合的伤口的主导菌种为放线菌【12】。这些结果或许表明绿脓杆菌可能可以阻止其他致病性更高的菌种在伤口定植,或多或少“保护”宿主,防止发生慢性伤口感染。研究应该将重点放在对生物膜中致病菌和“有益”菌的特点描述上,寻找能在早期分子诊断结果后使用的清创与生物膜破坏和/或抗生素治疗的最有效结合方法。 原文作者:Katie Kaestner返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |