专题笔谈|影像学在下肢静脉疾病诊断中应用及其评价 |
您所在的位置:网站首页 › 测量学中vd是什么意思 › 专题笔谈|影像学在下肢静脉疾病诊断中应用及其评价 |
专题笔谈|影像学在下肢静脉疾病诊断中应用及其评价
|
1 CDU
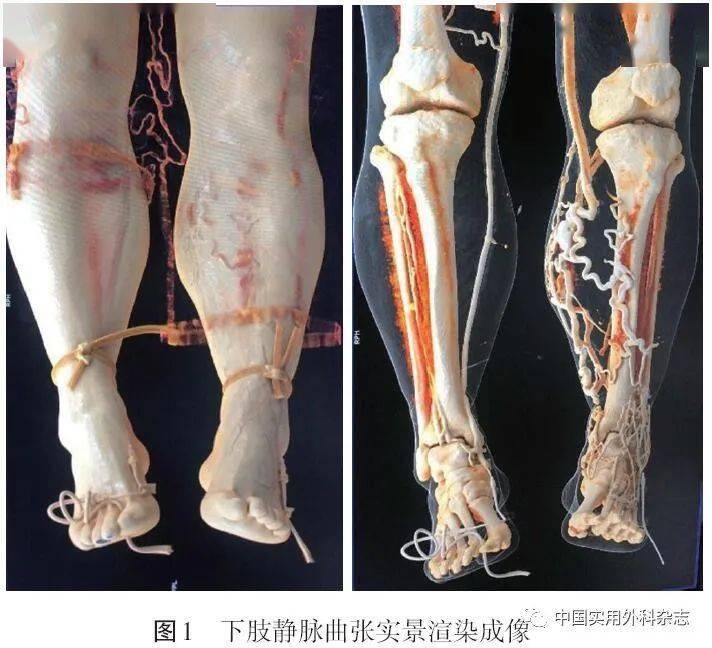
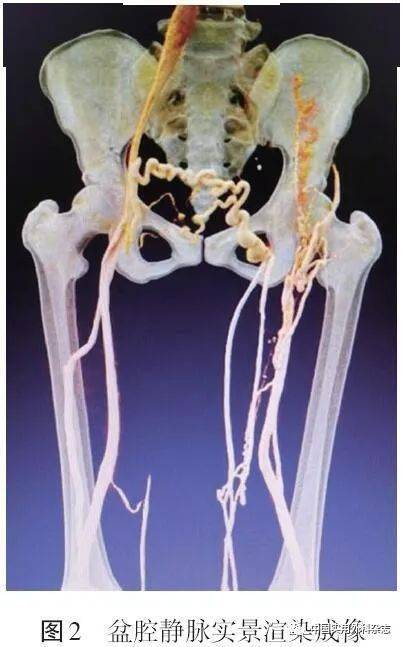
CDU是VD首选的辅助检查手段[1]。CDU具有安全、无创、方便、经济、重复性强、准确率高等特点,可观察血管的形态学变化和测量血流动力学参数,为静脉阻塞和反流提供可靠的病因学和解剖学诊断依据[2]。 完整的CDU由灰阶、彩色多普勒和频谱多普勒超声3部分组成。灰阶超声可以直视观察静脉的解剖形态和可压缩性,CDU可以检测静脉血流及其方向,频谱多普勒超声可以测量血流速度和方向。在血液反流的检查中,评估血流方向通常取反向特伦德伦伯(Trendelenburg)体位,结合Valsalva动作或用末端肢体加压激发操作来增加静脉血流。病理性反流被定义为隐静脉、股深静脉、小腿深静脉和穿通静脉反流时间>0.5 s,股浅静脉和腘静脉反流时间>1 s[2]。反流持续时间越长,表明病情越严重。虽然超声确定的疾病严重程度与临床表现相关性不强[3],但CDU提供了反流性疾病深、浅静脉以及穿通静脉系统异常瓣膜的解剖学分布信息,可以很好地帮助指导治疗。 静脉阻塞可继发于管腔血栓形成、外部压迫或两者兼有,CDU能够直视下观察或通过血流动力学参数特征推断静脉阻塞的存在及其严重程度。CDU对股腘静脉阻塞诊断的准确率较高,对小腿静脉阻塞诊断的准确率较低[4-5]。研究显示,CDU诊断股腘静脉和小腿静脉DVT的敏感度分别为96.5%和71.2%,两者的特异度均为94% [6]。由于盆腔内髂静脉位置较深,CDU对髂静脉阻塞诊断的敏感度较低。超声诊断髂静脉阻塞的总体灵敏度在髂外静脉为79%,髂总静脉为47%[7]。肥胖、潜在的肠道气体以及操作者技术水平等因素使20%~50%的检查无法充分显示髂静脉[7-8]。正因如此,超声可能不能直接检测髂静脉的血流动力学特征以及区分髂静脉的具体解剖结构,如压迫的位置或腔内血栓和“棘状物”的存在[9]。远端静脉血流异常可能提示潜在的髂静脉阻塞,这些间接征象包括髂外或股静脉血流速度减慢或出现湍流或反流,血流波形平坦或无呼吸变化,对Valsalva动作反应减弱或无反应等[10-11]。其中,有研究结果表明,股静脉反流时间>2.5 s与左髂静脉严重狭窄(≥50%)有高度相关性(敏感度为70%,特异度为80%)[12];峰值静脉流速比(peak vein velocity ratio,VR)≥2.5可以预测髂静脉严重阻塞(敏感度76%,特异度100%)[13]。然而需要注意的是,这些研究建立在小样本量基础上,尚未得到广泛验证和认可。临床上因侧支开放等因素导致髂静脉阻塞可能往往没有超声间接征象,血液反流和无呼吸变异对发现显著髂静脉阻塞的敏感度分别为7.9%和23.7%,而两者的特异度均为100%[14]。因此,针对髂静脉阻塞的诊断有赖于其他辅助检查手段。 近年来,随着超声新技术的发展,超声造影(contrast enhanced ultrasound,CEUS)[15-16]以及超声弹性成像(ultrasound elastography,UE)[17]等新技术也开始应用于VD静脉阻塞、血栓相关炎症和血栓新旧程度等诊断中。 CDU是VD首选的辅助检查手段[1]。CDU具有安全、无创、方便、经济、重复性强、准确率高等特点,可观察血管的形态学变化和测量血流动力学参数,为静脉阻塞和反流提供可靠的病因学和解剖学诊断依据[2]。 完整的CDU由灰阶、彩色多普勒和频谱多普勒超声3部分组成。灰阶超声可以直视观察静脉的解剖形态和可压缩性,CDU可以检测静脉血流及其方向,频谱多普勒超声可以测量血流速度和方向。在血液反流的检查中,评估血流方向通常取反向特伦德伦伯(Trendelenburg)体位,结合Valsalva动作或用末端肢体加压激发操作来增加静脉血流。病理性反流被定义为隐静脉、股深静脉、小腿深静脉和穿通静脉反流时间>0.5 s,股浅静脉和腘静脉反流时间>1 s[2]。反流持续时间越长,表明病情越严重。虽然超声确定的疾病严重程度与临床表现相关性不强[3],但CDU提供了反流性疾病深、浅静脉以及穿通静脉系统异常瓣膜的解剖学分布信息,可以很好地帮助指导治疗。 静脉阻塞可继发于管腔血栓形成、外部压迫或两者兼有,CDU能够直视下观察或通过血流动力学参数特征推断静脉阻塞的存在及其严重程度。CDU对股腘静脉阻塞诊断的准确率较高,对小腿静脉阻塞诊断的准确率较低[4-5]。研究显示,CDU诊断股腘静脉和小腿静脉DVT的敏感度分别为96.5%和71.2%,两者的特异度均为94% [6]。由于盆腔内髂静脉位置较深,CDU对髂静脉阻塞诊断的敏感度较低。超声诊断髂静脉阻塞的总体灵敏度在髂外静脉为79%,髂总静脉为47%[7]。肥胖、潜在的肠道气体以及操作者技术水平等因素使20%~50%的检查无法充分显示髂静脉[7-8]。正因如此,超声可能不能直接检测髂静脉的血流动力学特征以及区分髂静脉的具体解剖结构,如压迫的位置或腔内血栓和“棘状物”的存在[9]。远端静脉血流异常可能提示潜在的髂静脉阻塞,这些间接征象包括髂外或股静脉血流速度减慢或出现湍流或反流,血流波形平坦或无呼吸变化,对Valsalva动作反应减弱或无反应等[10-11]。其中,有研究结果表明,股静脉反流时间>2.5 s与左髂静脉严重狭窄(≥50%)有高度相关性(敏感度为70%,特异度为80%)[12];峰值静脉流速比(peak vein velocity ratio,VR)≥2.5可以预测髂静脉严重阻塞(敏感度76%,特异度100%)[13]。然而需要注意的是,这些研究建立在小样本量基础上,尚未得到广泛验证和认可。临床上因侧支开放等因素导致髂静脉阻塞可能往往没有超声间接征象,血液反流和无呼吸变异对发现显著髂静脉阻塞的敏感度分别为7.9%和23.7%,而两者的特异度均为100%[14]。因此,针对髂静脉阻塞的诊断有赖于其他辅助检查手段。 近年来,随着超声新技术的发展,超声造影(contrast enhanced ultrasound,CEUS)[15-16]以及超声弹性成像(ultrasound elastography,UE)[17]等新技术也开始应用于VD静脉阻塞、血栓相关炎症和血栓新旧程度等诊断中。 2 CTVCTV是一种对比增强成像方式,目前临床常用的下肢CTV技术根据对比剂注射路径可分为直接法CTV、间接法CTV和混合法CTV。直接法CTV通过足背静脉注射造影剂,间接法CTV通过前臂肘静脉注射造影剂,混合法CTV为前面两种技术的联合[18]。通过多平面重建(multi plane reconstruction,MPR)、最大密度投影(maximum intensity projection,MIP)、曲面重建(curving plane reconstruction,CPR)、容积再现(volume rendering,VR)和实景渲染(cinematic rendering,CR,见图1、2)等图像后处理功能,可以提供盆腔和下肢静脉解剖的横断面和三维结构信息。三维重建图像可以从皮肤到皮下多个深度进行调整,仿真还原下肢静脉的解剖,从而全面了解曲张静脉的分布及其与皮肤病变的关系,发现与静脉曲张相关的解剖变异(如Giacomini静脉反流、副大隐静脉反流和双大隐静脉等)[19],定位扩张的穿通静脉并了解其与浅静脉曲张的关系,判断深静脉通畅或阻塞。因此,CTV有助于了解静脉曲张的异常解剖结构和病因以及评估复发静脉曲张,也可诊断下肢脉管畸形、DVT、IVCS、盆腔淤血综合征(pelvic congestion syndrome,PCS)以及盆腔肿瘤等其他合并疾病[8]。
VD病人很少需要比CDU更复杂的影像学检查。当CDU诊断不明确或怀疑有复杂的下肢静脉解剖和盆腔静脉病变(IVCS或PCS等)时,CTV可以提供有价值的诊断信息[2,20]。CTV可以清晰地显示髂静脉受压部位和测量狭窄程度,通过侧支可以一定程度提示狭窄的血流动力学意义。总体而言,针对髂静脉狭窄,CTV敏感度较高,与DSA以及IVUS具有很好的相关性[10,21]。与IVUS相比,三维CTV对髂总静脉和髂外静脉狭窄诊断的敏感度均为100%,特异度分别为67%和57%,总体准确率分别为91%和86%[22]。CTV双节段管径测量法检测髂静脉狭窄的敏感度为97%,特异度为38%,准确率为91%[23]。在另一项研究中,CTV诊断髂静脉狭窄的敏感度为94.0%,特异度为79.2%[24]。同时,CTV对急性近端DVT具有较高敏感度和特异度[21]。Meta分析结果显示,CTV诊断近端DVT的敏感度为71%~100%,特异度为93%~100%[25]。 CTV的局限性主要在于辐射暴露和造影剂引起的过敏或肾毒性风险。随着技术的发展,CTV在扫描时间、空间分辨率和剂量效率等方面均在不断进步。比如双能量CT就能在相对较低的射线量和造影剂剂量下获得满意的成像效果[11,18]。CT结合核医学技术(如正电子发射断层扫描),将有潜力提供有关血栓结构的分子信息,有助于指导治疗[26-27]。 CTV是一种对比增强成像方式,目前临床常用的下肢CTV技术根据对比剂注射路径可分为直接法CTV、间接法CTV和混合法CTV。直接法CTV通过足背静脉注射造影剂,间接法CTV通过前臂肘静脉注射造影剂,混合法CTV为前面两种技术的联合[18]。通过多平面重建(multi plane reconstruction,MPR)、最大密度投影(maximum intensity projection,MIP)、曲面重建(curving plane reconstruction,CPR)、容积再现(volume rendering,VR)和实景渲染(cinematic rendering,CR,见图1、2)等图像后处理功能,可以提供盆腔和下肢静脉解剖的横断面和三维结构信息。三维重建图像可以从皮肤到皮下多个深度进行调整,仿真还原下肢静脉的解剖,从而全面了解曲张静脉的分布及其与皮肤病变的关系,发现与静脉曲张相关的解剖变异(如Giacomini静脉反流、副大隐静脉反流和双大隐静脉等)[19],定位扩张的穿通静脉并了解其与浅静脉曲张的关系,判断深静脉通畅或阻塞。因此,CTV有助于了解静脉曲张的异常解剖结构和病因以及评估复发静脉曲张,也可诊断下肢脉管畸形、DVT、IVCS、盆腔淤血综合征(pelvic congestion syndrome,PCS)以及盆腔肿瘤等其他合并疾病[8]。
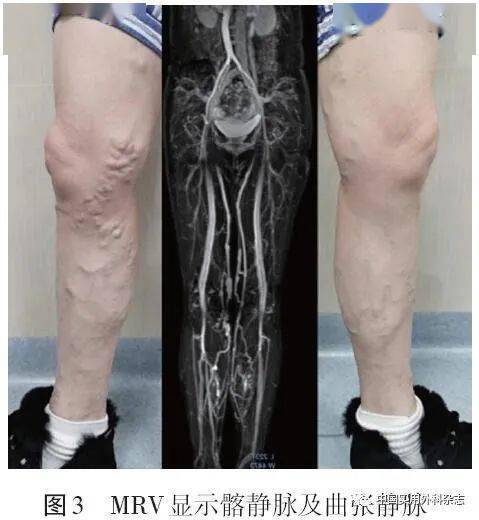
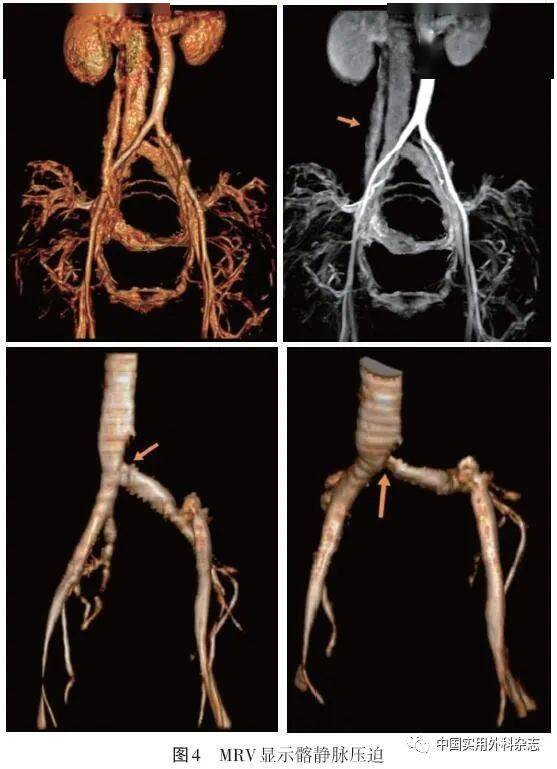
VD病人很少需要比CDU更复杂的影像学检查。当CDU诊断不明确或怀疑有复杂的下肢静脉解剖和盆腔静脉病变(IVCS或PCS等)时,CTV可以提供有价值的诊断信息[2,20]。CTV可以清晰地显示髂静脉受压部位和测量狭窄程度,通过侧支可以一定程度提示狭窄的血流动力学意义。总体而言,针对髂静脉狭窄,CTV敏感度较高,与DSA以及IVUS具有很好的相关性[10,21]。与IVUS相比,三维CTV对髂总静脉和髂外静脉狭窄诊断的敏感度均为100%,特异度分别为67%和57%,总体准确率分别为91%和86%[22]。CTV双节段管径测量法检测髂静脉狭窄的敏感度为97%,特异度为38%,准确率为91%[23]。在另一项研究中,CTV诊断髂静脉狭窄的敏感度为94.0%,特异度为79.2%[24]。同时,CTV对急性近端DVT具有较高敏感度和特异度[21]。Meta分析结果显示,CTV诊断近端DVT的敏感度为71%~100%,特异度为93%~100%[25]。 CTV的局限性主要在于辐射暴露和造影剂引起的过敏或肾毒性风险。随着技术的发展,CTV在扫描时间、空间分辨率和剂量效率等方面均在不断进步。比如双能量CT就能在相对较低的射线量和造影剂剂量下获得满意的成像效果[11,18]。CT结合核医学技术(如正电子发射断层扫描),将有潜力提供有关血栓结构的分子信息,有助于指导治疗[26-27]。 3 MRVMRV和CTV一样,属于无创横断面成像方式。相较于CVT,MRV无辐射,甚至无须使用造影剂即可完成下肢静脉扫查。MRV技术可分为对比增强MRV(contrast enhanced MRV,CE-MRV)和非增强MRV(non-contrast enhanced MRV,NCE-MRV)。CE-MRV将顺磁性对比剂注入静脉血管内,提高静脉血液与周围软组织对比,从而清楚显示静脉。NCE-MRV技术的原理是利用血管内流动血液与组织产生的信号差异,采用“流动相关增强”,无须使用造影剂即可进行二维或三维血管成像。常用的NCE-MRV成像技术包括:无需对比剂和心电、呼吸门控触发的血管造影术(relaxation-enhanced MR angiography without contrast and triggering,REACT)、平衡快速场回波技术(balanced turbo field echo,B-TFE)、时间飞跃技术(time-of-flight,TOF)和触发血管造影非对比增强技术(triggered angiography non-contrast-enhanced,TRANCE)等[28]。 虽然MRV是有效的诊断下肢静脉病变的影像学方法[29],研究同样不推荐MRV常规应用于下肢静脉检查,而更多用于复杂的下肢静脉解剖和更近端静脉及其周围结构以评估内部阻塞或外部压迫[30-32]。MRV在诊断急性DVT[33]和确定血栓新鲜程度等方面已确立了临床有用性[34]。一项涉及不同磁共振技术的系统综述和Meta分析结果显示,MRV诊断近端DVT具有高灵敏度(范围87.5%~94.5%,综合敏感度92%)和特异度(范围92.6%~96.5%,合并敏感度95%)[35]。MRV能显示髂静脉受压情况和静脉侧支开放程度(图3、4)[7,9],由于具有较高的软组织分辨率,MRV相较于CTV能更好地显示髂静脉内“棘状物”、血栓、静脉壁增厚以及盆腔包块等[9]。既往研究表明MRV存在假阳性,并将其归因于以下要素:静脉是动态结构,而MRV提供的是静态图像,腔静脉和髂静脉的直径随着整体血管内容积变化、呼吸运动、病人体位和静脉疾病的存在而显著改变[36]。最近的一项研究利用MRV评估髂静脉受压程度,并验证吸气末、呼气末、仰卧位、俯卧位、有下肢症状和无下肢症状病人压迫测量的差异,结果发现只有呼气末直径测量值有轻微差异[37],提示MRV可用于IVCS的诊断。针对髂静脉狭窄,研究显示MRV与IVUS相比得到的敏感度和特异度分别为100.0%和22.7%[38]。CE-MRI与NCE-MRI靶静脉切面面积存在显著相关,但两者与IVUS相关性较弱,CE-MRI或NCE-MRI与IVUS的静脉切面面积差异百分比为27%~60%[28]。MRV在检测髂静脉病变方面还需要更多前瞻性研究进行验证。
针对MRV的弱点,许多非对比增强技术如REACT不断得到改进,避免了造影剂毒性并能明显缩短扫查时间。结合靶向纤维蛋白、FXIIIa和血小板等纳米制剂分子影像学技术的MRV已经被证明可以检测并定量血管内血栓[39]。四维成像可以弥补MRV功能成像的不足。 MRV和CTV一样,属于无创横断面成像方式。相较于CVT,MRV无辐射,甚至无须使用造影剂即可完成下肢静脉扫查。MRV技术可分为对比增强MRV(contrast enhanced MRV,CE-MRV)和非增强MRV(non-contrast enhanced MRV,NCE-MRV)。CE-MRV将顺磁性对比剂注入静脉血管内,提高静脉血液与周围软组织对比,从而清楚显示静脉。NCE-MRV技术的原理是利用血管内流动血液与组织产生的信号差异,采用“流动相关增强”,无须使用造影剂即可进行二维或三维血管成像。常用的NCE-MRV成像技术包括:无需对比剂和心电、呼吸门控触发的血管造影术(relaxation-enhanced MR angiography without contrast and triggering,REACT)、平衡快速场回波技术(balanced turbo field echo,B-TFE)、时间飞跃技术(time-of-flight,TOF)和触发血管造影非对比增强技术(triggered angiography non-contrast-enhanced,TRANCE)等[28]。 虽然MRV是有效的诊断下肢静脉病变的影像学方法[29],研究同样不推荐MRV常规应用于下肢静脉检查,而更多用于复杂的下肢静脉解剖和更近端静脉及其周围结构以评估内部阻塞或外部压迫[30-32]。MRV在诊断急性DVT[33]和确定血栓新鲜程度等方面已确立了临床有用性[34]。一项涉及不同磁共振技术的系统综述和Meta分析结果显示,MRV诊断近端DVT具有高灵敏度(范围87.5%~94.5%,综合敏感度92%)和特异度(范围92.6%~96.5%,合并敏感度95%)[35]。MRV能显示髂静脉受压情况和静脉侧支开放程度(图3、4)[7,9],由于具有较高的软组织分辨率,MRV相较于CTV能更好地显示髂静脉内“棘状物”、血栓、静脉壁增厚以及盆腔包块等[9]。既往研究表明MRV存在假阳性,并将其归因于以下要素:静脉是动态结构,而MRV提供的是静态图像,腔静脉和髂静脉的直径随着整体血管内容积变化、呼吸运动、病人体位和静脉疾病的存在而显著改变[36]。最近的一项研究利用MRV评估髂静脉受压程度,并验证吸气末、呼气末、仰卧位、俯卧位、有下肢症状和无下肢症状病人压迫测量的差异,结果发现只有呼气末直径测量值有轻微差异[37],提示MRV可用于IVCS的诊断。针对髂静脉狭窄,研究显示MRV与IVUS相比得到的敏感度和特异度分别为100.0%和22.7%[38]。CE-MRI与NCE-MRI靶静脉切面面积存在显著相关,但两者与IVUS相关性较弱,CE-MRI或NCE-MRI与IVUS的静脉切面面积差异百分比为27%~60%[28]。MRV在检测髂静脉病变方面还需要更多前瞻性研究进行验证。
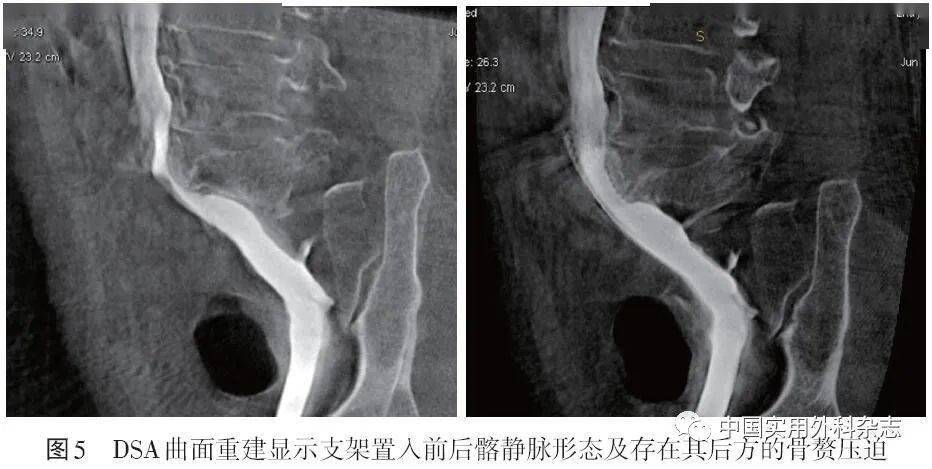
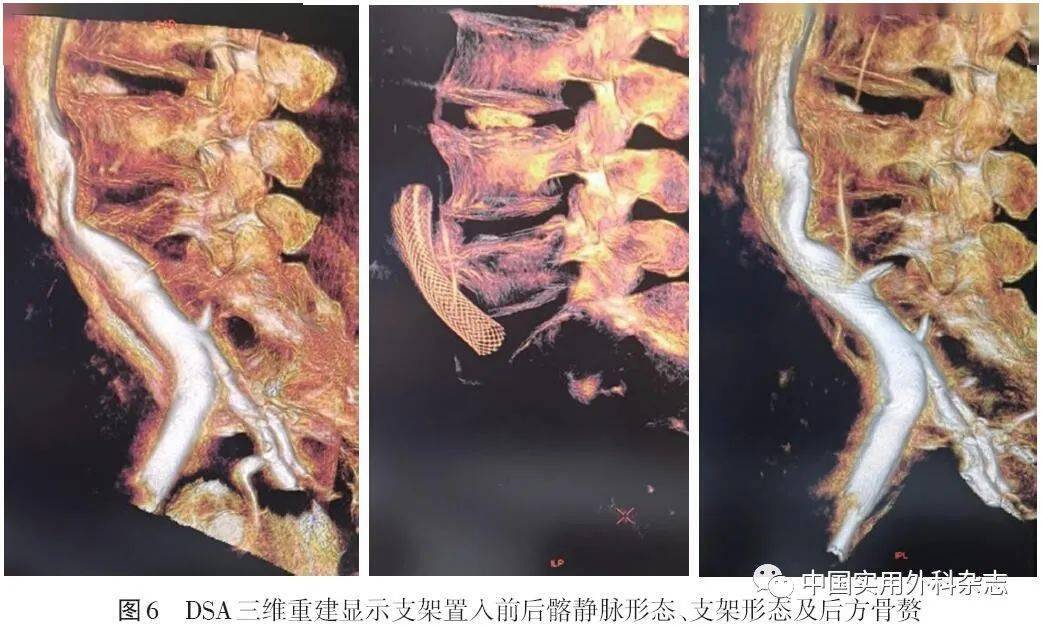
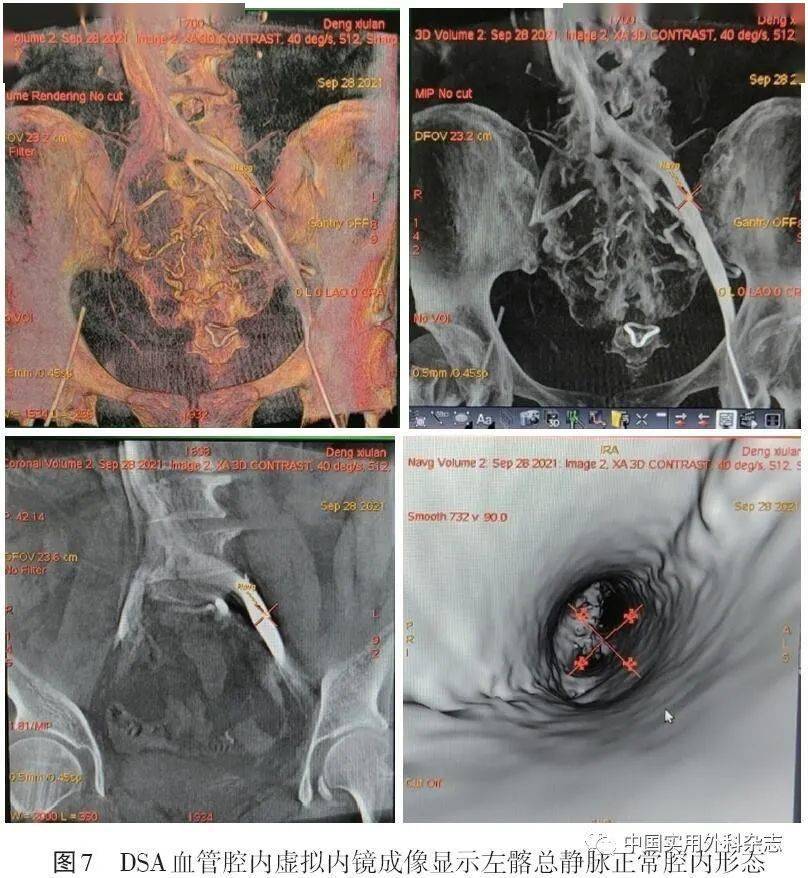
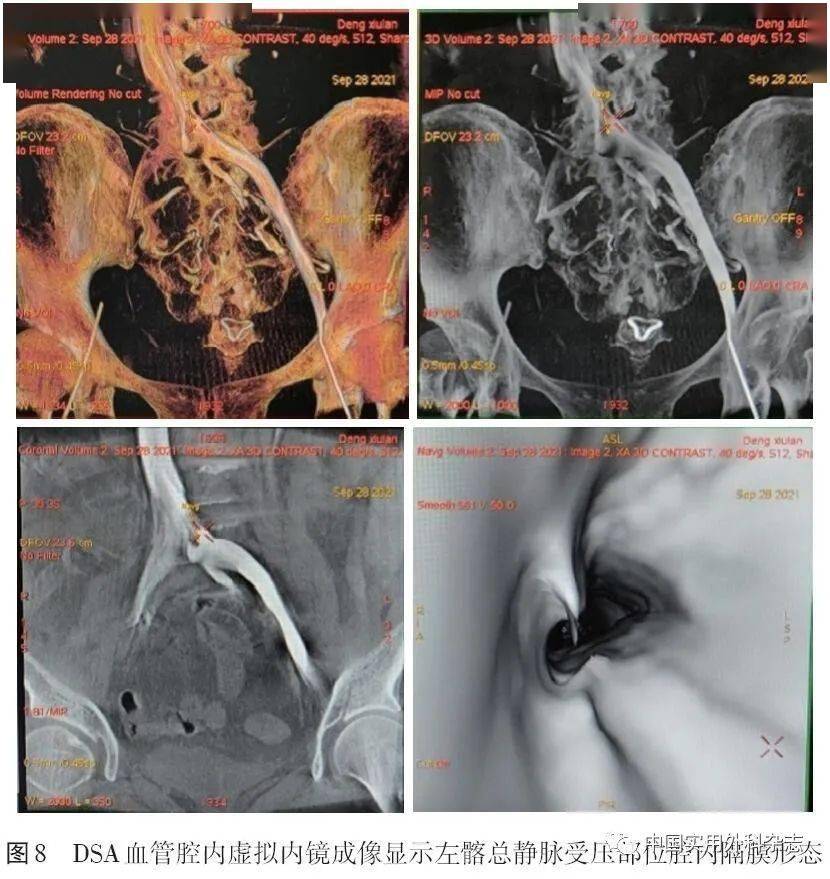
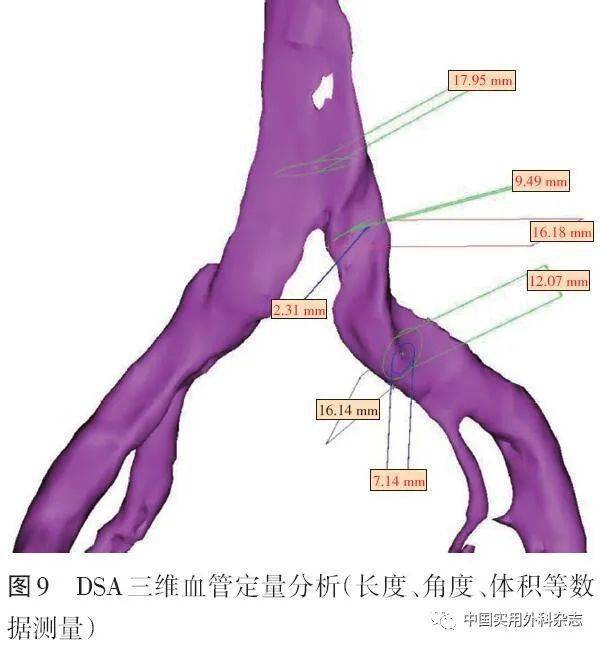
针对MRV的弱点,许多非对比增强技术如REACT不断得到改进,避免了造影剂毒性并能明显缩短扫查时间。结合靶向纤维蛋白、FXIIIa和血小板等纳米制剂分子影像学技术的MRV已经被证明可以检测并定量血管内血栓[39]。四维成像可以弥补MRV功能成像的不足。 4 DSA4.2 三维DSA(three-dimensional DSA,3D-DSA) 3D-DSA是在旋转DSA技术基础上,结合数字血管机C臂CT技术以及计算机三维图像处理技术发展出的一项新DSA技术[42]。该技术是对传统DSA的重要补充,只通过1次对比剂的注入就可以获得不同角度的多维空间血管造影图像。通过图像后处理,得到血管和周围软组织的三维图像,能够从最佳位置观察血管的正常解剖和异常改变以及病变原因(内在阻塞或外在压迫),提高病变血管的显示率,为治疗方案的选择和术后效果的评定提供最直观的影像依据。3D-DSA技术已经在神经和肝脏介入等领域得到应用[43-44]。在下肢静脉介入领域,3D-DSA技术特别适用于IVCS的诊断和治疗,我国已有越来越多的中心在IVCS介入中使用该项技术。北京大学第三医院报道3D-DSA和传统DSA诊断IVCS的狭窄率具有很好的一致性(kappa=0.78),并且3D-DSA能够提供更多的侧支静脉和管腔外邻近组织的细节[45]。笔者医院影像学团队基于DSA三维工作站平台,已实现三维重建的多项功能并常规辅助IVCS介入评估和支架选择等,如DSA曲面重建显示支架形态及存在其后方的骨赘压迫(图5、6)、血管虚拟内镜成像显示左髂总静脉的血管腔内形态(图7、8)、三维血管定量分析,如长度、角度、体积等数据测量(图9)等,展示了3D-DSA是一种很有前景的同期诊断和治疗IVCS的技术。
4.2 三维DSA(three-dimensional DSA,3D-DSA) 3D-DSA是在旋转DSA技术基础上,结合数字血管机C臂CT技术以及计算机三维图像处理技术发展出的一项新DSA技术[42]。该技术是对传统DSA的重要补充,只通过1次对比剂的注入就可以获得不同角度的多维空间血管造影图像。通过图像后处理,得到血管和周围软组织的三维图像,能够从最佳位置观察血管的正常解剖和异常改变以及病变原因(内在阻塞或外在压迫),提高病变血管的显示率,为治疗方案的选择和术后效果的评定提供最直观的影像依据。3D-DSA技术已经在神经和肝脏介入等领域得到应用[43-44]。在下肢静脉介入领域,3D-DSA技术特别适用于IVCS的诊断和治疗,我国已有越来越多的中心在IVCS介入中使用该项技术。北京大学第三医院报道3D-DSA和传统DSA诊断IVCS的狭窄率具有很好的一致性(kappa=0.78),并且3D-DSA能够提供更多的侧支静脉和管腔外邻近组织的细节[45]。笔者医院影像学团队基于DSA三维工作站平台,已实现三维重建的多项功能并常规辅助IVCS介入评估和支架选择等,如DSA曲面重建显示支架形态及存在其后方的骨赘压迫(图5、6)、血管虚拟内镜成像显示左髂总静脉的血管腔内形态(图7、8)、三维血管定量分析,如长度、角度、体积等数据测量(图9)等,展示了3D-DSA是一种很有前景的同期诊断和治疗IVCS的技术。
在下肢VD的评估中,多种影像学方法可以提供非常有价值的信息。CDU是VD首选的辅助检查手段,当CDU诊断不足时可考虑CTV或MRV。DSA和IVUS用于诊断无创检查结果不确切的复杂VD,其作用更多是用于指导静脉腔内治疗。目前的影像学检查手段仍然有利有弊,临床需要根据具体的VD病例进行选择。随着科技的不断进步,各种影像技术也在不断地发展,从而为下肢VD的诊断及治疗提供更好的指导。 在下肢VD的评估中,多种影像学方法可以提供非常有价值的信息。CDU是VD首选的辅助检查手段,当CDU诊断不足时可考虑CTV或MRV。DSA和IVUS用于诊断无创检查结果不确切的复杂VD,其作用更多是用于指导静脉腔内治疗。目前的影像学检查手段仍然有利有弊,临床需要根据具体的VD病例进行选择。随着科技的不断进步,各种影像技术也在不断地发展,从而为下肢VD的诊断及治疗提供更好的指导。 参考文献 (在框内滑动手指即可浏览) [1] Garcia R,Labropoulos N.Duplex ultrasound for the diagnosis of acute and chronic venous diseases[J].Surg Clin North Am,2018,98(2):201-218. [2] Gloviczki P,Comerota AJ,Dalsing MC,et al.The care of patients with varicose veins and associated chronic venous diseases: clinical practice guidelines of the Society for Vascular Surgery and the American Venous Forum[J].J Vasc Surg,2011,53(suppl 5):2. [3] Neglén P,Egger JF,Olivier J,et al.Hemodynamic and clinical impact of ultrasound-derived venous reflux parameters[J].J Vasc Surg,2004,40(2):303-310. [4] 中华医学会外科学分会血管外科学组.深静脉血栓形成的诊断和治疗指南(第三版)[J].中国血管外科杂志(电子版),2017,9(4):250-257. [5] Needleman L,Cronan JJ,Lilly MP,et al.Ultrasound for lower extremity deep venous thrombosis: multidisciplinary recommendations from the society of radiologists in ultrasound consensus conference[J].Circulation,2018,137(14):1505-1515. [6] Goodacre S,Sampson F,Thomas S,et al.Systematic review and meta-analysis of the diagnostic accuracy of ultrasonography for deep vein thrombosis[J].BMC Med Imaging,2005,5:6. [7] Zucker EJ, Gnguli S, Ghoshhajra BB, et al. Imaging of venous compression syndromes[J]. Therapy,2016,6:519-532. [8] Brinegar KN,Sheth RA,Khademhosseini A,et al.Iliac vein compression syndrome: Clinical, imaging and pathologic findings[J].World J Radiol,2015,7(11):375-381. [9] White JM, Comerota AJ. Venous compression syndromes[J]. Vasc Endovascular Surg,2017,51:155-168. [11] Toh MR,Tang TY,Lim HHMN,et al.Review of imaging and endovascular intervention of iliocaval venous compression syndrome[J].World J Radiol,2020,12(3):18-28. [12] Mousa AY,Broce M,Yacoub M,et al.Validation of venous duplex ultrasound imaging in determining iliac vein stenosis after standard treatment of active chronic venous ulcers[J].J Vasc Surg Venous Lymphat Disord,2016,4(3):307-312. [13] Metzger PB,Rossi FH,Kambara AM,et al.Criteria for detecting significant chronic iliac venous obstructions with duplex ultrasound[J].J Vasc Surg Venous Lymphat Disord,2016,4(1):18-27. [14] Sermsathanasawadi N,Pruekprasert K,Pitaksantayothin W,et al.Prevalence, risk factors, and evaluation of iliocaval obstruction in advanced chronic venous insufficiency[J].J Vasc Surg Venous Lymphat Disord,2019,7(3):441-447. [15] Liu H,Wang J,Zhao Y,et al.Doppler ultrasound and contrast-enhanced ultrasound in detection of stent stenosis after iliac vein stenting[J].BMC Cardiovasc Disord,2021,21(1):42. [16] Kaspar M,Imfeld S,Partovi S,et al.Perivascular Perfusion on Contrast-Enhanced Ultrasound (CEUS) is associated with inflammation in patients with acute deep vein thrombosis[J].Thromb Haemost,2017,117(11):2146-2155. [18] Silickas J,Black SA,Phinikaridou A,et al.Use of computed tomography and magnetic resonance imaging in central venous disease[J].Methodist Debakey Cardiovasc J,2018,14(3):188-195. [19] Min SK,Kim SY,Park YJ,et al.Role of three-dimensional computed tomography venography as a powerful navigator for varicose vein surgery[J].J Vasc Surg,2010,51(4):893-899. [20] Eberhardt RT,Raffetto JD. Chronic venous insufficiency[J].Circulation,2014,130(4):333-346. [21] Saleem T,Raju S.Comparison of intravascular ultrasound and multidimensional contrast imaging modalities for characterization of chronic occlusive iliofemoral venous disease: A systematic review[J].J Vasc Surg Venous Lymphat Disord,2021,9(6):1545-1556. [22] Jayaraj A,Raju S.Three-dimensional computed tomography venogram enables accurate diagnosis and treatment of patients presenting with symptomatic chronic iliofemoral venous obstruction[J].J Vasc Surg Venous Lymphat Disord,2021,9(1):73-80. [23] Raju S,Walker W,Noel C,et al.The two-segment caliber method of diagnosing iliac vein stenosis on routine computed tomography with contrast enhancement[J].J Vasc Surg Venous Lymphat Disord,2020,8(6):970-977. [24] Rossi FH,Kambara AM,Rodrigues TO,et al.Comparison of computed tomography venography and intravascular ultrasound in screening and classification of iliac vein obstruction in patients with chronic venous disease[J].J Vasc Surg Venous Lymphat Disord,2020,8(3):413-422. [25] Thomas SM,Goodacre SW,Sampson FC,et al.Diagnostic value of CT for deep vein thrombosis: results of a systematic review and meta-analysis[J].Clin Radiol,2008,63(3):299-304. [26] Rondina MT,Lam UT,Pendleton RC,et al.(18)F-FDG PET in the evaluation of acuity of deep vein thrombosis[J].Clin Nucl Med,2012,37(12):1139-1145. [27] Hara T,Truelove J,Tawakol A,et al.18F-fluorodeoxyglucose positron emission tomography/computed tomography enables the detection of recurrent same-site deep vein thrombosis by illuminating recently formed, neutrophil-rich thrombus[J].Circulation,2014,130(13):1044-1052. [28] Kusiak A,Budzyński J.Usefulness of non-contrast-enhanced magnetic resonance imaging prior to venous interventions[J].Postepy Kardiol Interwencyjnej,2019,15(3):338-344. [29] Chen CW,Ting H,Chen PY,et al.Usefulness of triggered non-contrast-enhanced magnetic resonance angiography in assessing lower extremity venous disease[J].Medicine (Baltimore),2021,100(20):e25809. [30] Santler B,Goerge T.Chronic venous insufficiency - a review of pathophysiology, diagnosis, and treatment[J].J Dtsch Dermatol Ges,2017,15(5):538-556. [31] Youn YJ,Lee J.Chronic venous insufficiency and varicose veins of the lower extremities[J].Korean J Intern Med,2019,34(2):269-283. [32] on Vascular EP,Hanley M,Steigner ML,et al.ACR appropriateness criteria ® suspected lower extremity deep vein thrombosis[J].J Am Coll Radiol,2018,15(suppl 11):413-417. [33] Piazza G,Mani V,Goldhaber SZ,et al.Magnetic resonance venography to assess thrombus resolution with edoxaban monotherapy versus parenteral anticoagulation/warfarin for symptomatic deep vein thrombosis: A multicenter feasibility study[J].Vasc Med,2016,21(4):361-368. [35] Sampson FC,Goodacre SW,Thomas SM,et al.The accuracy of MRI in diagnosis of suspected deep vein thrombosis: systematic review and meta-analysis[J].Eur Radiol,2007,17(1):175-181. [36] Esposito A,Charisis N,Kantarovsky A,et al.A comprehensive review of the pathophysiology and clinical importance of iliac vein obstruction[J].Eur J Vasc Endovasc Surg,2020,60(1):118-125. [37] Costa LMG,Tachibana A,da Silva F,et al.Magnetic resonance imaging evaluation of left common iliac vein compression in patients with and without symptoms of venous disease[J].Circ J,2020,84(5):763-768. [38] Massenburg BB,Himel HN,Blue RC,et al.Magnetic resonance imaging in proximal venous outflow obstruction[J].Ann Vasc Surg,2015,29(8):1619-1624. [39] McCarthy JR,Patel P,Botnaru I,et al.Multimodal nanoagents for the detection of intravascular thrombi[J].Bioconjug Chem,2009,20(6):1251-1255. [40] Radaideh Q,Patel NM, Shammas NW. Iliac vein compression: epidemiology, diagnosis and treatment[J]. Vasc Health Risk Manag,2019,15:115-122. [41] Wittens C,Davies AH,Bækgaard N,et al.Editor's choice - management of chronic venous disease: clinical practice guidelines of the European Society for Vascular Surgery (ESVS)[J].Eur J Vasc Endovasc Surg,2015,49(6):678-737. [42] Wallace MJ,Kuo MD,Glaiberman C,et al.Three-dimensional C-arm cone-beam CT: applications in the interventional suite[J].J Vasc Interv Radiol,2009,20(suppl 7):523-537. [44] Chivot C,Robert B,Bouzerar R,et al.3D C-Arm cone beam CT for targeting the portal vein during TIPS: Initial clinical experience[J].Eur J Radiol,2018,106:20-25. [45] Wang CM,Zhang WL,Li X.C-arm-based flat-panel detector cone-beam computed tomography venography in the diagnosis of iliac vein compression syndrome[J].Chin Med J (Engl),2020,134(4):431-438. [46] Saleem T,Knight A,Raju S.Diagnostic yield of intravascular ultrasound in patients with clinical signs and symptoms of lower extremity venous disease[J].J Vasc Surg Venous Lymphat Disord,2020,8(4):634-639. [47] Choi KH,Song YB,Lee JM,et al.Impact of intravascular ultrasound-guided percutaneous coronary intervention on long-term clinical outcomes in patients undergoing complex procedures[J].JACC Cardiovasc Interv,2019,12(7):607-620. [48] Marteslo JP,Makary MS,Khabiri H,et al.Intravascular ultrasound for the peripheral vasculature-current applications and new horizons[J].Ultrasound Med Biol,2020,46(2):216-224. [49] Montminy ML,Thomasson JD,Tanaka GJ,et al.A comparison between intravascular ultrasound and venography in identifying key parameters essential for iliac vein stenting[J].J Vasc Surg Venous Lymphat Disord,2019,7(6):801-807. [50] Lau I,Png CYM,Eswarappa M,et al.Defining the utility of anteroposterior venography in the diagnosis of venous iliofemoral obstruction[J].J Vasc Surg Venous Lymphat Disord,2019,7(4):514-521. [51] Gagne PJ,Tahara RW,Fastabend CP,et al.Venography versus intravascular ultrasound for diagnosing and treating iliofemoral vein obstruction[J].J Vasc Surg Venous Lymphat Disord,2017,5(5):678-687. [52] Gagne PJ,Gasparis A,Black S,et al.Analysis of threshold stenosis by multiplanar venogram and intravascular ultrasound examination for predicting clinical improvement after iliofemoral vein stenting in the VIDIO trial[J].J Vasc Surg Venous Lymphat Disord,2018,6(1):48-56. [53] Shammas NW,Shammas GA,Miller SJ,et al.Predicting iliac vein compression with computed tomography angiography and venography: correlation with intravascular ultrasound[J].J Invasive Cardiol,2018,30(12):452-455. [54] Gagne PJ,Tahara R, Fastabend C, et al. Venogram versus intravascular ultrasound for diagnosing and treating iliofemoral vein obstruction(VIDIO): report from a multicenter, prospective study of iliofemoral vein interventions[J].J Vasc Surg Venous Lym Dis,2016,4(1):136. [55] McLafferty RB.The role of intravascular ultrasound in venous thromboembolism[J].Semin Intervent Radiol,2012,29(1):10-15. (2021-11-08收稿) 版权声明 本文为《中国实用外科杂志》原创文章。其他媒体、网站、公众号等如需转载本文,请联系本刊编辑部获得授权,并在文题下醒目位置注明“原文刊发于《中国实用外科杂志》,卷(期):起止页码”。谢谢合作!返回搜狐,查看更多 |
【本文地址】