物质的量浓度 |
您所在的位置:网站首页 › 有关物质的量浓度计算应注意的问题是什么 › 物质的量浓度 |
物质的量浓度
|
物质的量浓度知识点包括物质的量浓度、物质的量浓度与溶质质量分数的比较、一定物质的量浓度溶液的配制等部分,有关物质的量浓度的详情如下: 物质的量浓度
内容 物质的量浓度 溶质质量分数 定义 以单位体积溶液中所含溶质的物质的量来表示溶液组成的物理量 用溶质质量与溶液质量之比来表示溶液组成的物理量 溶质的 单位 mol g 溶液的单位 L g 计算公式
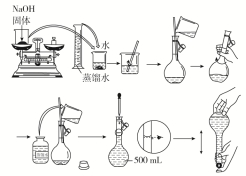
1.主要仪器 (1)托盘天平:称量前先调零,称量时药品放在左盘,砝码放在右盘,读数精确到0.1 g。 (2)容量瓶 ①构造及三标记
②容量瓶使用前要先查漏后洗净。 (3)其他仪器:量筒、烧杯、玻璃棒、胶头滴管等。 2.配制过程 以配制480 mL 1 mol·L-1 NaOH溶液为例,所需容量瓶的规格:500_mL。 (1)配制流程如下图所示:
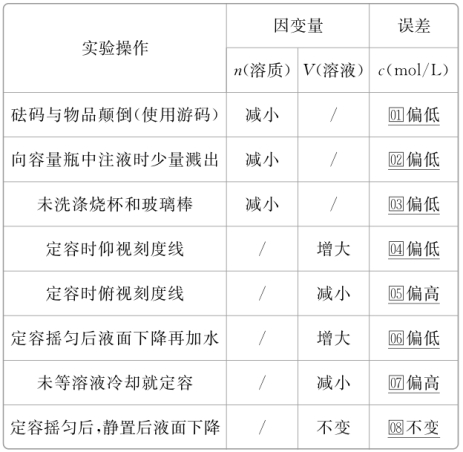
(2)配制步骤 ①计算(填写计算过程与结果) m(NaOH)=0.5_L×1_mol·L-1×40_g·mol-1=20.0_g。 ②称量:根据计算结果,称量固体质量。 ③溶解:将称量好的固体放入烧杯中,加适量水溶解,并用玻璃棒搅拌;溶解过程中玻璃棒的作用为加速溶解。 ④转移(移液) 移液前需要将溶液冷却至室温,然后用玻璃棒引流至500 ml容量瓶中。 ⑤洗涤:用适量蒸馏水将烧杯及玻璃棒洗涤2~3次,洗涤液也都注入容量瓶中,并振荡容量瓶,使溶液混合均匀。 ⑥定容 将蒸馏水注入容量瓶,待液面离容量瓶颈刻度线下1~2_cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面最低处与刻度线水平相切。 ⑦摇匀:盖好瓶塞,反复上下颠倒,摇匀。 ⑧装瓶、贴签。 3.误差分析
|
【本文地址】
今日新闻 |
推荐新闻 |