植物毛状体的分析与评述 |
您所在的位置:网站首页 › 拟物的典型例子的拟体是什么 › 植物毛状体的分析与评述 |
植物毛状体的分析与评述
|
植物毛粒的发展是协调和调节的各种因素,例如环境,激素,调节基因和非编码RNA。其中,监管基因包括转录因子和功能基因,在调节初始化,生长和发育中起重要作用。 培养基因编码基因的调节机制植物毛状体的发育受复杂的分子网络、植物激素和环境因素的调控。1).以前的研究表明,许多转录因子参与调节植物毛粒的起始,生长和发育(表1).阳性调节因子包括WD40家族蛋白TTG1(透明Testa Glabra1),四种类似的转录因子GL3(GLABRA3),EGL3(Glabra3的增强剂),TT8(透明Testa),MyC-1和三个R2R3相关转录因素(GL1,MYB23和MYB5)[33那41那46那47那65那66那67那68那69].这些基因在功能上是冗余的,并形成MYB-bHLH-TTG复合物与启动子结合glabra2.(GL2.)[70].TTG1在毛状体的发育中起着重要的调控作用。Bloomer等(2012)发现MYB23、GL1、GL2和GL3在毛状体发育中的调控作用需要TTG1的参与[71].GL1和TTG1中的完全突变导致培养滴注体的损失。这GL3 / EGL3.双突变体也显示无毛表型[72].SAD2(对ABA和DROUGHT 2敏感)是一种重要的β样蛋白,通过介导GL3功能调控毛状体的启动。在SAD2突变体,MyB23,GL1,GL2和TTG1的转录物水平随GL3和EGL3表达的降低而增加[73]. 图。1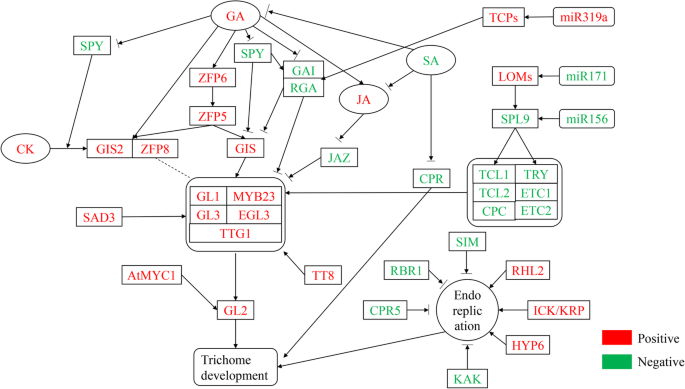
毛状体发育过程中的调控网络。红色为正调节因子,绿色为负调节因子。箭头线表示上调,钝线表示下调或抑制 全尺寸图像 表1植物毛状体发育相关的重要基因 全尺寸表负调节器包括Caprice(CPC),Triptychon(尝试),尝试增强器和CPC1(ETC1),ETC2,其显示功能冗余。与GL3,EGL3和TTG1相互作用的阴性调节剂负面调节毛状体的发育[73].此外,ETC1和ETC2充当尝试和CPC的增强剂,以促进细胞之间的运动,并通过与GL3和TTG1相互作用来抑制毛状体发育的开始。CPC并尝试具有类似的功能[42]. 目前,关于毛状体发育的分子调控机制有两种模型,它们共同调控植物毛状体的生长发育。第一种是激活剂耗尽模型:TTG1在毛状体发育中具有双重作用,在细胞间自由移动,并结合GL3/EGL3和GL1/MYB23形成GL1/MYB23-GL3/EGL3-TTG1复合物,正向调节毛状体发育[74].第二种是活化剂抑制剂模型:MYB-BHLH-TTG复合物激活试验/ CPC并促进尝试和CPC蛋白进入相邻的细胞。该复合物形成无活性的试验/ CPC-GL3 / EGL3-TTG1复合物,并通过替换积极调节的转录因子GL1 / MYB23来负调节毛状体形成[75].SAD2通过调节植物中许多培养基相关基因的MRNA的积累来维持GL1-GL3-TTG1复合物的稳定性,这反过来影响蛋白质活性[53]. 此外,一些调节因子通过调节培养细胞的核复制来影响毛状体分支。在培养型核DNA的初期综合术后,发生滴毛组分支的形成。其中,影响DNA复制和分支过程的阳性调节剂是CDK / KIP相关蛋白(ICK / KRP),根部无毛2(RHL2),Hypoco-Tyl 6(Hyp6),Zwichel(ZWI),无毛花序的交互剂茎(GIS),GL3和TTG1。 在单细胞中ICK1/KRP1的错误表达拟南芥毛状体减少核内再复制、细胞大小并诱导细胞死亡[50].这zwi, rhl2和hyp6突变减少毛状体分支[76];AtFIP37和GIS通过核内复制周期正调控植物毛状体分支[77那78].毛状体分支的负调控因子包括SIAMESE (SIM)、KAKTUS (KAK)、SPINDLY (SPY)、CONSTITUTIVE PATHOGEN RESPONSE 5 (CPR5)、RETINOBLASTOMA RELATED 1 (RBR)、TRY和HOMEODOMAIN GLABROUS 11 (HDG11)。SIM, CPR5和RBR都通过控制核复制来影响毛状体分支[42那56那66];KAK主要调控GL3和EGL3的表达模式,导致毛状体分支减少[55];SPY是由赤霉素控制的负调控因子[79],而HDG11可以恢复表型GL2.突变体的拟南芥毛状体(58]. 滴毛体和植物有机组织的发育同步发生。玻璃状头发(glh),tbr,noeck(nok),它们的蛋白质复合物一起诱导毛粒的形成。三种基因的突变表型均为玻璃状胎儿[59那60那61].在毛状体发育后期,GLH可诱导毛状体形成乳头状毛格拉夫突变体减少拟南芥[59].此外,复合物GL1-GL3-TTG1通过激活毛状体发育的负调控基因CPC、TRY、ETC1等,影响细胞间的信号传递,从而抑制GL1-GL3-TTG1复合物的活性,促进细胞向非毛状细胞的发育[50]. 然而,在各种植物中培养的滴毛瘤的调节机制是不同的。过度表达拟南芥GL1在烟草(烟草L)不影响毛状体的发育。金鱼草MIXTA和棉花MIXTA同源基因CotMYB基因的过表达增加了棉花的密度n .烟草滴毛症,而转基因拟南芥MIXTA显示没有变化[68].此外,棉花TRY基因的过表达阻碍了烟草毛状体的发育,而转基因烟草则相反拟南芥没有变化[64].拟南芥毛状体抑制器CPC没有影响l . esculentum毛状体特征[80].控制滴毛组发酵G11和滴毛体分化OCL4B(外部电池层4)抑制玉米[81]仅限于毛皮体的生长和发展拟南芥不是烟草属L..,l Esculentum.[82].因此,所有的研究表明多细胞和单细胞毛状体发育过程中存在不同的调节机制。然而,它们之间有特定的关系。例如,棉花毛状体转录因子GaMYB2可以恢复毛状体的表型GL1.突变体拟南芥[63], AnnGh3蛋白从棉花中分离后,促进毛状体伸长拟南芥[64]. 还研究了与多细胞毛细胞相关的其他转录因子。WO(狼)影响了初步发展l . esculentum毛状体(83].黄瓜CsGL1控制毛枝发育[84].此外,可转换元件参与棉纤维细胞发育[85].M6a(内腺苷的位置N6的甲基化)残留物直接由其yth读者容纳。含有Yth结构域的Ect2蛋白在显影过程中解码M6A信号,并通过控制其倍增水平来调节毛状体分支[86那87].SlCycB2过度表达导致导致l . esculentum没有非腺状和腺毛状体的植物[88]. 非编码基因的调节microrna (mirna)是一种内源性非编码小rna,长度约为21个核苷酸,与靶mrna序列高度互补。这些mirna通过在转录后水平上调节其靶基因的表达水平来控制细胞功能的许多方面[89那90.].miRNA通过调节Squamosa启动子结合蛋白的表达等(SPL)来调节毛状体的发育[91.].miR156是一种潜在的移植型传染性miRNA,可调节叶片形态,产生长叶毛状体[92.].在拟南芥,SPLS是花序茎和花器官中培养的滴毛瘤的负稳压因子。这拟南芥SPL基因家族包含17个成员,其中10个被miR156靶向[93.].miR156和SPLs (SPL3/SPL)的表达9.)时间上调[94.那95.].MiR156的表达水平是幼苗中最高的,并且随着植物年龄的下降,而其靶标的表达水平,幼苗在幼苗中低,并且在生殖生长期间逐渐积累。表达模式与茎和花器官上的胎儿的逐渐丧失一致。MiR156的模仿靶的过度表达显着降低了茎粒细胞的密度。在过表达MIR156抗性形式的SPL3,SPL9和SPL10的转基因植物中发现了类似的表型。SPL9,与TCL1的启动子结合并尝试,激活它们的表达并抑制形成毛状体的形成[91.].另外,转基因拟南芥组成型过表达乳头156在茎和花器官上产生异位毛细胞。转基因苜蓿(紫花苜蓿)过表达miR156由于三个靶点表达水平降低,导致毛状体密度增加,开花时间推迟,生物量产量增加:(SPL6,SPL12和SPL13)。我们发现MiR171靶向丢失的商品1(LOM1),LOM2和LOM3也参与了调节SPL活性。通过过表达的MiR171减少LOM丰度导致茎和花器官上的毛状体密度降低。相反,MiR171抗性LOM(RLOM)的组成型表达促进了培养体的培养[96.].最近的研究表明,在MiR319A-OX转基因蛋白中,TCP作为miR319a的靶标的表达水平降低,并显着增加了叶毛细胞的密度。相反,使用短串联靶模具模拟(STTM)抑制miR319a,TCP的转录水平上调并降低培养物密度(表2)[97.]. 表2与植物中滴毛瘤发育相关的microRNA 全尺寸表 激素在毛状体生长和发育中的作用毛状体的分化与其生长位置、生长发育阶段和激素水平密切相关3.).研究表明,吉布林素(GA)[101],cytokinin(ck)[102]水杨酸(SA)[98.]茉莉酸(JA)[103芸苔(Br)和其他激素调节植物毛状体的开始,生长和发育。GA治疗增加了毛泽东体数量拟南芥叶子。GA提高MYB23、GL1、GL3、EGL3的表达水平,抑制TRY、ETC1、ETC2的表达水平[74].分析拟南芥ga1-3,间谍突变体和野生型表明,内源性GA水平和/或信号转导途径的活性正调控毛状体的数量和分支[4.那97.].GA和CK控制毛细血管形成,主要通过C2H2转录因子,例如GIS1,GIS2,锌指蛋白(ZFP)5,ZFP6和ZFP8,其在GL3 / EGL3-GL1-TTG1转录活化剂复合物上游。 表3植物中培养的毛细血管有关的植物激素 全尺寸表CKS促进毛状体形成[45].GA反应抑制剂间谍活动激活CK信号通路拟南芥[104].GA和CK信号传导途径通过整合来控制毛皮组电池命运拟南芥转录因子GIS,ZFP8,GIS2调节GL1表达。该研究表明,ZFP8和GIS2参与CK对培养的调节机制。CKS诱导的GIS2在间谍下游,但在GL1上游。 SA可减少毛状体的形成[97.].这拟南芥心肺复苏突变体溢出Sa显示出低毛状体密度。SA降低了JA对培养体诱导的积极作用,表明JA-和SA依赖性途径之间的负串扰。还有证据表明GA,JA和SA路径之间的互动,以及拟南芥用SA处理表明毛状体密度的1/4降低。在培养体形成的诱导中,GA和JA协同作用,但SA作用于Ga关于毛细胞的密度和数量的影响。外源性JA应用显着增加了毛粒的密度A. Annua.和l . esculentum[105].JA水平的减少(通过OPR3的沉默,在JA的前体的生物合成中的一个关键酶)损害腺体培养l . esculentum[106].jasmonate Zim-域(Jaz)蛋白质与BHLH转录因子(GL3,EGL3和TT8)和MYB转录因子(MYB75和GL1)相互作用,这些因子通过JA降解来调节毛滴度的启动和发育,通过释放WD重复/ bhlh / myb复合体和激活下游因素[99.]. 乙烯增加黄瓜中的毛滴毛瘤[107].增加乙烯合成增强了棉花中培养的枝条的长度[108那109].乙烯受体ETR2通过调节微管的组装来控制毛状体的分支[110].最近的一项研究表明l . esculentumSlIAA15作为生长素依赖性转录的强抑制因子,参与调节毛状体的起始[One hundred.].此外,Br在棉花中的应用增加了棉胚轴中纤维相关基因的表达水平,而BRZ(BR抑制剂)抑制纤维相关的基因表达[111]. 环境因素对培养的影响蒂氏有助于植物处理不同的环境挑战。为了更好地适应环境,胎儿已经发展,以适应复杂和变化的环境,例如盐,温度,光和其他非生物因素[112那113那114].在盐胁迫试验中,薄荷和马郁兰的毛状体大小和密度显著增加[115那116].毛的密度Solanum Habrochaites.受到光周期和温度的影响。在漫长的天然阳光下,毛状体密度增加;密度在20-25℃的温度下增加,低温下降[117].Ning et al.(2016)沿着黄土高原纬度梯度选择两个试验点(由湿向干),观察毛状体形态的变化Caragana Korshinskii.[114].使用扫描电子显微镜观察在减少沉淀下滴注的微现象,并且在减少降水下观察到。证据表明毛状体对低温的结构调整,并从桦树的研究中获得了对冻融的耐受性,霜冻迅速增加腺体滴毛的密度[118].Yan et al.(2012)发现拟南芥uv-b可以刺激毛状体形成[119].来自更高纬度的植物往往更短,较少,较少的分支,较早,花较大,开发较少的毛状体,并在较低纬度的植物产生更高度裂片的叶子[120].表面密度M. Sativa.机械损伤、干旱胁迫或缺水条件下生长的增加[121]. |
【本文地址】