实验 Q&A:如何用慢病毒转染构建稳转细胞系 |
您所在的位置:网站首页 › 慢病毒包装多久换液好 › 实验 Q&A:如何用慢病毒转染构建稳转细胞系 |
实验 Q&A:如何用慢病毒转染构建稳转细胞系
|
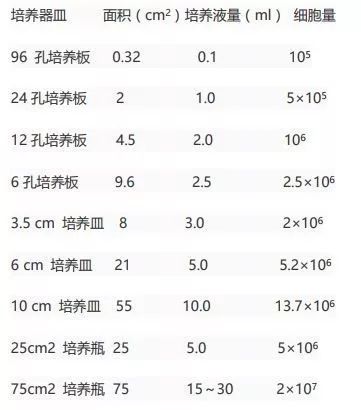
1. 慢病毒转染前 18~24 小时,将贴壁细胞 以 1×10^5(根据细胞大小而定,一般转染前细胞长到 40-60% 为宜)孔铺到 24 孔板中。使细胞在慢病毒转染时的数量为 2×10^5/孔左右。 2.加入 polybrene6-8 ug/ml(这个相当是破膜剂,只有细胞膜破了,病毒才有机会进入细胞内发挥作用),设置合适的病毒浓度梯度,比如 24 孔板,设置 5 个梯度,分别加入病毒量是 0,1,2,3,4,5 ul,37 ℃ 孵育。这时候用的是无血清的培养基培养。 3. 4~6 h 换液 (正常的含血清的新鲜培养基),继续培养,如果慢病毒含有荧光蛋白,一般转染 48 小时后可见明显荧光表达,72 小时后更加明显。用荧光显微镜观察细胞的转染效率,一般病毒量达到一定程度之后就荧光强度就不再增加了。 4. 选择一个合适的病毒量就可以做实验了,如果 3ul 的时候病毒的转染效率已经和后面的没有区别了,在 24 孔板里,合适的病毒量就是 3ul。这时候就可以构建的稳转细胞系了。 5. 当你把实验组对照组转完病毒后 24 h 就可以进行嘌呤筛选,因为病毒转完之后转染效率不可能达到 100%,而慢病毒在构建的时候就含有嘌呤抗性基因,一旦转入细胞,嘌呤抗性基因就能表达嘌呤抗性蛋白,可以抵抗嘌呤对细胞的杀伤作用。有人问了,嘌呤浓度怎么定 (一句话摸浓度,在 24 孔板里,设置不同浓度梯度,48 h 细胞全部杀死的浓度即为你要的嘌呤浓度),一般在 1 ug/ml 左右,所以设定浓度一般在 0~4 ug/ml。 常见问题解答 1. 元元,我病毒转染效率不高怎么办? 答:最简单粗暴的方法是加大病毒量,不好使,那么就得从步骤入手了第一:4~6 h 换液的时间延长,8~10 h,设置过夜试试。还有一种是 4~6 小时换液的时候用的等量的有血清新鲜培养基稀释原有的无血清的培养基,不撤掉病毒,继续培养 24 小时,用新鲜培养基替换含有病毒的培养基。 2. 元元,我着急做实验,我不用 24 孔板,行不行,我用瓶,用平皿行不行? 答:如果你病毒量足够的话,完全可以。那怎么换算呢,根据细胞量或者培养基以及底面积自己算个大概的病毒量就行。
自己换算吧,元元数学不好。 3. 元元,还有个问题是不是扩增倍数越多越好? 答:这个不是的,HIV 病毒是逆转录病毒,会随机插入基因组,扩增倍数越大,说明插入基因组的数量越多,这样基因被损坏的越多,一般文章非编码 6~8 倍左右,编码基因 2~4 倍即可,太多了不好。 4.元元,还有个问题...... 答:今天打烊了。 作者:元元 图片:元元 题图来源:丁香通返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |