专题笔谈|不同微创腔内术式治疗下肢静脉曲张的价值及评价 |
您所在的位置:网站首页 › 微创外科手术的优点 › 专题笔谈|不同微创腔内术式治疗下肢静脉曲张的价值及评价 |
专题笔谈|不同微创腔内术式治疗下肢静脉曲张的价值及评价
|
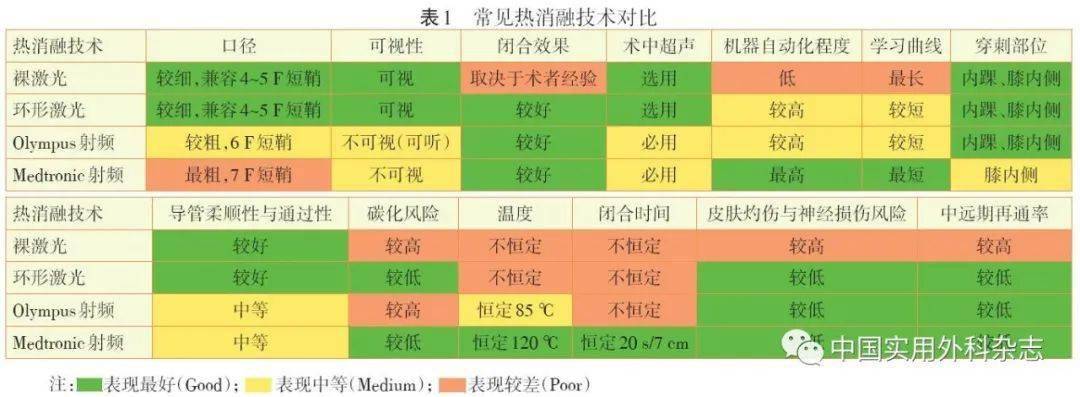
下肢静脉曲张是最常见的血管外科疾病。随着技术和理念进步,微创腔内手术已成为C2期以上治疗的主要方法。但因术式多样、原理不同、适应证不一、临床开展不规范等原因,有时并未达到预期疗效。不同的微创腔内术式各具特点,腔内激光消融术(EVLA)与射频消融(RFA)治疗大隐静脉主干并发症发生率低、中远期闭合率高,获指南推荐首选;硬化剂注射术在静脉属支、穿通支和复发曲张治疗上安全、有效、简捷,具有优势;机械化学腔内消融术(MOCA)因中远期闭合率不及腔内热闭合,国内未得到广泛应用;氰基丙烯酸盐黏合剂栓塞术(CGE)无须肿胀麻醉、操作简单、中远期闭合率高,未来有望成为新选择。在临床应用中,需结合病人需求与各单位实际情况,合理选择单独或不同术式联合治疗。 通信作者:曲乐丰,E-mail:[email protected] 下肢静脉曲张是一种由多种病因引起的下肢慢性静脉功能不全性疾病,以大隐静脉曲张最为多见。欧美西方国家患病率高达25%,国内文献报道约为10%,女性比例略高[1]。发病机制与静脉高压、瓣膜功能不全、静脉壁薄弱或炎症有关。家族遗传、吸烟、雌激素水平过高、久站或久坐、妊娠等均可诱发或加重病情。可表现为肢体肿胀、浅表静脉迂曲扩张、皮肤瘙痒等症状,严重时进一步出现营养性病变(色素沉着、皮炎、溃疡等),甚至并发破裂出血或血栓性浅静脉炎,血栓脱落可诱发肺栓塞。因此,下肢静脉曲张不但影响生活质量,严重情况甚至威胁生命。手术是目前治疗C2期以上的下肢静脉曲张主要方法,随着技术和理念进步,各种以腔内闭合为核心原理的微创术式已广泛应用并成为指南推荐。但由于术式多样、原理不同、适应证不一、临床开展不规范等原因,有时并未达到预期疗效。本文对下肢静脉曲张的常见微创腔内术式作一评述,以期促进其规范和推广。 1 微创腔内术式较开放术式的优势1.1 开放术式的简介与特点 大隐静脉高位结扎+抽剥术是下肢静脉曲张的传统经典术式,包括顺行抽剥、逆行抽剥、顺逆结合抽剥,手术的本质是对病变段静脉进行物理上的结扎、抽剥,从根本上消除大隐静脉瓣膜功能不全引起的反流,也是相对彻底的术式。缺点是手术切口多,创伤大,术后恢复慢,局部血肿和隐神经损伤风险较高。基于血流动力学的保留静脉的门诊局麻手术(CHIVA)指通过术前超声对静脉血流动力学分析,进行保留大隐静脉主干的血流改道手术。该术式对传统术式的破坏性、废弃性有了一定减轻,但对术者超声下血流动力学评估水平的要求较高、学习曲线较长,术后复发率也明显高于其他术式。国外大型研究结果显示,CHIVA病人术后2年的再手术率可达37.7%[2]。 1.2 微创腔内术式的简介与特点 微创腔内术式主要原理是,通过物理或化学的方式,使目标静脉壁内皮坏死黏连,最终机化、纤维化达到闭合血管的作用。根据作用机制可分为两大类:热消融技术和非热消融技术。热消融技术指通过激光、射频、蒸汽等物理方式在静脉腔内释放热量,以热效应损伤静脉内皮、闭合血管,目前一线治疗方式包括腔内激光消融术(endovenous laser ablation,EVLA)和射频消融术(radiofrequency ablation,RFA)。非热消融技术则采用非热能的化学或物理方式腔内闭合静脉,包括硬化剂注射术(sclerotherapy)、机械化学腔内消融术(mechanochemical endovenous ablation,MOCA)和氰基丙烯酸盐黏合剂栓塞术(cyanoacrylate glue embolization,CGE)。与传统手术相比,微创腔内术式由于无须行皮肤切口抽剥静脉,具有技术操作简捷、无须全身麻醉、微创美容、手术时间短、恢复快等优势,且中远期闭合率与传统抽剥术相当。 1.1 开放术式的简介与特点 大隐静脉高位结扎+抽剥术是下肢静脉曲张的传统经典术式,包括顺行抽剥、逆行抽剥、顺逆结合抽剥,手术的本质是对病变段静脉进行物理上的结扎、抽剥,从根本上消除大隐静脉瓣膜功能不全引起的反流,也是相对彻底的术式。缺点是手术切口多,创伤大,术后恢复慢,局部血肿和隐神经损伤风险较高。基于血流动力学的保留静脉的门诊局麻手术(CHIVA)指通过术前超声对静脉血流动力学分析,进行保留大隐静脉主干的血流改道手术。该术式对传统术式的破坏性、废弃性有了一定减轻,但对术者超声下血流动力学评估水平的要求较高、学习曲线较长,术后复发率也明显高于其他术式。国外大型研究结果显示,CHIVA病人术后2年的再手术率可达37.7%[2]。 1.2 微创腔内术式的简介与特点 微创腔内术式主要原理是,通过物理或化学的方式,使目标静脉壁内皮坏死黏连,最终机化、纤维化达到闭合血管的作用。根据作用机制可分为两大类:热消融技术和非热消融技术。热消融技术指通过激光、射频、蒸汽等物理方式在静脉腔内释放热量,以热效应损伤静脉内皮、闭合血管,目前一线治疗方式包括腔内激光消融术(endovenous laser ablation,EVLA)和射频消融术(radiofrequency ablation,RFA)。非热消融技术则采用非热能的化学或物理方式腔内闭合静脉,包括硬化剂注射术(sclerotherapy)、机械化学腔内消融术(mechanochemical endovenous ablation,MOCA)和氰基丙烯酸盐黏合剂栓塞术(cyanoacrylate glue embolization,CGE)。与传统手术相比,微创腔内术式由于无须行皮肤切口抽剥静脉,具有技术操作简捷、无须全身麻醉、微创美容、手术时间短、恢复快等优势,且中远期闭合率与传统抽剥术相当。 2 热消融技术EVLA和RFA为代表的热消融技术已被美国血管外科学会/美国静脉论坛和英国国家健康中心列为下肢静脉曲张的一线推荐方案[3-4],两种手术方式也是我国目前临床应用最广的腔内微创术式。 2.1 EVLA EVLA的原理是通过激光光纤的光热作用,将光能转化为热量,最终导致静脉内皮热损伤,胶原皱缩,最终纤维化闭塞。因不同波长的热量作用于不同目标,各波长的激光副反应风险不一:短波长(810/940/980 nm)激光产生的能量主要被血液中的血红蛋白吸收,容易引起血管碳化发生热损伤;而长波长(1470 nm)激光能透过血液直接被血管壁上的水分子吸收,不易碳化。此外,光纤的设计也与闭合效果和副反应有关:早期裸光纤为“点发热-线闭合”形式热消融,由于静脉受热不均匀,加之能量输出功率较高,不但闭合效果不佳,且易引起热损伤。新型单环、双环甚至多环光纤为“环发热-面闭合”形式热消融,静脉受热均匀,不但在保证闭合效果的基础上降低了能量输出功率,更降低了热损伤风险。在EVLA(包括RFA)术中,为了避免皮下组织和皮肤的热损伤,往往需在血管走行的深浅筋膜间隙注射肿胀麻醉液作为配合,起到局部镇痛、充分压闭管腔和保护周围组织的目的。在治疗的靶血管上,EVLA不但适用于大隐及小隐静脉主干,对走行相对较直的属支和穿通支同样适用。在小腿浅静脉及属支的闭合中应注意调低功率并充分肿胀麻醉,避免神经损伤和皮肤灼伤。 2.2 RFA RFA的原理是通过射频发生器产生的高频振动和离子碰撞产生热量,并通过专用的导管传递至血管壁,造成接触的静脉内皮损伤、静脉内膜胶原纤维收缩,直至血管闭合并最终纤维化。与EVLA相比,RFA导管为头端的一段范围内加热并维持恒温,并在仪器中设定了恒定闭合时间,静脉受热更加均匀可控,副反应较少;但是射频导管较激光光纤相比,直径更粗,通过性稍差,需要植入7 F鞘管辅助或静脉切开(EVLA仅需4~5 F鞘管);在术中操作上,RFA须全程血管超声监视下进行,学习曲线和掌握难度高于EVLA。在适应证上,RFA仅适用于大隐及小隐静脉近端主干闭合,穿通支闭合需要换用专用的射频闭合导管,曲张静脉的远端主干及属支均须配合点状抽剥或泡沫硬化剂等其他术式另行处理。 2.3 临床研究结果 一项EVLA、RFA与抽剥术的多中心随机临床对照研究结果显示,术后5年的复发率EVLA组、RFA组和传统抽剥术组分别为6.8%、5.8%和6.3%,三者差异均无统计学意义(P>0.05)[5],证实在中远期疗效上,二者与传统抽剥术相当。Meta分析结果显示,热消融技术的潜在并发症包括血栓性浅静脉炎(7%),皮肤色素沉着(5%),感觉异常(1%~2%),血肿(0~7%),术后疼痛、皮肤灼伤和皮神经损伤(<1%),热效应导致的深静脉血栓形成的发生率约为1%[6],说明EVLA与RFA的并发症发生率均较低。此外,多项有关EVLA、RFA和抽剥术的随机临床对照显示,两种热消融术式均可显著缩短恢复时间、并在术后生活质量评分显著高于传统抽剥组[7-8]。 2.4 特点评价 作为临床最常用的两类热消融技术,EVLA和RFA的共同优势在于技术成熟、操作简单、微创美观、局麻即可、住院时间短、康复恢复快。然而,该类技术要求在静脉周围使用麻醉肿胀液以麻醉并保护周围组织免受热损伤,肿胀液给药需要沿隐静脉多次注射,可能导致术中和术后热损伤以及血肿、瘀斑等不良事件。笔者结合文献与临床实践经验,总结了国内临床常用的EVLA和RFA产品特点:口径方面,激光光纤较射频导管更细,可以兼容直径更小的鞘管;柔顺性和通过性对比方面,激光光纤由于直径较细,表现稍优于射频导管;可视性方面,EVLA的光纤由于头端可以发光,可做到术中肉眼直视定位,而RFA的导管无法肉眼可视,需要术中超声引导和定位;闭合效果方面,除裸激光取决于术者经验外,其余均表现较好;其余指标详见表1。
EVLA和RFA为代表的热消融技术已被美国血管外科学会/美国静脉论坛和英国国家健康中心列为下肢静脉曲张的一线推荐方案[3-4],两种手术方式也是我国目前临床应用最广的腔内微创术式。 2.1 EVLA EVLA的原理是通过激光光纤的光热作用,将光能转化为热量,最终导致静脉内皮热损伤,胶原皱缩,最终纤维化闭塞。因不同波长的热量作用于不同目标,各波长的激光副反应风险不一:短波长(810/940/980 nm)激光产生的能量主要被血液中的血红蛋白吸收,容易引起血管碳化发生热损伤;而长波长(1470 nm)激光能透过血液直接被血管壁上的水分子吸收,不易碳化。此外,光纤的设计也与闭合效果和副反应有关:早期裸光纤为“点发热-线闭合”形式热消融,由于静脉受热不均匀,加之能量输出功率较高,不但闭合效果不佳,且易引起热损伤。新型单环、双环甚至多环光纤为“环发热-面闭合”形式热消融,静脉受热均匀,不但在保证闭合效果的基础上降低了能量输出功率,更降低了热损伤风险。在EVLA(包括RFA)术中,为了避免皮下组织和皮肤的热损伤,往往需在血管走行的深浅筋膜间隙注射肿胀麻醉液作为配合,起到局部镇痛、充分压闭管腔和保护周围组织的目的。在治疗的靶血管上,EVLA不但适用于大隐及小隐静脉主干,对走行相对较直的属支和穿通支同样适用。在小腿浅静脉及属支的闭合中应注意调低功率并充分肿胀麻醉,避免神经损伤和皮肤灼伤。 2.2 RFA RFA的原理是通过射频发生器产生的高频振动和离子碰撞产生热量,并通过专用的导管传递至血管壁,造成接触的静脉内皮损伤、静脉内膜胶原纤维收缩,直至血管闭合并最终纤维化。与EVLA相比,RFA导管为头端的一段范围内加热并维持恒温,并在仪器中设定了恒定闭合时间,静脉受热更加均匀可控,副反应较少;但是射频导管较激光光纤相比,直径更粗,通过性稍差,需要植入7 F鞘管辅助或静脉切开(EVLA仅需4~5 F鞘管);在术中操作上,RFA须全程血管超声监视下进行,学习曲线和掌握难度高于EVLA。在适应证上,RFA仅适用于大隐及小隐静脉近端主干闭合,穿通支闭合需要换用专用的射频闭合导管,曲张静脉的远端主干及属支均须配合点状抽剥或泡沫硬化剂等其他术式另行处理。 2.3 临床研究结果 一项EVLA、RFA与抽剥术的多中心随机临床对照研究结果显示,术后5年的复发率EVLA组、RFA组和传统抽剥术组分别为6.8%、5.8%和6.3%,三者差异均无统计学意义(P>0.05)[5],证实在中远期疗效上,二者与传统抽剥术相当。Meta分析结果显示,热消融技术的潜在并发症包括血栓性浅静脉炎(7%),皮肤色素沉着(5%),感觉异常(1%~2%),血肿(0~7%),术后疼痛、皮肤灼伤和皮神经损伤(<1%),热效应导致的深静脉血栓形成的发生率约为1%[6],说明EVLA与RFA的并发症发生率均较低。此外,多项有关EVLA、RFA和抽剥术的随机临床对照显示,两种热消融术式均可显著缩短恢复时间、并在术后生活质量评分显著高于传统抽剥组[7-8]。 2.4 特点评价 作为临床最常用的两类热消融技术,EVLA和RFA的共同优势在于技术成熟、操作简单、微创美观、局麻即可、住院时间短、康复恢复快。然而,该类技术要求在静脉周围使用麻醉肿胀液以麻醉并保护周围组织免受热损伤,肿胀液给药需要沿隐静脉多次注射,可能导致术中和术后热损伤以及血肿、瘀斑等不良事件。笔者结合文献与临床实践经验,总结了国内临床常用的EVLA和RFA产品特点:口径方面,激光光纤较射频导管更细,可以兼容直径更小的鞘管;柔顺性和通过性对比方面,激光光纤由于直径较细,表现稍优于射频导管;可视性方面,EVLA的光纤由于头端可以发光,可做到术中肉眼直视定位,而RFA的导管无法肉眼可视,需要术中超声引导和定位;闭合效果方面,除裸激光取决于术者经验外,其余均表现较好;其余指标详见表1。
为避免热消融的潜在并发症,非热、无肿胀的腔内技术逐渐成为进一步减少下肢静脉曲张创伤和并发症的术式选择。主要包括硬化剂注射术、机械化学腔内消融术和氰基丙烯酸盐黏合剂栓塞术。 3.1 硬化剂注射术 硬化剂注射术的原理是向静脉内注射化学制剂,通过化学作用破坏静脉内皮,导致静脉内膜黏连纤维化,在局部压迫辅助下最终闭合。硬化剂可分为两类:(1)泡沫硬化剂,又称表面活化剂或去污剂。该类物质以聚多卡醇为代表,具有较小剂量、较大血管内膜接触面积、较长接触时间的优点,已成为临床主流。(2)化学刺激剂或高渗溶液,均为液体硬化剂,由于不良反应较多,目前已退出一线应用。 硬化剂注射术治疗静脉曲张既往被认为是不成功的,直到泡沫硬化剂的问世,才作为单独的治疗方法被学界认可。超声引导下泡沫硬化剂注射(ultra-sound-guided foam sclerotherapy,UGFS)是临床常用的大隐静脉主干闭合方法,在超声引导下,将泡沫硬化剂注射至隐股静脉汇合处(saphenous-femoral vein junction,SFJ)以下的水平,起到闭合大隐静脉主干的作用。此外,硬化剂注射术也适用于毛细血管、网状静脉扩张和小静脉曲张以及非隐静脉主干的属支曲张静脉,以及术后残留的曲张静脉处置[9]。绝对禁忌证包括硬化剂过敏、胶原性疾病史、近期有血栓形成及肺栓塞病史,伴有局部或全身性感染、卧床制动病人、下肢严重缺血病人。 UGFS在不同文献的大隐静脉主干闭合率报道存在差异,术后1年闭合率为65%~81%,不少学者认为UGFS效果不及传统开放手术及EVLA、RFA等腔内热消融技术[10-11]。但硬化剂注射术操作简便易行,相关并发症率低,尤其在改善病人临床症状上有显著优势:一项针对美国新上市的预置型泡沫硬化剂VarithenaTM用于治疗非大隐静脉主干的静脉属支研究结果证实,泡沫硬化剂组在临床症状相关VVSymQ评分改善率为77.7%,显著高于对照组13.3%;而深静脉血栓形成、神经并发症和过敏反应等副反应发生率较低[12]。 3.2 MOCA MOCA的原理是通过在静脉腔内高速旋转钢丝后,再注射硬化剂,达到使用机械和化学双重破坏静脉内皮、促进纤维化闭合的效果。以临床常见的Merit 公司ClariVein 导管系统为例,在血管彩超引导下将导管头端输送至SFJ下端0.5 cm处后,高速旋转导丝3~5 s,使静脉痉挛同时部分破坏血管壁,再注射液体硬化剂。再以每秒 6~7 cm的速度后撤导管,使大隐静脉全程闭合。该技术主要用于大隐静脉主干的闭合,不推荐于属支及穿通支静脉的处理。MOCA的潜在并发症包括:浅表性血栓性静脉炎,血肿,穿刺部位轻度色素沉着,以及针头旋转引起病人不适,整体发生率较低[13]。 一项针对MOCA和RFA的随机临床对照研究结果显示,MOCA在术后14 d的疼痛评分上表现优于RFA,术后30 d生活质量评分两组未见差异,术后2年的解剖学闭合率上,MOCA组和RFA组分别为80.0%和88.3%,MOCA组较低,但差异无统计学意义(P=0.06)[14]。另一项针对MOCA和EVLA的随机临床对照研究结果显示,术后疼痛评分上两组均较低,术后1年解剖闭合率上,MOCA组为77%,显著低于EVLA组91%(P=0.02),在静脉曲张临床严重程度评分(Venous clinical severity score,VCSS)和阿伯丁生活质量评分上,两组均显著提升,但组间差异无统计学意义[15]。可见MOCA较RFA、EVLA相比,在改善临床症状和生活质量方面表现良好,但中远期闭合率不如RFA和EVLA。 3.3 CGE 氰基丙烯酸盐黏合剂属于化学组织黏合剂,结构式为NC-C=CH2COOR,-CN和-COOR是具有诱导效应的极性基团,室温下即可在遇到血液等阴离子或有机胺类物质后迅速聚合,发挥黏合栓塞作用。该技术在血管外科领域最早用于食管胃底静脉曲张出血、颅内出血和动静脉畸形出血的止血治疗,近5年逐渐应用于下肢静脉曲张治疗。目前已有多个氰基丙烯酸盐黏合剂闭合装置和技术的研究报道(VenaSeal、VenaBlock、VariClose等系统),均遵循相同的技术原理,仅在黏合剂的黏度、配比和聚合时间上存在差异。以VariClose系统为例,以病变段大隐静脉最低点穿刺并置5 F鞘管,引入4F治疗导管至SFJ以远3 cm处,取头低脚高位,每5 s按动1次扳机释放0.3 mL黏合剂,以10 cm/s的速度回拉导管,直至闭合静脉。即以每10 cm静脉为1个单位进行操作,最终每厘米静脉使用0.03 mL黏合剂。释放黏合剂的同时,需根据所使用黏合剂的聚合时间使用超声探头予以相应时间的加压。术中需全程超声监视下完成,若发现存在未闭合段静脉,可单独穿刺注射黏合剂。术中为保留一定血液以激活聚合反应,各文献报道均未在设置体位后进行患肢驱血。此外,由于CGE几乎无皮下渗血且黏合作用即刻发生,因此,术后无须佩戴弹力袜辅助治疗。 欧洲多中心研究结果发现,CGE术后1年大隐静脉主干闭合率达92.9%,VCSS和阿伯丁生活质量评分显著改善,副反应仅限于静脉炎(11.4%)和单纯疼痛(8.6%),对症处理后静脉炎于7 d痊愈、疼痛于1 d后消失[16]。在与RFA的多中心随机临床对照研究中,术后36个月大隐静脉主干闭合率在CGE和RFA组分别为94.4%和91.9%,两组在VCSS和阿伯丁生活质量评分上均显著改善,不良事件发生率相似。可见CGE在下肢静脉曲张的手术治疗被证明是安全、有效的[17]。 3.4 特点评价 非热消融技术,由于无须肿胀麻醉,更契合未来静脉曲张微创腔内手术的发展方向。具有学习曲线短、操作简单、手术时间短、病人损伤小、恢复正常生活快的优势。但是仍存在潜在问题:(1)硬化剂注射术在大隐静脉主干中远期闭合效果欠佳,更多适用于毛细血管、网状静脉扩张和属支曲张静脉的治疗。(2)MOCA操作相对复杂繁琐,同时大隐静脉主干中远期闭合效果欠佳,也不适用于属支及穿通支静脉的治疗。(3)CGE与其他微创术式相比技术最新,兼具操作便利性、生活质量改善性和中期疗效确切性,但目前国外临床研究开展较少,国内尚属空白,尚待有关中远期远期疗效与安全性的大样本随访报道。 为避免热消融的潜在并发症,非热、无肿胀的腔内技术逐渐成为进一步减少下肢静脉曲张创伤和并发症的术式选择。主要包括硬化剂注射术、机械化学腔内消融术和氰基丙烯酸盐黏合剂栓塞术。 3.1 硬化剂注射术 硬化剂注射术的原理是向静脉内注射化学制剂,通过化学作用破坏静脉内皮,导致静脉内膜黏连纤维化,在局部压迫辅助下最终闭合。硬化剂可分为两类:(1)泡沫硬化剂,又称表面活化剂或去污剂。该类物质以聚多卡醇为代表,具有较小剂量、较大血管内膜接触面积、较长接触时间的优点,已成为临床主流。(2)化学刺激剂或高渗溶液,均为液体硬化剂,由于不良反应较多,目前已退出一线应用。 硬化剂注射术治疗静脉曲张既往被认为是不成功的,直到泡沫硬化剂的问世,才作为单独的治疗方法被学界认可。超声引导下泡沫硬化剂注射(ultra-sound-guided foam sclerotherapy,UGFS)是临床常用的大隐静脉主干闭合方法,在超声引导下,将泡沫硬化剂注射至隐股静脉汇合处(saphenous-femoral vein junction,SFJ)以下的水平,起到闭合大隐静脉主干的作用。此外,硬化剂注射术也适用于毛细血管、网状静脉扩张和小静脉曲张以及非隐静脉主干的属支曲张静脉,以及术后残留的曲张静脉处置[9]。绝对禁忌证包括硬化剂过敏、胶原性疾病史、近期有血栓形成及肺栓塞病史,伴有局部或全身性感染、卧床制动病人、下肢严重缺血病人。 UGFS在不同文献的大隐静脉主干闭合率报道存在差异,术后1年闭合率为65%~81%,不少学者认为UGFS效果不及传统开放手术及EVLA、RFA等腔内热消融技术[10-11]。但硬化剂注射术操作简便易行,相关并发症率低,尤其在改善病人临床症状上有显著优势:一项针对美国新上市的预置型泡沫硬化剂VarithenaTM用于治疗非大隐静脉主干的静脉属支研究结果证实,泡沫硬化剂组在临床症状相关VVSymQ评分改善率为77.7%,显著高于对照组13.3%;而深静脉血栓形成、神经并发症和过敏反应等副反应发生率较低[12]。 3.2 MOCA MOCA的原理是通过在静脉腔内高速旋转钢丝后,再注射硬化剂,达到使用机械和化学双重破坏静脉内皮、促进纤维化闭合的效果。以临床常见的Merit 公司ClariVein 导管系统为例,在血管彩超引导下将导管头端输送至SFJ下端0.5 cm处后,高速旋转导丝3~5 s,使静脉痉挛同时部分破坏血管壁,再注射液体硬化剂。再以每秒 6~7 cm的速度后撤导管,使大隐静脉全程闭合。该技术主要用于大隐静脉主干的闭合,不推荐于属支及穿通支静脉的处理。MOCA的潜在并发症包括:浅表性血栓性静脉炎,血肿,穿刺部位轻度色素沉着,以及针头旋转引起病人不适,整体发生率较低[13]。 一项针对MOCA和RFA的随机临床对照研究结果显示,MOCA在术后14 d的疼痛评分上表现优于RFA,术后30 d生活质量评分两组未见差异,术后2年的解剖学闭合率上,MOCA组和RFA组分别为80.0%和88.3%,MOCA组较低,但差异无统计学意义(P=0.06)[14]。另一项针对MOCA和EVLA的随机临床对照研究结果显示,术后疼痛评分上两组均较低,术后1年解剖闭合率上,MOCA组为77%,显著低于EVLA组91%(P=0.02),在静脉曲张临床严重程度评分(Venous clinical severity score,VCSS)和阿伯丁生活质量评分上,两组均显著提升,但组间差异无统计学意义[15]。可见MOCA较RFA、EVLA相比,在改善临床症状和生活质量方面表现良好,但中远期闭合率不如RFA和EVLA。 3.3 CGE 氰基丙烯酸盐黏合剂属于化学组织黏合剂,结构式为NC-C=CH2COOR,-CN和-COOR是具有诱导效应的极性基团,室温下即可在遇到血液等阴离子或有机胺类物质后迅速聚合,发挥黏合栓塞作用。该技术在血管外科领域最早用于食管胃底静脉曲张出血、颅内出血和动静脉畸形出血的止血治疗,近5年逐渐应用于下肢静脉曲张治疗。目前已有多个氰基丙烯酸盐黏合剂闭合装置和技术的研究报道(VenaSeal、VenaBlock、VariClose等系统),均遵循相同的技术原理,仅在黏合剂的黏度、配比和聚合时间上存在差异。以VariClose系统为例,以病变段大隐静脉最低点穿刺并置5 F鞘管,引入4F治疗导管至SFJ以远3 cm处,取头低脚高位,每5 s按动1次扳机释放0.3 mL黏合剂,以10 cm/s的速度回拉导管,直至闭合静脉。即以每10 cm静脉为1个单位进行操作,最终每厘米静脉使用0.03 mL黏合剂。释放黏合剂的同时,需根据所使用黏合剂的聚合时间使用超声探头予以相应时间的加压。术中需全程超声监视下完成,若发现存在未闭合段静脉,可单独穿刺注射黏合剂。术中为保留一定血液以激活聚合反应,各文献报道均未在设置体位后进行患肢驱血。此外,由于CGE几乎无皮下渗血且黏合作用即刻发生,因此,术后无须佩戴弹力袜辅助治疗。 欧洲多中心研究结果发现,CGE术后1年大隐静脉主干闭合率达92.9%,VCSS和阿伯丁生活质量评分显著改善,副反应仅限于静脉炎(11.4%)和单纯疼痛(8.6%),对症处理后静脉炎于7 d痊愈、疼痛于1 d后消失[16]。在与RFA的多中心随机临床对照研究中,术后36个月大隐静脉主干闭合率在CGE和RFA组分别为94.4%和91.9%,两组在VCSS和阿伯丁生活质量评分上均显著改善,不良事件发生率相似。可见CGE在下肢静脉曲张的手术治疗被证明是安全、有效的[17]。 3.4 特点评价 非热消融技术,由于无须肿胀麻醉,更契合未来静脉曲张微创腔内手术的发展方向。具有学习曲线短、操作简单、手术时间短、病人损伤小、恢复正常生活快的优势。但是仍存在潜在问题:(1)硬化剂注射术在大隐静脉主干中远期闭合效果欠佳,更多适用于毛细血管、网状静脉扩张和属支曲张静脉的治疗。(2)MOCA操作相对复杂繁琐,同时大隐静脉主干中远期闭合效果欠佳,也不适用于属支及穿通支静脉的治疗。(3)CGE与其他微创术式相比技术最新,兼具操作便利性、生活质量改善性和中期疗效确切性,但目前国外临床研究开展较少,国内尚属空白,尚待有关中远期远期疗效与安全性的大样本随访报道。 4 结语对于下肢静脉曲张病人,无论程度及是否手术,均应采取减肥、戒烟、避免久站久坐等生活习惯的改变,并在必要时辅以压力和药物治疗。对于保守治疗不佳的C2以上静脉曲张病人,应进行手术治疗。尽管开放手术也在向微创化改良,但腔内手术已成为国内外指南公认的发展方向。不同的微创腔内术式各具特点,在大隐静脉主干治疗上,EVLA与RFA疗效确切、并发症发生率低、中远期闭合率高;在属支、穿通支和复发静脉曲张治疗上,硬化剂注射术因安全、有效、简捷,更受推崇;MOCA因中远期主干闭合率不及腔内热闭合治疗,国内未得到广泛应用;CGE因无须肿胀麻醉、操作简单、中远期闭合率高,可显著改善病人生活质量和临床症状,未来有望成为微创腔内治疗的新选择。在临床应用中,需结合病人需求与各单位实际情况,合理选择单独术式或不同术式联合治疗。 对于下肢静脉曲张病人,无论程度及是否手术,均应采取减肥、戒烟、避免久站久坐等生活习惯的改变,并在必要时辅以压力和药物治疗。对于保守治疗不佳的C2以上静脉曲张病人,应进行手术治疗。尽管开放手术也在向微创化改良,但腔内手术已成为国内外指南公认的发展方向。不同的微创腔内术式各具特点,在大隐静脉主干治疗上,EVLA与RFA疗效确切、并发症发生率低、中远期闭合率高;在属支、穿通支和复发静脉曲张治疗上,硬化剂注射术因安全、有效、简捷,更受推崇;MOCA因中远期主干闭合率不及腔内热闭合治疗,国内未得到广泛应用;CGE因无须肿胀麻醉、操作简单、中远期闭合率高,可显著改善病人生活质量和临床症状,未来有望成为微创腔内治疗的新选择。在临床应用中,需结合病人需求与各单位实际情况,合理选择单独术式或不同术式联合治疗。 参考文献 (在框内滑动手指即可浏览) [1] 黄晟,陆信武.慢性静脉功能不全规范化治疗争议与共识[J].中国实用外科杂志,2017,37(12):1358-1361. [2] Rasmussen L,Lawaetz M,Bjoern L,et al.Randomized clinical trial comparing endovenous laser ablation and stripping of the great saphenous vein with clinical and duplex outcome after 5 years[J].J Vasc Surg,2013,58(2):421-426. [3] Bootun R,Davies AH.Long-term follow-up for different varicose vein therapies: is surgery still the best?[J].Phlebology,2016,31(suppl):125-129. [4] Gloviczki P,Comerota AJ,Dalsing MC,et al.The care of patients with varicose veins and associated chronic venous diseases: clinical practice guidelines of the Society for Vascular Surgery and the American Venous Forum[J].J Vasc Surg,2011,53(suppl5):2. [5] Lawaetz M,Serup J,Lawaetz B,et al.Comparison of endovenous ablation techniques, foam sclerotherapy and surgical stripping for great saphenous varicose veins. Extended 5-year follow-up of a RCT[J].Int Angiol,2017,36(3):281-288. [6] Agrawal S,Saber W. Venous ablation [J]. Interv Cardiol Clin, 2020,9(2):255-263. [7] Kilic HE,Bektas N,Bitargil M,et al.Long-term outcomes of endovenous laser ablation, n-butyl cyanoacrylate and radiofrequency ablation in the treatment of chronic venous insufficiency[J].J Vasc Surg Venous Lymphat Disord,2021 Oct 21;S2213-333X(21)00515-1. doi: 10.1016/j.jvsv.2021.10.009. Online ahead of print. [9] Bi M,Li D,Chen Z,et al.Foam sclerotherapy compared with liquid sclerotherapy for the treatment of lower extremity varicose veins: A protocol for systematic review and meta analysis[J].Medicine (Baltimore),2020,99(22):e20332. [10] Farah MH,Nayfeh T,Urtecho M,et al.A systematic review supporting the Society for Vascular Surgery, the American Venous Forum, and the American Vein and Lymphatic Society guidelines on the management of varicose veins[J].J Vasc Surg Venous Lymphat Disord,2021 Aug 24;S2213-333X(21)00421-2. doi: 10.1016/j.jvsv.2021.08.011. Online ahead of print. [12] Star P,Connor DE,Parsi K.Novel developments in foam sclerotherapy: Focus on Varithena® (polidocanol endovenous microfoam) in the management of varicose veins[J].Phlebology,2018,33(3):150-162. [13] Elias S,Raines JK.Mechanochemical tumescentless endovenous ablation: final results of the initial clinical trial[J].Phlebology,2012,27(2):67-72. [14] Holewijn S,van Eekeren RRJP,Vahl A,et al.Two-year results of a multicenter randomized controlled trial comparing Mechanochemical endovenous Ablation to RADiOfrequeNcy Ablation in the treatment of primary great saphenous vein incompetence (MARADONA trial)[J].J Vasc Surg Venous Lymphat Disord,2019,7(3):364-374. [15] Mohamed AH,Leung C,Wallace T,et al.A randomized controlled trial of endovenous laser ablation versus mechanochemical ablation with clarivein in the management of superficial venous incompetence (LAMA trial)[J].Ann Surg,2021,273(6):e188-e195. [16] Proebstle TM,Alm J,Dimitri S,et al.The European multicenter cohort study on cyanoacrylate embolization of refluxing great saphenous veins[J].J Vasc Surg Venous Lymphat Disord,2015,3(1):2-7. [17] Morrison N,Kolluri R,Vasquez M,et al.Comparison of cyanoacrylate closure and radiofrequency ablation for the treatment of incompetent great saphenous veins: 36-Month outcomes of the VeClose randomized controlled trial[J].Phlebology,2019,34(6):380-390. (2021-11-01收稿) 版权声明 本文为《中国实用外科杂志》原创文章。其他媒体、网站、公众号等如需转载本文,请联系本刊编辑部获得授权,并在文题下醒目位置注明“原文刊发于《中国实用外科杂志》,卷(期):起止页码”。谢谢合作! 点击 阅读原文 即刻体验中国实用外科杂志APP 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |