哦豁!一眼就看穿的影像组学套路,是什么能让它在今年4月发到2区? |
您所在的位置:网站首页 › 影像学是做什么的 › 哦豁!一眼就看穿的影像组学套路,是什么能让它在今年4月发到2区? |
哦豁!一眼就看穿的影像组学套路,是什么能让它在今年4月发到2区?
|
回答:传统的多模态指融合了CT、MRI、超声、PET等多种影像学技术的玩法,而现在的多模态也可表示单种影像设备中整合多个成像技术的方式。多模态MRI指多个MRI序列的联合,比如在常规序列基础上整合DWI,DKI, PWI等功能序列; 多模态CT包括平扫CT、增强CT、CT血管成像(CTA)和CT灌注成像(CTP)等;多模态超声包括有普通二维超声、弹性成像等。 提问:什么是多靶区? 回答:多靶区是指对不同的区域进行研究。比如胶质瘤的相关研究中经常可见这样子的表述:整个肿瘤区域、其子区域(亚区域,subregion)有非强化肿瘤区域(平扫、增强的T1WI,联合来看)、瘤周水肿区域(T2WI、T2WI-FLAIR联合来看)和强化肿瘤区域(平扫、增强的T1WI,联合来看)。 也就是说, 多靶区的研究有时候也是需要通过多模态的来实现的。此外就是对 瘤周区域的研究,比如放疗靶区勾画的 GTV(GrossTumorVolume:肿瘤靶区 = 原发灶+转移灶)、 CTV(Clinical Target Volume:临床靶区 = GTV+亚临床病变区/肿瘤可能侵犯的区域)、 PTV(Planning Target Volume:计划靶区 = CTV+摆位误差+器官运动)等。 鑫仔说: 多模态或者多靶区的本质就是增加自变量的方式,但这种的增加不是无意义的堆砌,比如多模态,不同的序列,均有自己独特的成像原理,反映的是多维度的肿瘤背后的参数与性质; 同样,多靶区,比如肿瘤区、瘤周区域、亚临床病灶区等,均可获得不同的肿瘤相关的信息,科学价值还是拉满的。 由于结合临床因素在之前的单单单组合已经为大家渗透过了。而多模态的影像组学文章我们在第一期为大家解析过,所以鑫仔挑选了一篇多模态+多靶区的文章,为大家解读。双倍套路,十倍快乐,轻松上二区不是梦! 本期鑫仔为大家带来一篇2022年4月发表于European Radiology(IF = 5.315)多模态影像组学文章,题目是 “Multiparametricmagnetic resonance imaging‑derived radiomics for the predictionof disease‑free survival in early‑stage squamous cervical cancer”。 本文开发基于多靶区的多模态MRI的影像组学特征,用于预测早期宫颈鳞状细胞癌(ESSCC)的无病生存期(DFS)模型。 而本文对比之前类似研究的亮点也就在采用了DWI序列和ADC系数(多模态)和对瘤周的影像组学特征进行了提取(多靶区)。 值得注意,这是欧放杂志!影像口的大哥大杂志之一!与Radiology一起,业内标杆,口碑之选,要发一篇并不容易,行业认可度极高。 小注:表观扩散系数ADC 描述磁共振扩散加权成像中不同水分子扩散运动速度和范围的参数,是DWI序列的衍生系数。
1 核心要素 研究对象(P):接受双侧盆腔淋巴结清扫术的根治性子宫切除术的早期宫颈鳞状细胞癌(ESSCC)患者(191例纳入) 预后模型(I/C):Logistic回归模型构建的影像组学signature;通常我们的模型都是Cox回归模型构建的,这里是Logistic回归,有没有什么猫腻,我们后面揭晓; 结局指标(O):无病生存期DFS 研究类型(S):回顾性队列研究,预后预测类型 研究目的:开发基于多靶区的多模态MRI的影像组学特征,用于预测早期宫颈鳞状细胞癌(ESSCC)的无病生存期(DFS)模型 鑫仔说: 这里我们还是来看一下本文对DFS的定义:从手术日期到首次局部区域复发、远处转移或最后一次随访日期的时间。局部复发和远处转移通过妇科检查和CT、MRI、PET-CT等影像诊断或病理证实(ref:PMID: 30638582& PMID: 28756904)。 两篇柳叶刀撑腰,还是比较规范的。 2 变量分析 预测变量(X):影像组学signature(瘤内+瘤周) 结局变量(Y):2年DFS 协变量(Z):年龄、血常规检查(红细胞、中性粒细胞、血小板)、人乳头瘤病毒(HPV) 状态和血清妇科肿瘤标志物(CEA、CA125、CA199和鳞状细胞癌抗原 (SCCA));肿瘤分化、淋巴结转移、浸润深度、淋巴管浸润LVI、FIGO 分期 3 研究背景 双侧盆腔淋巴结清扫的根治性子宫切除术是ESSCC 治疗的最有效手段。尽管进行了治愈性治疗,但25-30% 的 ESSCC 患者会出现局部复发或远处转移。因此,准确的预后预测对于选择最佳手术方案、术后辅助治疗和术后观察强度至关重要。 目前临床上采用的FIGO分期准确性会受到医生经验的影响。而且,病理特征只能通过侵入性方法获得,容易受到抽样误差和观察者间变异性的影响。 小张点评: 这段内容很值得大家模仿和借鉴,作者同时批判了FIGO和病理诊断两个当前预后和诊断的金标准的方法,为了铺垫后续的影像组学模型的引出,非常适合作为引言第三段Gap(研究间隙)的书写素材。 我觉得它还少写一点,就是临床应用的病理特征很多是定性诊断,无法定量,这也是一个缺陷,但是影像组学同样受到观察者间变异性的影响,所以这句话说的也并不太严谨。 基于此,作者联合多模态MR影像组学特征和患者病理及临床特征构建DFS预测模型,以期为临床诊治决策提供参考。 4 影像组学模型构建
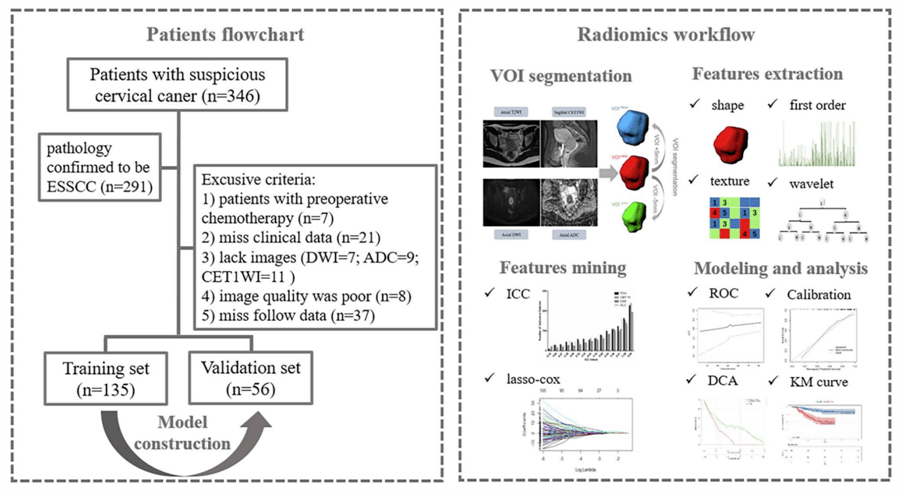
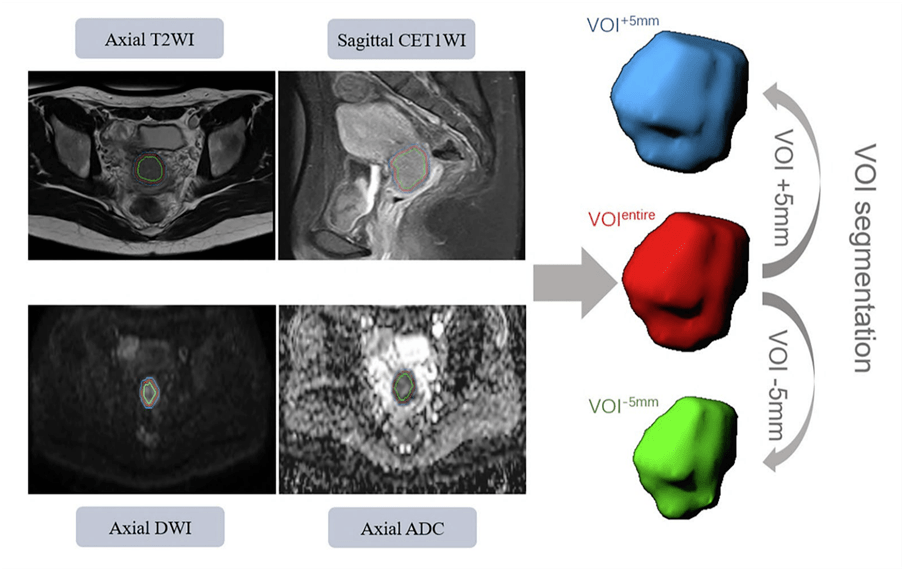
Figure 1 我们先来看一下流程图,重点关注右侧影像组学部分: ①VOI分割(红: VOI entire ,蓝: VOI +5mm , 绿: VOI -5mm ) ② 特征提取(形态学特征、一阶统计学特征、纹理特征、基于小波变换的特征) ③特征选择(ICC+LASSO-Cox) ④ 模型构建与评价 1.纳入排除标准制定 纳入标准 ①接受双侧盆腔淋巴结清扫的根治性子宫切除术 ② 术后病理证实为 ESSCC(FIGO IB-IIA 期) ③在MRI检测前无放化疗史 ④ 可以进行分析的影像质量 ⑤ 临床数据完整 排除标准(写在了流程图上) ① 术前接受化疗 ② 临床数据不全 ③ 影像资料不全 ④ 影像质量差 ⑤ 失访 鑫仔说: 这里鑫仔依然按照PICOS原则给大家做个梳理: P: 年龄:不限制(本文中年龄24-73岁),作者并未对年龄进行限制; 性别:女; 疾病状态:首诊初治; 疾病分期:早期(FIGO IB-IIA 期); 治疗方案:接受双侧盆腔淋巴结清扫的根治性子宫切除术(术后有无放化疗均纳入); 诊断标准:病理诊断; I/C: 影像设备:MRI ; 扫描序列:T2WI(TSE)、CET1WI(TSE)、DWI(EPI)、ADC; 靶区:3个VOI ( VOI entire , VOI +5mm , VOI -5mm ); 影像检查时间点:术前; 层厚:T2WI(5mm)、CET1WI(4mm)、DWI(5mm); 对比剂:0.1 mL/kg 钆造影剂以 2.5 mL/s 的速度静脉注射,然后用 20 mL 盐水冲洗 O: 远期疗效:DFS 最终,共纳入191名患者,按手术时间和7:3的比例分为训练集(135例:2016年3月-2018年8月)和验证集(56例:2018年9月-2019年9月)。并从中获得MRI影像数据、病理特征及临床特征资料。 鑫仔说: 作者这里直接将队列按时间段和比例拆分,而没有随机拆分。 2.多模态VOI分割 分割过程由具有 6年MR图像解读经验的妇科医师执行,并由具有 8年经验的妇科医师进行验证。使用 syngo.via Frontier Radiomics(Siemens Healthcare) 在轴向倾斜 T2WI、DWI、ADC 和矢状 CET1WI 上进行半自动分割。得到“整个”感兴趣体积 VOI entire 。 小注: syngo.via FrontierRadiomics是Siemens商业化的影像科研工作站,该软件兼具分割和影像组学特征提取功能。本文中,通过集成基于阈值的方法以及基于模型的形态处理的混合算法进行半自动分割VOI。 随后,将腐蚀和膨胀的形态学操作用于 VOI entire 上,从肿瘤表面分别向内5mm和向外5mm,全自动重构得到 VOI +5mm , VOI -5mm 。 最终,分别生成了 VOI entire , VOI +5mm , VOI -5mm 三种分割方式,展示在Figure2中。
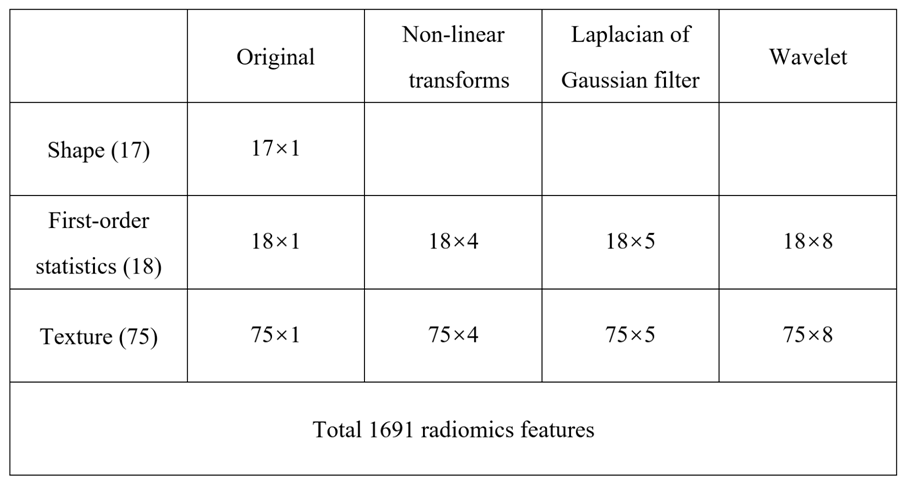
Figure 2 鑫仔说: 本文用的基本上是最简单的省力的多靶区分割方式。如果从影像学的角度来看,这样做还是比较暴力,不够严谨。直接做向外膨胀5mm的VOI,对于一些患者而言,有的区域会覆盖到大血管或器官外,应该对这样的区域进行擦除。 但我们换个角度看,本文进行的是全自动的腐蚀和膨胀,不用花费分割精力就可以蹭到多靶区这个加分项目了,是不是也是值得借鉴的呢? 3.影像组学特征提取+数据预处理 1)特征提取 本文特征提取过程依然采用syngo.via Frontier Radiomics全自动进行。最终包括了17个形态学特征,18个一阶统计特征,75个纹理特征(24个灰度共生矩阵GLCM、14个灰度依赖矩阵GLDM、16个灰度大小区域矩阵GLSZM、16个灰度游程矩阵GLRLM、5个邻域灰度差矩阵NGTDM)。 为了获得高通量特征,对图像体素进行非线性强度变换(平方、平方根、对数和指数);用 0.5、1.5、2.5、3.5 和 4.5 mm 的 sigma值进行滤波的高斯拉普拉斯算子 (LoG);并针对一阶统计和纹理特征进行了八种小波变换算法(LLL、LLH、LHL、LHH、HLL、HLH、HHL 和 HHH)。 最终总共得到1691个影像组学特征。
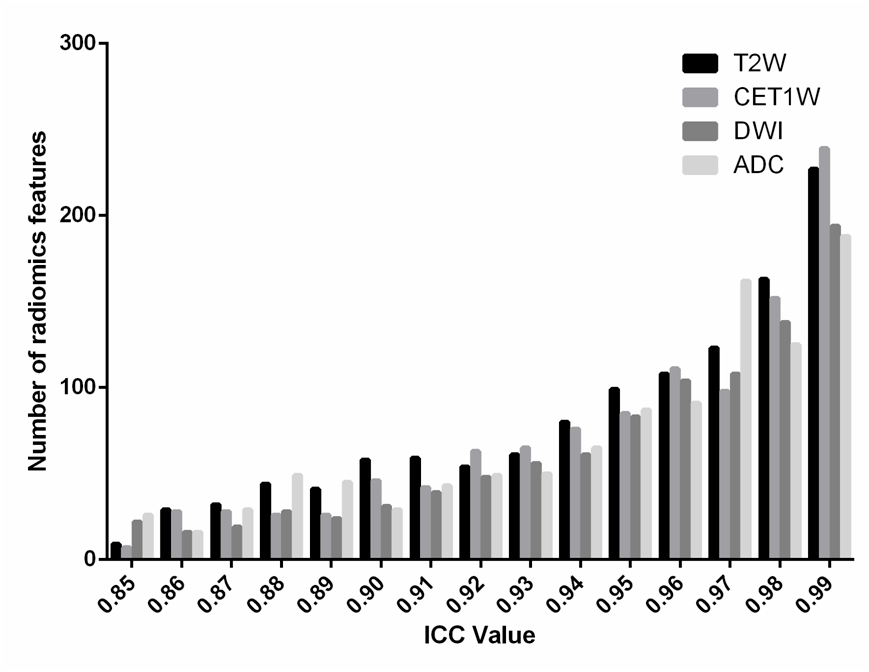
Table S3 2) 数据预处理 随后对训练集上提取的特征值进行标准化处理。 4.特征选择+三个Radscore计算 本文的特征选择过程分为两步 1)特征的一致性评价 随机选择75名患者进行2次分割,利用组内相关系数ICC评估提取特征的可重复性,ICC>0.8的影像组学特征被保留到下一阶段进行分析。
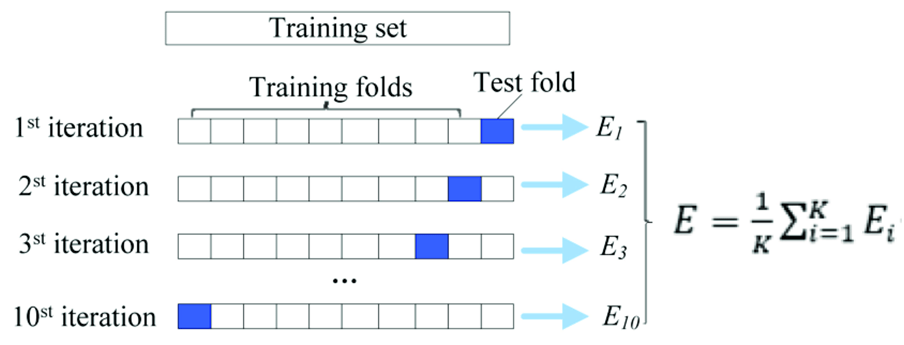
FigureS1 鑫仔说: 组间/组内相关系数ICC的两个作用: ① 一致性评估特征是否稳定 ② 选出哪些特征不受VOI影响 小注: 计算不同勾画者的ICC是影像组学质控评分(RQS)中的加分项。但需要注意的是,在常规利用ICC评估提取的影像组学特征一致性时,这一步一定是在影像组学特征提取之后的。 2)LASSO(COX)回归 通过10折交叉验证调节参数λ,保留具有非零系数的特征。 最终,在三类不同VOI ( VOI entire , VOI +5mm , VOI -5mm )中,利用选择的鲁棒性好的特征基于线性模型计算Radscore。 鑫仔说: K-折交叉验证(K-foldcrossvalidation)通常用于数据集较少时,直接随机切分可能会产生较大的误差。我们的例子中,数据集被分成了10份,称作10折交叉验证。 每一次迭代,有9份数据作为训练集,1份数据作为测试集,均会产生一个误差值。最后求10个误差的平均值,作为误差的输出。通过K-折交叉验证的不断迭代,可以实现对超参数λ的优化。
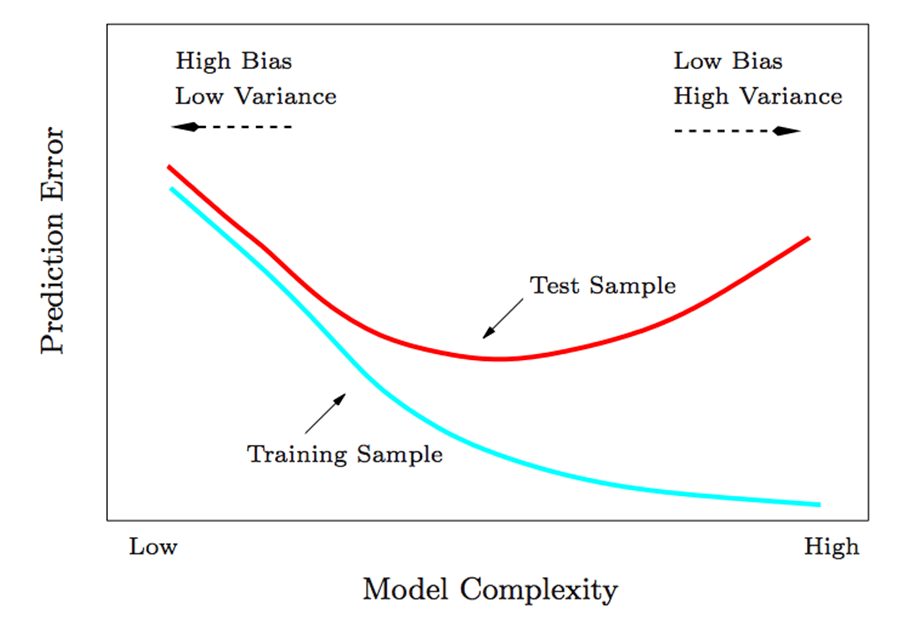
(图源:doi.org/10.3390/ijms19072071) 5.融合模型的建立和验证 对三个Radscore和肿瘤复发临床预测因子进行单变量COX回归分析,挑选具有统计学意义的参数进行基于最低贝叶斯信息准则(BIC)分数的逐步法多因素COX回归分析(简单来说,就是先用全部变量进行建模,然后逐步删除变量的方法)。 随后通过方差膨胀因子(VIF)检测变量间的多重共线性。与此同时,作者还建立了仅包括临床危险因素的临床模型以进行与融合模型比较。 至此,融合模型和临床模型构建完毕。 鑫仔说: 虽然本文用的是间接法进行融合模型的变量选择,不过该法也可以用在机器学习中,是有一定混淆性的(例如上期推文中 单单单影像组学MRI套路+白嫖数据,这个组合依然能发到6分+? 介绍的第二篇文章就利用了逐步回归法进行了影像组学特征的筛选)。 所以这里简单说说直接法和间接法进行模型选择的区别: 通常情况下,随着模型 复杂度(degree of complexity)的提升,训练误差会不断地减小,而测试误差会先减小后增大。
(图源:https://towardsdatascience.com/model-complexity-accuracy-and-interpretability-59888e69ab3d) 模型选择就是一系列让我们找到最佳复杂度模型的方法。它的主要思想是通过训练数据来估计期望的测试误差,从而让我们在不同复杂度的模型中进行选择。 模型选择包括 直接方法和 间接方法。直接方法通常指一系列 重抽样方法,其中包括 交叉验证或者 留一验证等。 间接方法通常指根据一些 分析准则来进行模型选择。分析准则就是用一些理论依据去估计期望的测试误差。通常情况下, “准则”=“训练误差”+“对参数数量的惩罚”。 如果本文也用间接法多机器学习模型进行筛选,主要会有以下两点优势:①与直接法相比,计算量要小很多;② 与间接方法的其它准则相比,BIC会进行更大的惩罚力度,因此往往也会选出更加简单的模型。 5 研究结果 1. 患者基线
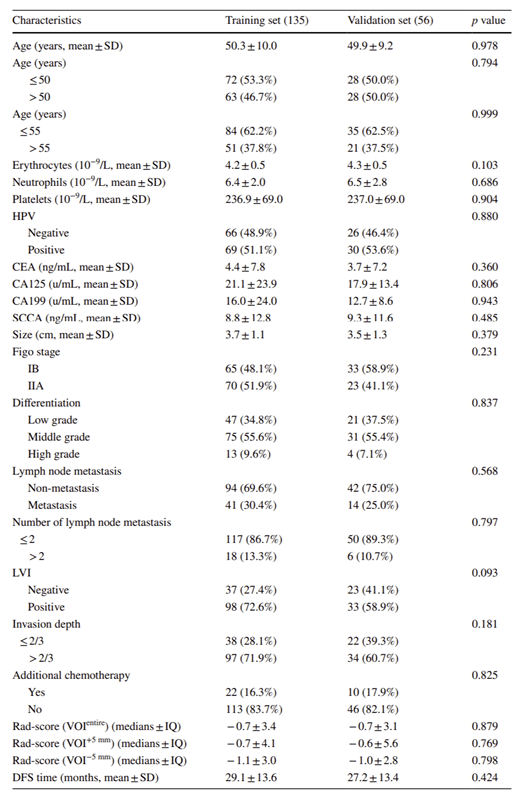
从Table1中,我们可以看到训练集和测试集的基线资料之间的差异均无统计学意义(P>0.05)。 鑫仔说:
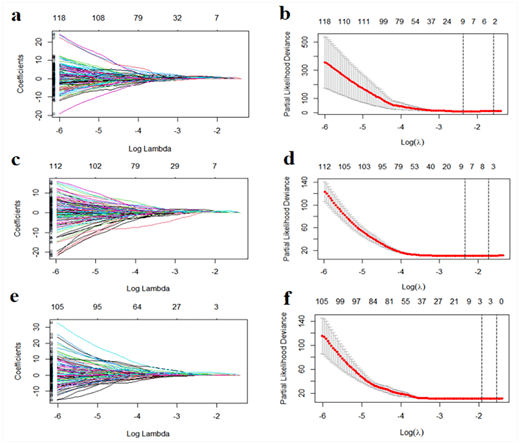
文章这里的写作逻辑:因为p值的区间在0.093到0.999,所以变量间没有显著差异。这种写法鑫仔是不推荐的,属于对p值的理解有误,更可靠的表达类似于这种: 具体原因可以参考洪老师的这篇推文:P值为何如此多娇,引无数医生竞折腰? 2. 影像组学特征选择和3个Radscore构建 如Figure S2所示通过LASSO(COX)回归模型对三个VOI分别进行特征选择,最终从( VOI entire )得到9个影像组学特征、( VOI +5mm ) 中得到8个影像组学特征、( VOI -5mm )中得到3个影像组学特征。
Figure S2 基于此,进一步对三组影像组学特征建立Radscore。 结果显示
Appendix1(1) Radscore (VOI entire ) 包含了3个T2WI 特征, 1个 DWI 特征,2个ADC特征, 和3个CET1WI 特征
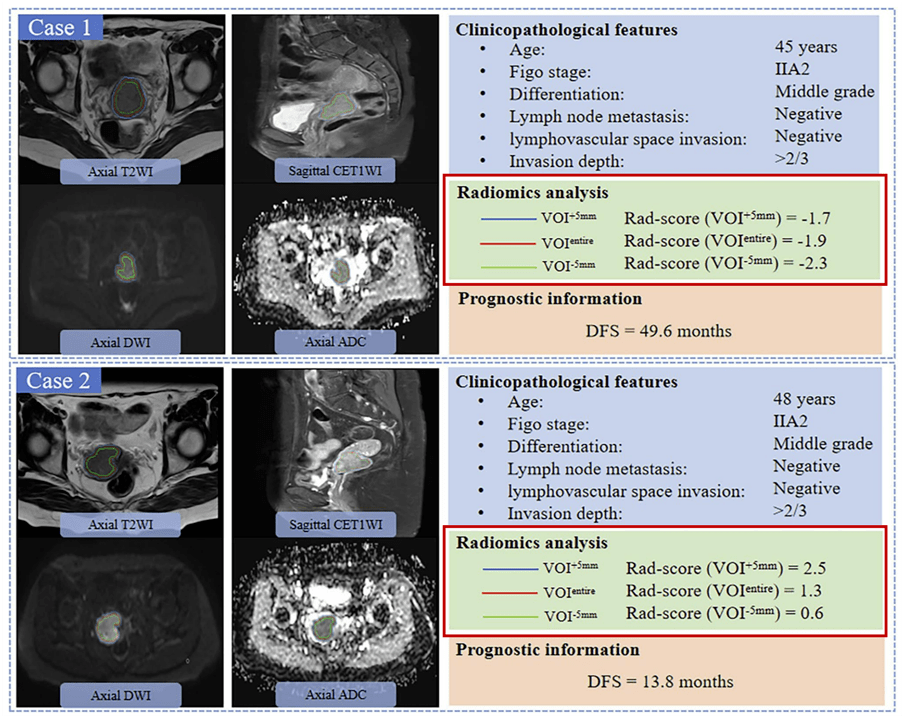
Appendix1(2) Radscore (VOI +5 mm ) 包含了1个T2WI 特征,两个DWI 特征,1个ADC特征, 4个CET1WI 特征。 Appendix1(3) Radscore ( VOI −5 mm ) 包含了2个T2WI 特征和1个 ADC 特征。 3. 三组Radsocre对DFS的预测能力评价 值得一提的是,作者随后展示了具有相同临床病理特征但不同DFS (49.6 个月vs 13.8个月)的两名患者。
Figure3 结果显示: Radscore ( VOI entire )(-1.9vs 1.3;p |
【本文地址】
今日新闻 |
推荐新闻 |