Cell:孙金鹏/邵振华/李乾/王越团队开发TAAR1激动剂,用于治疗精神分裂 |
您所在的位置:网站首页 › 川大邵振华 › Cell:孙金鹏/邵振华/李乾/王越团队开发TAAR1激动剂,用于治疗精神分裂 |
Cell:孙金鹏/邵振华/李乾/王越团队开发TAAR1激动剂,用于治疗精神分裂
 单胺类分子,例如多巴胺、5-羟色胺、肾上腺素等,是哺乳动物中枢神经系统中重要的神经递质,参与多种行为的调节和神经生理功能的调控,如奖赏、情绪调节、运动控制等,单胺环路功能异常则与抑郁症、帕金森病、精神分裂症等多种神经精神疾病密切相关。感知这些单胺类神经递质的G蛋白偶联受体(GPCR),例如多巴胺受体、肾上腺素能受体,是多种神经元活动的枢纽,也是重要的临床药物靶点,与这些胺类受体相关的研究已经多次获得诺贝尔奖。 除了上述这些被大家熟知的生物胺类神经递质以外,大脑内还存在一类内源性的胺类分子,其浓度非常低(10ng/g脑组织,不足多巴胺等单胺类分子的百分之一),因此被称为“痕量胺”。痕量胺分子包括苯乙胺(PEA)、色胺、酪胺等,是大脑内氨基酸的代谢产物。 2001年研究发现痕量胺能够特异性激活一类受体,这些受体被命名为痕量胺相关受体(Trace Amine-Associated Receptor,TAAR)。TAAR家族在哺乳动物中可以分为两个进化枝:Clade I(包括TAAR1-4) 和 Clade II(包括TAAR5-9),其中,除TAAR1以外,其余TAAR家族成员均在嗅上皮组织中高表达,属于一类嗅觉受体亚家族,称为嗅觉TAAR,能够识别环境中挥发性胺类气味分子,介导动物本能的嗅觉相关行为。然而,与嗅觉TAAR不同,TAAR1主要表达在大脑的单胺能神经核团,包括腹侧被盖区、中缝核和杏仁核等,可以识别大脑内的痕量胺分子,并调节单胺能神经元如多巴胺能和5-羟色胺能神经元的兴奋性及单胺类神经递质释放,因此也被称为非嗅觉TAAR。TAAR1能够被多种痕量胺激活,并且与药物成瘾、注意力缺陷多动症、精神分裂症等多种精神疾病相关,2020年《新英格兰医学杂志》报道了一种靶向TAAR1的小分子药物SEP-363856(又名Ulotaront), 不依赖多巴胺受体,可以避免严重不良反应,该药物已进入临床三期试验,这为开发精神分裂症的新型治疗方法提供了线索。尽管靶向TAAR1开发药物具有巨大的治疗潜力,但TAAR1分子识别和信号多样性的机制和药理学基础尚未得到系统研究。 值得一提的是,山东大学孙金鹏教授团队和上海交通大学医学院李乾研究员团队长期关注嗅觉受体及TAAR家族功能研究,于2023年5月24日在 Nature 合作发表研究了题为:Structural basis of amine odorant perception by a mammal olfactory receptor 的研究论文。该研究聚焦嗅觉受体感知机制,阐明了TAAR9感知气味的分子机制及其独特的激活方式。 然而,作为非嗅觉TAAR的TAAR1具有独特的配体谱,提示TAAR1的配体识别和激活机制不同于嗅觉TAAR,此外,能否基于TAAR1的配体结合域开发出亲和力更高其副作用更小的新化合物,从而为精神分裂症或药物成瘾治疗提供新的候选药物呢? 2023年11月13日,山东大学孙金鹏教授团队、杨帆教授团队,联合四川大学邵振华团队、上海交通大学医学院李乾团队和山东第一医科大学王越团队,在 Cell 期刊发表了题为:Structural and signaling mechanisms of TAAR1 enabled preferential agonist design 的研究论文。 该研究系统分析了不同内源性胺类和SEP-363856激活TAAR1多种G蛋白信号的特征,解析了不同胺类激活TAAR1-Gs/Gq通路的分子机制和药理学特征,进而成功开发出同时具有Gs和Gq双重激活活性的TAAR1小分子激动剂——ZH8651,并在小鼠模型中验证了其改善精神分裂的作用。该研究为靶向TAAR1治疗精神分裂症的候选化合物设计及药物开发改造提供了重要参考。  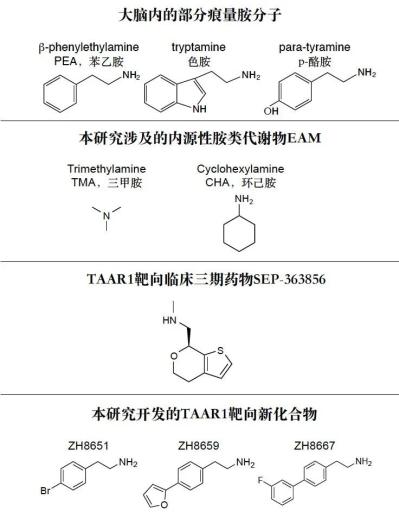 图1. 痕量胺分子和本研究使用的胺类化合物及其化学结构式 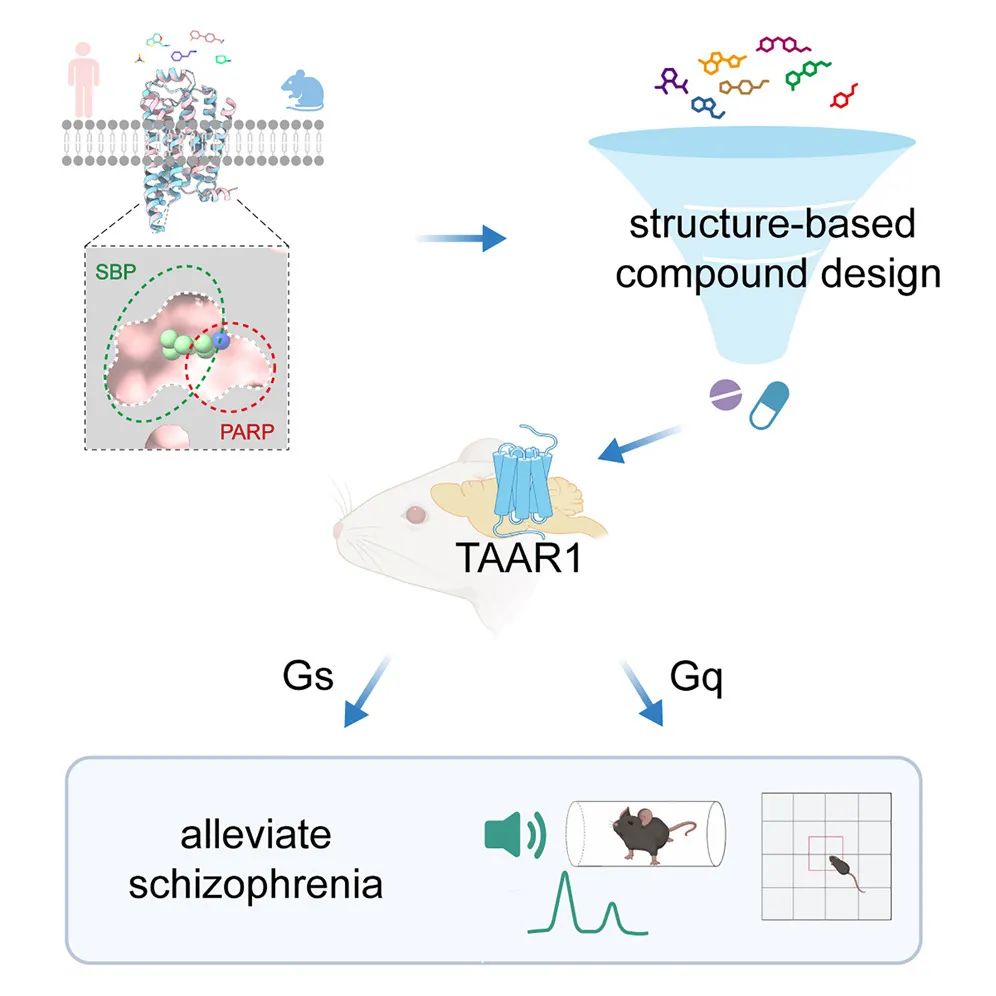 图2. 文章简要示意图 该研究主要发现包括: 1、明确了多种内源性胺类代谢物(EAM)激活TAAR1下游信号的通路多样性及其在精神分裂症中的作用。 研究团队首先系统地检测了多种内源性胺类物质及SEP-363856(化学结构式见图1)对人源TAAR1(hTAAR1)和小鼠TAAR1(mTAAR1)不同G蛋白亚型的激活情况,结果表明SEP-363856(简称SEP)和PEA能够激活m/hTAAR1的Gs信号通路,三甲胺(TMA)能够激活Gs、Gq、Gi三条信号通路,环己胺(CHA)激活Gq信号通路。有意思的是,研究发现在动物实验中,不仅SEP能够缓解MK-801诱导的精神分裂样症状,激活Gq信号通路的CHA也能够缓解该症状(图3)。在分别应用Taar1-/-小鼠和Gq抑制剂后,CHA对精神分裂的缓解作用明显减弱。这提示TAAR1介导的Gq信号通路在MK801诱导的精神分裂症中发挥有益作用,因此,开发靶向TAAR1的Gs/Gq双激动剂可能具有更好的应用效果。 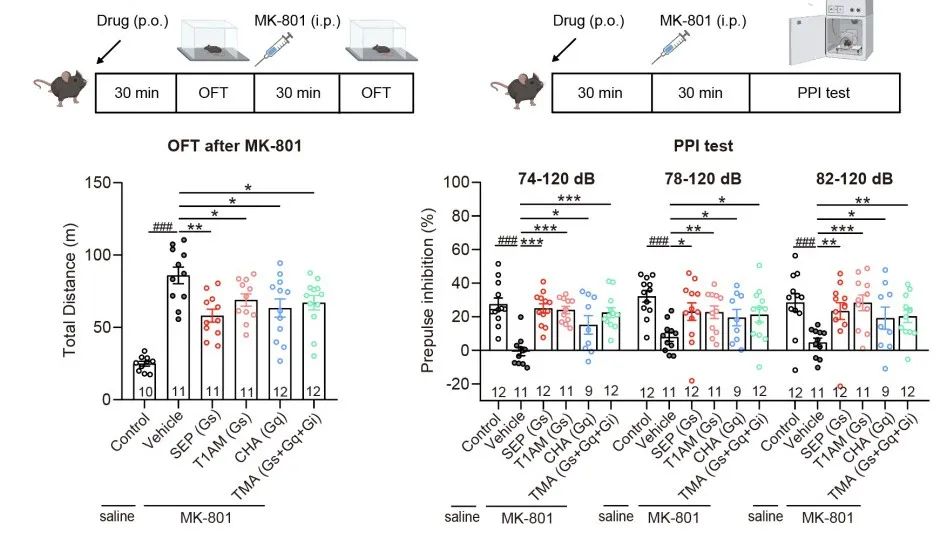 图3. TAAR1不同G蛋白信号通路激动剂对精神分裂样症状的作用 2、解析了EAM和临床三期药物SEP激活m/hTAAR1-Gs/Gq的分子机制。 基于以上在动物实验中的发现,研究团队解析了SEP-TAAR1-Gs、CHA-TAAR1-Gq、TMA-TAAR1-Gs、PEA-TAAR1-Gs等多个复合物的配体识别机制,发现了胺类识别的结合口袋(PARP)(图4)。在PARP内部,保守的D1023.32 TMA、CHA、PEA、SEP的氨基基团形成氢键形成氢键。Y2917.43与D1023.32共同稳定潜在的氢键网络。在口袋底部,W2616.48和F2646.51形成“双”拨动开关,从而诱导TAAR1激活。此外,与仅占据PARP的TMA相比,CHA、PEA和SEP激动剂中存在额外的环状结构,显示出第二结合口袋(SBP),结构分析和突变数据提示PARP和SBP均介导TAAR1的激活,揭示了TAAR1不同于嗅觉TAAR的配体结合域,同时也提示PARP和SBP是设计TAAR1高效力激动剂的潜在靶标。 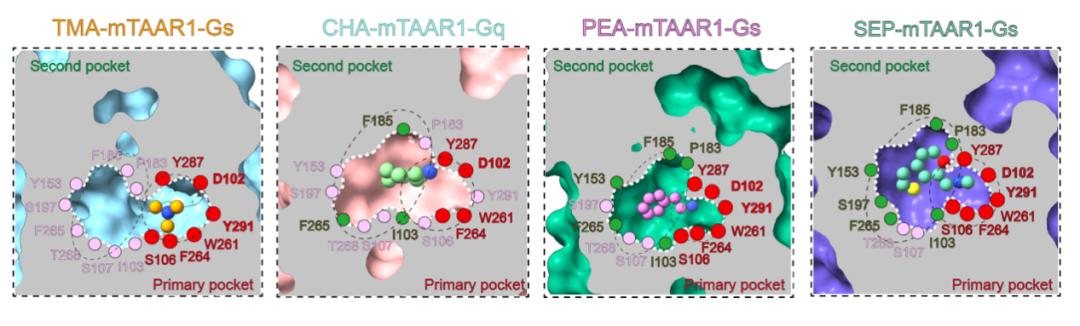 图4. TAAR1的配体识别口袋 3、阐明了TAAR1偶联Gs和Gq两种不同信号通路的关键氨基酸和信号传递途径。 基于对TAAR1不同G蛋白信号转导机制的分析,研究团队进一步找到了激活Gs和Gq通路的关键氨基酸位点。与Gq选择性激动剂CHA相比,两种Gs选择性激动剂SEP和PEA与TAAR1的特定氨基酸之间形成了额外的相互作用,包括S1063.36、Y1534.56、P183ECL2和Y2917.43。因此,研究团队在后续小分子的筛选工作中,将S1063.36和Y2917.43作为Gs选择性激动剂的筛选位点,而I1033.33、F185ECL2和F2656.52作为Gs/Gq双效激动剂的关键筛选位点(图5)。与此同时,研究团队详细解释了Gs和Gq信号传递途径的差异,为后续双效激动剂的开发提供了有利信息。 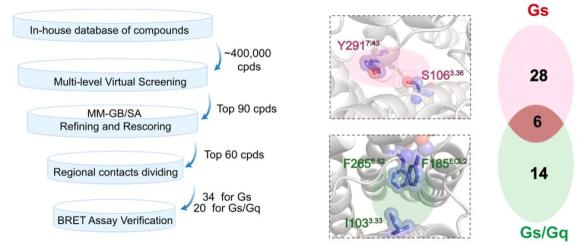 图5. 基于结构开发TAAR1激动剂的流程图 4、开发了靶向TAAR1的Gs偶联、Gq偶联以及Gs/Gq双偶联的高亲和力激动剂,并验证了其缓解精神分裂症的作用。 基于上述鉴定出的TAAR1配体结合域以及偶联Gs和Gq通路的关键氨基酸,研究团队进行了小分子设计及化合物库的建立,设计了“区域接触划分”策略,通过虚拟筛选和细胞生化实验验证,研究团队得到了TAAR1的Gs偶联激动剂ZH8667、Gq偶联激动剂ZH8659、Gs/Gq双偶联激动剂ZH8651(图5,其化学结构见图1)。ZH8651能够激活mTAAR1和hTAAR1的Gs、Gq信号通路,亲和力均在nM级别。以SEP作为对照,单次应用ZH8659和ZH8651剂量依赖性地改善MK -801诱导的小鼠精神分裂样症状,其效果与临床三期药物SEP相似。在Taar1-/-小鼠中,ZH8659和ZH8651对精神分裂症的改善作用大大减弱。 值得注意的是,单独给药SEP (3 mg/kg)对基础运动有明显的抑制作用,提示SEP可能具有导致自发活动减少的潜在副作用。相比之下,ZH8659或ZH8651没有引起基础活动减少(图6),显示其亲和力高副作用低的优势。 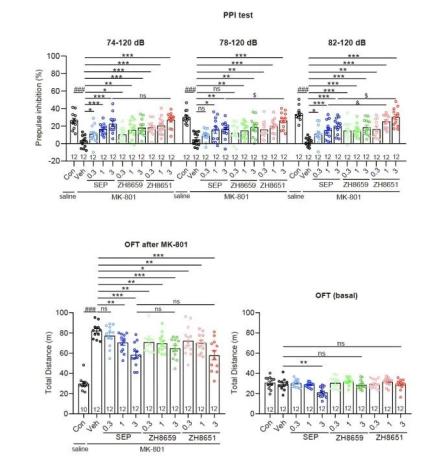 图6. ZH8659和ZH8651对精神分裂样症状的改善作用 总的来说,该研究应用基于结构的虚拟筛选和候选化合物设计,开发出一种有效的TAAR1双激动剂,在MK -801诱导的精神分裂症样小鼠模型中表现出治疗潜力,为靶向TAAR1开发抗精神疾病药物先导化合物提供了线索。 山东大学基础医学院研究生尚攀、荣乃康、讲师姜晶晶、高等医学研究院特别资助类博士后程杰、齐鲁医院研究生张鸣晖、药学院教授康东伟、生物医学结构表征中心主任齐磊为论文共同第一作者。山东大学孙金鹏教授、杨帆教授、四川大学邵振华研究员、上海交通大学医学院李乾研究员、山东第一医科大学王越研究员为论文共同通讯作者。该研究得到了国家卫健委耳鼻咽喉科学重点实验室的大力支持。孙金鹏团队与耳鼻喉重点实验室雷大鹏团队、冯昕团队、山东省立医院夏明团队开展长期合作,致力于嗅觉感知、耳鼻咽喉及头颈外科疾病的基础-临床转化。 阅读原文 |
【本文地址】