Cell Metabolism:AD中星形胶质细胞尿素循环的双重作用 |
您所在的位置:网站首页 › 尿素生成的主要过程包括 › Cell Metabolism:AD中星形胶质细胞尿素循环的双重作用 |
Cell Metabolism:AD中星形胶质细胞尿素循环的双重作用
|
01 导读 阿尔茨海默病(AD)是最重要的神经退行性疾病之一,其特征是β-淀粉样蛋白(Aβ)斑块和显著的进行性记忆丧失。在AD中,星形胶质细胞被认为可以吸收和清除Aβ斑块。然而,Aβ如何诱发AD的发病机制和记忆障碍仍不清楚。近期《Cell Metabolism》期刊发表了题为《Astrocytic urea cycle detoxifies Aβ-derived ammonia while impairing memory in Alzheimer′s disease》的研究论文,作者团队发现正常的星形胶质细胞表现为非循环尿素代谢,而经过Aβ处理的星形胶质细胞则表现为酶水平上调启动尿素循环,同时积累了进入尿素循环代谢物天冬氨酸、起始底物氨、最终产物尿素和副产物腐胺。星形细胞鸟氨酸脱羧酶 1 (ODC1) 的基因沉默,促进鸟氨酸到腐胺的转化,促进尿素循环并消除异常腐胺及其有毒副产物氨和 H2O2 及其最终产物 GABA,从而使AD的反应性星形胶质增生和记忆障碍得到恢复。作者团队研究结果表明,星形细胞尿素循环在 AD 中发挥有益的Aβ解毒和有害记忆障碍的相反作用,从而提出抑制ODC1作为一种有前途的AD治疗策略,以促进毒性分子的清除和防止记忆丧失。  02 结果 1.尿素循环酶在AD样条件下上调 为了研究星形胶质细胞中尿素循环的存在,作者首先检测了尿素循环通路相关基因。传统尿素循环由5个酶促步骤组成,从氨基甲酰磷酸合成酶 1 (CPS1)、鸟氨酸转氨甲基酶(OTC)、精氨酸琥珀酸合成酶1 (ASS1)、精氨酸琥珀酸裂解酶(ASL)和精氨酸酶1 (ARG1)开始(图1A)。总的来说,ARG1反应的最终产物是鸟氨酸,鸟氨酸可以被鸟氨酸脱羧酶1 (ODC1)进一步转化为腐氨酸或生成瓜氨酸(图1A)。他们通过qRT-PCR技术在原代培养的星形胶质细胞中筛选每种酶的mRNA水平(图1B)。将每个酶的基础mRNA水平归一化至Gapdh表达水平。他们发现通过qRT-PCR技术检测到所有尿素循环相关酶的mRNA的CT值均低于34。然而,他们观察到CPS1、OTC、ADC和AGMAT在正常星形胶质细胞中表达极低,这也表明了,正常条件下星形胶质细胞的尿素循环与传统尿素循环途径相比具有不同的非循环的特征。由于ADC1和AGMAT在星形胶质细胞中表达非常低(图1B),作者认为ARG1-to-ODC1通路可能是腐胺产生的主要通路。为了研究Aβ处理后尿素循环相关机制的变化,该团队评估了对照组和5天Aβ处理的星形胶质细胞的下一代RNA-seq (图1C)。RNA-seq通路分析显示,Aβ处理后,尿素循环和尿素代谢过程上调(图1D)。此外,通过差异表达分析,他们观察到自噬相关基因(Atg5, Atg7, Atg12, Lc3A/B,Sqstm1)和尿素环化基因(Ass1, Asl,Odc1)在Aβ处理下增加,而鸟氨酸氨基转移酶则减少,这表明鸟氨酸比谷氨酸更倾向于向腐胺转化(图1E)。为了验证获得的RNA-seq结果,他们对Aβ处理的星形胶质细胞进行了qRT-PCR检测。这种情况下,在4个不同的Aβ处理条件下进行分析:0h, 6h, 1d和5d处理。结果显示,CPS1、OTC、ASS1、ASl、ARG1、ODC1等所有与尿素循环相关的基因在Aβ处理5d后均呈增加趋势(图1F),表明AD样条件下星形胶质细胞的尿素循环与传统尿素循环相似。事实上,星形胶质细胞表达谷氨酰胺合成酶(GS),这是一种在大脑中负责氨解毒的内在酶。作者团队检测了APP/PS1小鼠中GS的表达水平,发现与WT小鼠相比,APP/PS1小鼠中GS的表达水平明显降低(图S1)。由于GS表达减少,AD条件下星形细胞的尿素循环可能被激活转化多余的氨。综上所述,这些结果表明,在正常条件下,星形胶质细胞具有独特的非循环尿素代谢途径,而缺乏CPS1和OTC酶,导致循环中断。在AD样条件下,由于星形胶质细胞中大部分尿素循环相关基因表达升高,尿素代谢也变成传统的尿素循环,鸟氨酸最终生成腐胺(图1G)。   图1.尿素循环酶在AD条件下上调 图1.尿素循环酶在AD条件下上调2.AD患者海马区星形胶质细胞OTC、ARG1、ODC1增高 为了探讨尿素循环在AD患者中的临床意义,作者获得了8-10例AD患者和对照组受试者的死后大脑的转录数据(图2A和2B)。通过KEGG通路分析,他们发现AD患者的氨基酸生物合成和尿素循环相关通路上调(图2A)。此外,他们通过转录组分析观察到AD患者中OTC、ARG1和ODC1的 mRNA表达水平升高。他们发现,在原代星形胶质细胞培养物和AD患者中,OTC、ARG1和ODC1转录组表现出类似的上调模式。作者观察到OTC水平比ODC1低约100倍,与星形胶质细胞培养一致(图1B)。接下来,该团队对AD患者和正常受试者死后海马组织进行免疫组化,检测OTC、ARG1和ODC的蛋白水平(图2C - 2H)。他们发现AD患者大脑中GFAP阳性反应性星形胶质细胞较正常组增加(图2C、2E和2G)。此外,他们发现OTC、ARG1和ODC1的表达在AD脑中随着GFAP阳性区域的水平升高而显著增加并共同定位(图2D、2F和2H),这表明星形胶质细胞的OTC、ARG1和ODC1的上调可作为AD的致病标志物。由于OTC的抑制作用预计最终会增加而不是降低腐胺的浓度,他们决定将重点放在 ARG1和ODC1上,这是腐胺生产的最后两个步骤。综上所述,他们提出,在AD条件下,星形胶质细胞尿素循环ARG1和ODC1酶上调,这一过程导致了合成腐胺并最终合成GABA。   图2.AD患者海马区星形胶质细胞中尿素循环相关基因升高 图2.AD患者海马区星形胶质细胞中尿素循环相关基因升高3.星形胶质细胞尿素循环代谢物在AD样条件下上调 为了研究AD样条件下星形胶质细胞尿素循环的直接代谢变化,作者采用液相色谱-质谱(LC-MS)分析了在1μm Aβ处理下的培养的星形胶质细胞内尿素循环代谢物(图3A)。他们发现,在尿素循环中,作为底物胺供体之一的天门冬氨酸(图1G)在Aβ处理下显著增加。此外,经Aβ处理的星形胶质细胞,副产物腐胺及其副产物GABA的浓度显著增加(图3A),这与之前的报道一致,而鸟氨酸的潜在副产物谷氨酸(图1G)则没有变化(图3A)。作者发现,尿素循环的中间代谢物,如瓜氨酸、精氨酸和鸟氨酸没有明显的变化(图3A),说明这些尿素循环代谢物是一个恒定的通量。相反,代谢物天门冬氨酸显著增加,这说明天门冬氨酸是Aβ降解进入尿素循环的主要代谢产物。他们用15NH4Cl(重氮氯化铵,1mm)处理原代培养的星形胶质细胞,进一步确认氨是尿素循环的起始底物,发现15N-原子结合到鸟氨酸、腐胺和GABA中(图S2)。 为了研究星形细胞尿素循环中代谢产物的通量,他们开发了包括ASS1、ASl、ARG1和ODC1在内的每种尿素循环酶的shRNAs(图S3)。他们首先用ARG1-或ODC1-shRNA转染Aβ处理的星形胶质细胞,通过基因沉默抑制每种酶,并与对照组的Scr shRNA进行比较(图3B)。他们发现Arg1-shRNA条件下精氨酸的浓度显著升高(图3B),表明沉默Arg1诱导精氨酸的积累,这是由Aβ处理星形胶质细胞尿素循环的恒定通量引起的(图3B)。此外,鸟氨酸浓度在ODC1-shRNA条件下显著升高,也证实了Aβ处理后星形胶质细胞尿素循环的恒定通量。此外,作者观察到通过ODC1- shRNA,瓜氨酸的浓度有增加的趋势(图3B),这表明通过ODC1基因沉默积累的鸟氨酸又循环回到瓜氨酸中。由于天门冬氨酸位于ARG1和ODC1的上游,基因沉默后,天门冬氨酸的浓度没有改变(图3B)。该团队还发现,通过沉默ODC1,谷氨酸浓度增加,增加了积累的鸟氨酸通过OAT途径转向谷氨酸的可能性。综上所述,这些结果表明,星形胶质细胞尿素循环在AD样条件下是以恒定的通量循环的。 为了研究星形胶质细胞尿素循环是否为AD样条件下产生腐胺的主要上游来源,作者用shRNA (ASS1, ASl, ARG1或ODC1)转染Aβ处理的星形胶质细胞,并检测腐胺浓度(图3C)。他们观察到腐胺浓度在所有条件下都显著降低,这表明星形胶质细胞尿素循环酶参与了腐胺的产生。此外,ARG1和ODC1基因沉默表现出最显著的腐胺产量减少,表明这些酶是这一过程的关键调控因子。总之,这些结果提供了直接证据,表明经Aβ处理后,星形胶质细胞尿素循环的进入鸟氨酸循环代谢物天冬氨酸和终产物腐胺的水平升高,随着中间代谢物恒定流动,这些物质在AD样条件下可能以更高的速度增加。 接下来,为了调查底物氨的来源和去路,他们在AD样条件下进行了氨分析(图3D和3E)。未解毒的氨进入尿素循环的来源可能包括通过Aβ自噬/溶酶体途径增加蛋白质降解导致的氨基酸代谢升高和通过依赖单胺氧化酶的腐胺降解途径产生的氨(图1G)。为了分析自噬/溶酶体和单胺氧化酶依赖途径的作用,他们使用CQ(氯喹,20 mM)和Atg5, Lc3 shRNA或最近开发的可逆单胺氧化酶抑制剂KDS2010 (100μm)对Aβ处理的星形胶质细胞进行氨检测。他们观察到,单胺氧化酶抑制剂和自噬抑制剂大大减少了氨的积累(图3E 、S4C),这表明单胺氧化酶介导的腐胺降解途径和自噬降解途径都是有毒氨进入尿素循环的主要来源。此外,ATG5和LC3 shRNA抑制自噬降低了Aβ诱导的天冬氨酸浓度(图S4B),提示自噬系统是Aβ诱导的天冬氨酸的上游通路。然后,该团队研究了ARG1和ODC1对Aβ处理的星形胶质细胞中毒性氨积累的药理抑制作用。他们使用ARG1抑制剂ABH (2(S)-氨基-6-硼己酸-盐酸,10 μm) 和ODC1抑制剂DFMO(二氟甲基鸟氨酸,50 mM)对Aβ处理的星形胶质细胞进行氨测定。作者发现ABH和DFMO都能显著降低Aβ处理的星形胶质细胞的氨积累(图3E)。综上所述,这些结果表明,在类似AD的条件下,存在有毒的正反馈回路,抑制ARG1、ODC1或MAO-B可以防止有毒氨的积累,并限制其重新进入尿素循环。 为了研究经Aβ处理的星形胶质细胞尿素循环是否产生终产物尿素,作者团队通过尿素测定法检测了体外和体外尿素浓度(图3D)。他们用10μm精氨酸和10μm ABH处理原代星形胶质细胞5天,测定细胞中尿素含量。他们发现精氨酸处理显著增加了细胞中尿素的含量,而ARG1抑制减少了细胞中尿素的含量(图3F),这表明精氨酸和ARG1都是尿素生成的关键因素。接下来,为了检测Aβ和ODC1对尿素生成的影响,他们用1μm Aβ和50μm DFMO处理星形胶质细胞(图3G)。他们发现Aβ处理使尿素浓度升高,而DFMO处理又进一步提高了尿素浓度(图3G),说明ODC1抑制加速了尿素循环中氨解毒为尿素的过程。这些结果表明,尿素循环中,ARG1抑制破坏Aβ和氨的解毒作用,而ODC1抑制则增强其解毒作用。综上所述,星形胶质细胞经Aβ处理后表现出星形胶质细胞尿素循环通量的上调和最终产物尿素的产生。 为了进一步研究AD小鼠模型中尿素循环酶的体内意义,作者团队开发了一种新型尿素传感器探针,可以实时测量麻醉野生型(WT)和转基因(TG)APP/PS1小鼠(AD动物模型)大脑中的尿素(图3I和S5)。在使用新型尿素传感器探针之前,他们首先使用酶基尿素测定法测量WT和APP/PS1小鼠海马区细胞内尿素含量(图3H)。与之前的报道一致,他们观察到APP/PS1小鼠体内尿素浓度明显高于WT小鼠(图3H),证实AD小鼠体内尿素循环确实上调。然后,他们使用新开发的尿素传感器测量WT和APP/PS1小鼠齿状回(DG)中尿素酶诱导的电流(图S5),并基于体外预校准传感器计算细胞外尿素浓度(图3J)。他们观察到APP/PS1小鼠的尿素浓度高于WT小鼠(图3K和3L)。然后在配对实验中,对APP/PS1小鼠注射ABH(10 mg/kg)或DFMO(600 mg/kg)前后实时测量电流(图3I)。在腹腔注射ABH后,他们发现在大约2小时内,尿液诱导电流逐渐显著降低(图3K),转化为脑内细胞外尿素浓度降低(图3L)。然而,注射DFMO没有引起这种改变(图3K和3L)。这些结果提示ARG1是AD小鼠脑内Aβ解毒生成尿素的关键酶。   图3.尿素循环代谢物和尿素产量在AD样条件下上调 图3.尿素循环代谢物和尿素产量在AD样条件下上调4.ARG1和ODC1是副产物GABA必需的上游酶 为了测试尿素循环是否直接参与腐胺降解产生GABA,该团队开发并利用尿素循环酶的shRNAs来沉默原代星形胶质细胞培养中的尿素循环基因(图S3和4A-4C)。他们分别将尿素循环酶shRNAs (ASS1、ASl、ARG1和ODC1)转染于Aβ处理5天的星形胶质细胞中,并用免疫细胞化学(ICC)染色显示GFAP和GABA。结果显示,通过基因沉默尿素循环中涉及的酶,GABA显著降低(图4B和4C),表明尿素循环位于GABA合成途径的上游。 为了研究ARG1和ODC1是否是AD样条件下产生GABA的关键调节酶,他们对Aβ处理的培养星形胶质细胞进行嗅迹贴片实验,以实时检测单个星形胶质细胞立即释放GABA 的情况。在刺激星形胶质细胞时,测量TRPA1通道增加的钙信号,并可从表达GABAC受体的HEK细胞记录释放的GABA电流。通过100mm GABA处理,内向GABA电流归一化为全激活电流(图S4D和S4E)。经过5天的Aβ处理后,星形胶质细胞出现了GABA的显著释放(图4D),如前所述,使用shRNA对Arg1和Odc1基因沉默几乎完全消除了GABA的释放(图4E)。然后,他们用10μm精氨酸(ARG1的底物)培养原代星形胶质细胞,并将对照组与10μm ABH进行比较。他们发现精氨酸处理增加了GABA的释放,而这一过程被ARG1抑制剂阻断(图4F)。通过ARG1基因沉默,精氨酸代谢产生的GABA释放显著减少(图4G),表明Arg1的药理和遗传抑制都阻断了精氨酸诱导的GABA产生。接下来,当他们用10μm鸟氨酸(腐胺的前体)处理培养物时,GABA电流被诱导,而ODC1抑制剂DFMO 可以使这一过程显著消除(50μm;图4 h)。最后,通过ODC1基因沉默,鸟氨酸增加的GABA电流显著降低(图4I),说明ODC1是鸟氨酸诱导的GABA产生所必需的。20μm CQ抑制自噬也阻断了Aβ诱导的GABA的产生(图S4D-S4F),进一步证实了自噬在腐胺中的上游作用,进而产生GABA。此外,H2O2实验结果进一步支持ODC1抑制和ARG1抑制可降低Aβ诱导的H2O2产生和氧化应激(图S4G)。 由于瓜氨酸和天门冬氨酸在启动尿素循环中也是必不可少的,所以作者团队用10μm瓜氨酸和10μm天门冬氨酸分别或同时孵育原代培养的星形胶质细胞。他们发现瓜氨酸单独对GABA的产生和释放没有显著影响,而天冬氨酸显著增加了GABA的产生(图4J),这表明进入代谢物天冬氨酸的积累可以增加尿素循环的通量,导致更多的GABA产生。有趣的是,带有天冬氨酸的瓜氨酸显示出最大的GABA电流增加,表明天门冬氨酸和瓜氨酸共同促进尿素循环。综上所述,在AD样条件下,腐胺降解途径上游尿素循环通量的增加导致GABA和H2O2的产生增加,其中ARG1和ODC1是关键酶。   图4.ARG1和ODC1是产生GABA的主要酶 图4.ARG1和ODC1是产生GABA的主要酶5.Arg1和Odc1基因沉默可降低AD小鼠GABA和腐胺的产生 为了检测APP/PS1转基因小鼠的ODC1水平,作者使用GFAP和ODC1抗体进行免疫组化(IHC)实验(图5A)。他们发现,ODC1在WT小鼠的星形胶质细胞中染色最少,而APP/PS1小鼠在DG区的GFAP阳性区域表现出明显的ODC1,而在颗粒细胞(GC)层则没有表现(图5A)。与人类数据一致(图2),由于它高度的疾病相关表达性,这些结果提高了ODC1作为一个新的AD标记的可能性。此外,ODC1在WT小鼠中的小胶质细胞(52%)和星形胶质细胞(40%)表达量最高,而在APP/PS1小鼠的星形胶质细胞(61%)和小胶质细胞(33%)表达量最高(图S6A和S6B),提示ODC1与AD的病理改变有关。为了观察ODC1-shRNA在体内的作用,该团队将携带pSicoR-Odc1shRNA-GFP构建物的慢病毒注射到WT和APP/PS1小鼠的DG中。注射病毒3周后处死动物,使用抗GFAP和ODC1抗体进行免疫组化。他们观察到上调的星形细胞ODC1被ODC1 - shRNA完全逆转(图5B)。这些结果说明了ODC1 - shRNA在体内构建的高效率以及ODC1抗体的特异性和可靠性。为了观察Arg1-shRNA的体内效应,他们将携带pSico-Arg1sh-GFP的慢病毒与AAV - GFAP – cre - mCherry病毒一起注射到APP/PS1小鼠DG中。4周后,作者通过qRT-PCR检测海马切片中mRNA水平,通过western blot检测蛋白水平(图S6D-S6G)。他们观察到Arg1-shRNA在体内系统中降低了mRNA水平和蛋白质水平。因此,他们得出结论,携带ARG1和ODC1 shRNA系统的慢病毒构建在注射后3-4周显示出良好的敲除效果。 接下来,为了验证ARG1和ODC1是否是AD动物模型中导致GABA合成的关键上游酶,他们将pSicoR-Arg1shRNA-GFP或pSicoR-Odc1shRNA-GFP病毒注射到WT和APP/PS1小鼠中(图5C)。他们发现APP/PS1小鼠GFAP阳性星形胶质细胞GABA产生异常,通过Arg1-和ODC1 - shRNAs恢复到WT水平(图5D),表明Arg1和ODC1是星形胶质细胞GABA合成的关键酶。此外,在Arg1-或odc1-shRNA注射的小鼠中,APP/PS1小鼠中上调的GFAP水平显著降低(图5E)。详细的星形胶质细胞Sholl分析(图5F)显示,应用APP/PS1小鼠星形胶质细胞的末端半径(图5H)和相交总和的增加(图5G和5I)也被ARG1和ODC1基因沉默拯救,表明星形胶质细胞增生减少。鉴于在反应性星形胶质细胞中观察到的GABA增加是通过单胺氧化酶介导的腐胺降解,他们进一步试图检测APP/PS1小鼠中Arg1和Odc1星形胶质细胞特异性基因沉默时副产物腐胺的水平。他们在WT或APP/PS1小鼠的DG内注射携带依赖于CRE的pSICO-Arg1shRNA-GFP或pSICO-Odc1shRNA-GFP以及AAV-GFAP-Cre-mCherry病毒的慢病毒,,并对腐胺和GFAP进行免疫组化(图5J)。他们发现APP/PS1小鼠的腐胺和GFAP水平显著升高,并在ARG1和ODC1星形细胞特异性基因沉默后恢复到WT水平(图5K)。综上所述,这些结果表明,ARG1和ODC1对腐胺和GABA的合成以及AD的反应性胶质细胞增生至关重要,且与Aβ处理的原代培养星形胶质细胞的数据一致(图4)。这些结果暗示,在AD小鼠模型中星形胶质细胞的尿素循环位于GABA合成通路的上游。  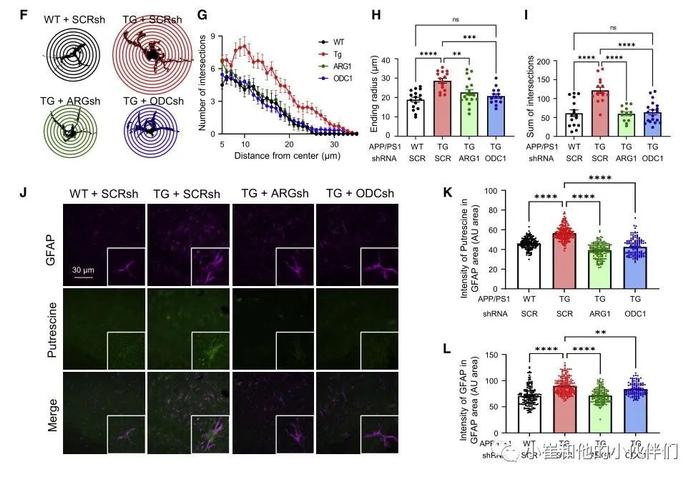 图5 .抑制ARG1和ODC1可减少GABA的异常产生 6.抑制星形胶质细胞ARG1和ODC1酶完全恢复APP/PS1小鼠受损的峰概率和记忆缺陷 为了检测APP/PS1小鼠ARG1和ODC1酶被药理抑制后星形胶质细胞GABA释放的水平,作者用ARG1抑制剂ABH(1 MM)和ODC1抑制剂DFMO(1 MM)孵育超过2小时后,在DG颗粒细胞上进行全细胞膜片钳记录(图6A)。他们观察到,ABH-和DFMO -孵育的切片都显示了紧张性GABA水平的显著降低,而自发抑制突触后电流(sIPSC)频率和幅度没有显著差异(图6B),这有力地证明了ARG1和ODC1参与星形胶质细胞的GABA合成,而不是神经元。因此,为了检测星形胶质细胞特异性沉默Arg1和Odc1基因在APP/PS1小鼠体内的增强GABA电流的变化,他们将携带COR依赖的pSico-Arg1shRNA-GFP或携带AAV - GFAP - cre- mCherry病毒的pSico-Odc1shRNA-GFP慢病毒注射到WT或APP/PS1小鼠的DG中(图6C和6D)。如前所述,他们观察到与WT小鼠相比,APP/ PS1小鼠的紧张性GABA电流显著增加。有趣的是,星形胶质细胞特异性的Arg1-和Odc1-shRNA表达使这种增加的紧张性GABA电流显著降低到WT水平,sIPSC的振幅和频率没有差异。这些结果表明,ARG1和ODC1的药理和遗传抑制选择性地影响星形细胞的GABA紧张性释放,而不是突触释放。 在AD条件下,已知紧张性GABA释放可抑制突触引起的动作电位放电。为了研究星形细胞ARG1和ODC1在这种抑制中的作用,作者在这些病毒注射小鼠中进行了全细胞电流钳记录,以计算通过电刺激穿孔通路上EPSPs上突触诱发动作电位的峰值概率(图6E)。与之前的报告一致,与WT小鼠相比,APP/PS1小鼠的峰值概率受损(图6F)。重要的是,星形细胞Arg1和Odc1的基因沉默完全拯救了这种受损的spike概率(图6F和6G)。这些结果表明,星形胶质细胞ARG1和ODC1是AD小鼠紧张性GABA释放升高和峰电位降低的必要因素。 为了进一步研究APP/PS1小鼠ARG1和ODC1基因沉默后记忆相关行为的变化,他们在注射病毒3周后进行了Y迷宫试验和被动回避试验(PAT),如图6H所示。他们发现通过星形细胞Arg1和Odc1的基因沉默,APP/PS1小鼠的低水平的百分比改变(%改变)得到了恢复(图6I),表明受损的空间短期记忆得到了修复。此外,该团队评估了PAT,它解释了DG相关的长期记忆。采集后一天,APP/PS1小鼠进入暗室的潜伏期明显较短,表明其长期记忆受损(图6J)。沉默星形胶质细胞ARG1和ODC1能够部分而显著地恢复这个入口潜伏期(图6J),从而改善APP/PS1小鼠的长期记忆损伤。先前的报告指出AD中异常的紧张性GABA释放与记忆障碍之间的相关性。为了理解这种相关性,他们绘制了每个受试者的紧张性GABA电流与PAT进入潜伏期之间的关系。有趣的是,他们观察到进入潜伏期与紧张性GABA电流高度负相关(图6K),表明星形胶质细胞释放的紧张性GABA越高,记忆越差。综上所述,作者得出结论:ARG1和ODC1对APP/PS1小鼠的紧张性GABA水平、突触放电和记忆损伤有重要的调节作用,这表明它们可能是治疗AD的新靶点。  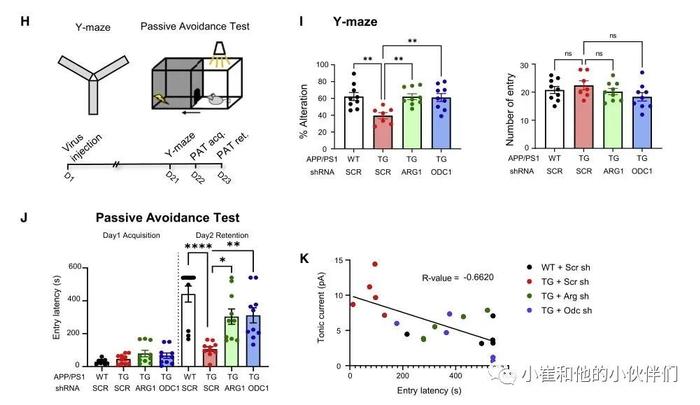 图6 .抑制星形胶质细胞ARG1和ODC1酶完全恢复了APP/PS1小鼠受损的峰概率和记忆 7.通过Odc1基因沉默,APP/PS1小鼠Aβ斑块减少 为了研究ARG1和ODC1对Aβ斑块的影响,作者检测了APP/PS1小鼠ARG1和ODC1基因沉默的神经系统斑块数量。他们将携带SicoR-Arg1shRNA-GFP或pSicoR-ODC1shRNA-GFP的慢病毒注射到WT或APP/PS1小鼠DG层,并进行PyrPeg免疫染色,它可选择性检测神经系统斑块(图7A)。注射病毒4周后,作者观察到APP/PS1小鼠中pyrpeg阳性斑块较WT小鼠明显增加(图7B)。有趣的是,ODC1基因沉默组pyrpeg阳性斑块数量明显减少,而ARG1基因沉默组没有明显变化(图7B)。进一步,他们使用RNA-seq来检测在含或不含DFMO的Aβ处理的原代星形胶质细胞培养中,编码APP加工相关蛋白的基因,如a-分泌酶、b-分泌酶和g-分泌酶的表达水平(图7C和7D)。他们发现,与对照组相比,Aβ处理的星形胶质细胞中APP-、β-分泌酶- (Bace1和Bace2)和γ-分泌酶相关基因(Psen1、Psen2、Aph1b、Aph1c和Ncstn)的淀粉样裂解相关基因水平上调(图7D)。相反,这种上调被DFMO处理逆转,伴随非淀粉样裂解相关的α-分泌酶基因上调(图7D)。这些结果表明,ODC1抑制促进APP的非淀粉样裂解,而不是淀粉样裂解。结合图3的结果,这些数据表明,ODC1抑制在AD样条件下显示出双重有益作用,即通过增加Aβ解毒和减少淀粉样负荷。  图7 图7.ODC1基因沉默减少APP/PS1小鼠AB斑块 03 小结 在这项研究中,作者团队描述了AD样条件下星形胶质细胞尿素循环中腐胺降解途径的详细分子机制和代谢途径,并且揭示了尿素循环在AD中的双重作用:一方面在清除过量的氨发挥正解毒作用,另一面因为产生腐胺及其副产物而引起记忆损害及神经退行病变。同时,作者还发现ODC1是将解毒尿素循环和有害腐胺降解途径分离的关键酶,抑制ODC1可以保持星形胶质细胞的正解毒作用,从而减少AD患者记忆损害及神经退行病变,为防治AD提供新的治疗靶点和策略。 原文链接: Ju YH, Bhalla M, Hyeon SJ, et al. Astrocytic urea cycle detoxifies Aβ-derived ammonia while impairing memory in Alzheimer's disease. Cell Metab. 2022;34(8):1104-1120.e8. 编 译:许 建 明 校 审:梁 春 梅 小崔和他的小伙伴们 特别声明:以上文章内容仅代表作者本人观点,不代表新浪网观点或立场。如有关于作品内容、版权或其它问题请于作品发表后的30日内与新浪网联系。 |
【本文地址】
今日新闻 |
推荐新闻 |