乳腺癌HER2检测指南(2019版) |
您所在的位置:网站首页 › 原位杂交技术报销吗 › 乳腺癌HER2检测指南(2019版) |
乳腺癌HER2检测指南(2019版)
|
[导读] 作者: 《乳腺癌HER2检测指南(2019版)》编写组
来源:中华病理学杂志, 2019,48(3) : 169-175.
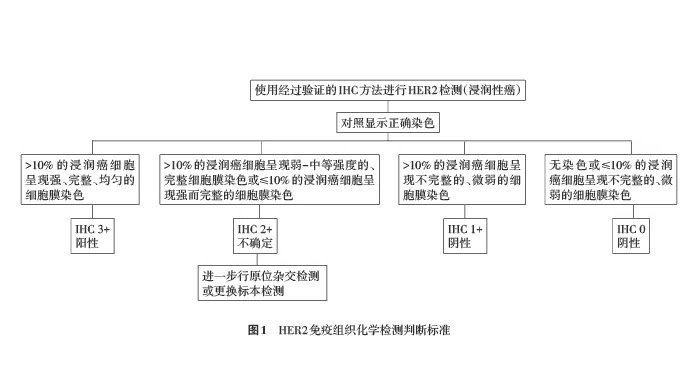
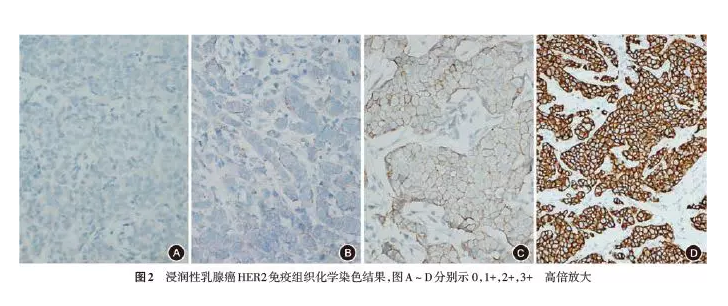
正确检测和评定乳腺癌的HER2蛋白表达和基因扩增状态对乳腺癌的临床治疗及预后判断至关重要[1,2]。2006年我国《乳腺癌HER2检测指南》[3]的发布对提高乳腺癌HER2检测水平起到了积极作用。我国病理学专家和临床专家于2009年和2014年联合发布了《乳腺癌HER2检测指南(2009版)》[4]及《乳腺癌HER2检测指南(2014版)》[5],强调了HER2检测结果的判读标准、检测的技术路线、内外部质量控制等,对提高我国乳腺癌HER2检测的标准化水平起到了积极推动作用。近年来针对HER2阳性乳腺癌的抗HER2治疗(曲妥珠单抗、拉帕替尼)在临床上取得了良好疗效,新的抗HER2药物如帕妥珠单抗、T-DM1、吡咯替尼等也越来越多用于临床。与此同时,HER2检测中也出现了一些新进展和新问题[6,7,8,9,10,11]。本指南以《乳腺癌HER2检测指南(2014版)》为基础,补充相关领域的更新,旨在提高HER2检测的准确性和可重复性,更有效地评估乳腺癌患者的预后,并选择适合抗HER2靶向治疗的乳腺癌患者。 一、检测方法 推荐采用免疫组织化学(immunohistochemistry,IHC)法检测HER2蛋白的表达水平,应用原位杂交(in situ hybridization)法检测HER2基因扩增水平。原位杂交包括荧光原位杂交(fluorescence in situ hybridization,FISH)和亮视野原位杂交。常用的亮视野原位杂交方法有显色原位杂交(chromogenic in situ hybridization,CISH)[12,13]和银增强原位杂交(silver-enhanced in situ hybridization,SISH)[14,15]。上述检测方法各有优缺点,本指南推荐IHC与原位杂交相结合的检测策略。近年来有报道部分HER2基因突变患者也能从抗HER2靶向治疗中获益[16,17],但HER2基因突变检测尚未作为预测HER2靶向治疗疗效的常规检测方法。HER2基因mRNA相关研究也有报道[18],也尚未用于临床常规检测。 二、检测时机及临床病理联系 所有乳腺原发性浸润性癌都应进行HER2检测。只要能获取肿瘤组织,对复发灶和转移灶也应该进行HER2检测。加强临床病理沟通有助于对HER2检测结果的正确诠释和对抗HER2靶向治疗疗效的客观评价。临床医师和病理医师应该注意HER2检测结果是否与组织病理学特征相符,如下列组织学类型通常为HER2阴性,包括组织学分级为Ⅰ级的浸润性导管癌、经典型浸润性小叶癌、小管癌、黏液癌、筛状癌、髓样癌、分泌性癌、低级别腺鳞癌、腺样囊性癌等[9,19]。上述肿瘤如HER2检测结果为阳性,则视为检测结果与组织病理学特征不符合,需要核实诊断或重新检测。 三、HER2检测流程 乳腺癌标本一般可先做IHC检测。IHC 3+判断为HER2阳性,IHC 0和1+则判断为HER2阴性。IHC 2+者需进一步应用原位杂交的方法进行HER2基因扩增状态检测,也可以选取不同的组织块重新检测或送其他实验室进行检测。 四、组织标本的制备 1.标本的类型: (1)手术切除标本;(2)粗针穿刺活检标本;(3)麦默通活检标本;(4)大于100个癌细胞的细胞学标本。 2.标本的固定: 所有乳腺癌标本离体后都应尽快固定(1 h内)。固定时应将标本每隔5~10 mm切开,并可在组织间嵌入纱布或滤纸等物。固定液量与所浸泡组织的比例应足够。固定时间以6~72 h为宜。 3.固定液类型: 3.7%中性(磷酸缓冲)甲醛固定液。 4.组织切片: (1)未染色的切片置于室温不宜超过6周,以防抗原丢失。(2)用于IHC染色者切片厚度以3~5 μm为宜,原位杂交法以4~5 μm为宜。(3)完成检测的切片,IHC和亮视野原位杂交可按常规长期保存,FISH结果应立即照相存档并长期保存,FISH切片建议于-20 ℃保存至少3个月备查。(4)各种检测方法均应有HE染色切片作为比对。 五、染色要求与结果判读 建议使用我国国家药品监督管理局批准的检测试剂盒,对自行组配的检测系统则必须经过严格的内、外部质量控制,建立完善的实验室标准操作程序(SOP),并与权威机构批准的检测试剂盒进行比对,以保证检测结果的可靠性。 (一)IHC 1.观察程序: 应首先在低倍镜下观察整张切片,判断染色是否满意及是否存在HER2表达的异质性。正常乳腺上皮不应出现强的细胞膜着色。只评定浸润癌的着色情况,原位癌的着色不能作为评定对象。当原位癌伴有微浸润时,若IHC切片中能判断微浸润癌的HER2状态,应予以报告。若IHC切片中微浸润病灶过少,难以评估HER2状态时可予以备注。观察细胞膜着色的浸润癌细胞的比例及着色强度,若出现细胞质或细胞核着色提示IHC染色效果不理想或组织处理不佳,建议调整染色条件或更换组织后再行染色。判读时应避开组织边缘及组织处理不佳(如伴明显挤压)的癌组织。 2.结果判断及注意事项: 结果判读标准(按每张切片计;图1):0:无着色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;1+:>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;2+:有2种情况,第一种为>10%的浸润癌细胞呈现弱-中等强度的完整细胞膜染色;第二种为≤10%的浸润癌细胞呈现强而完整的细胞膜染色;3+:>10%的浸润癌细胞呈现强、完整且均匀的细胞膜染色(图2)。对于2+的病例,应该用原位杂交做进一步检测,也可以选取不同的组织块重新检测或送条件更好的实验室进行检测。当出现下列情况时HER2状态为无法判断(indeterminate),包括标本处理不当、严重的组织挤压或边缘效应、检测失败等。应在报告中注明HER2状态无法判断的可能原因,并建议再次获取标本进行HER2检测。在乳腺浸润性微乳头状癌和部分有分泌现象的乳腺癌中,常呈特殊的基底及侧膜U型染色模式。此时若呈现弱-中等强度的细胞膜染色,应判为HER2 2+,并需要行原位杂交检测进一步明确HER2状态[7,9]。若浸润癌的细胞膜已呈很深的棕褐色U型染色,可等同于完整的细胞膜染色[20]。建议HER2的IHC检测报告中包括如下内容:患者信息(包括姓名、性别、年龄、门诊/住院号)、送检医师姓名、送检日期、病理编号、标本部位和类型、抗体类型、检测方法、是否使用图像分析、对照设置情况、样本量是否适合评估、判读结果(0、1+、2+、3+)。
图1 HER2免疫组织化学检测判断标准
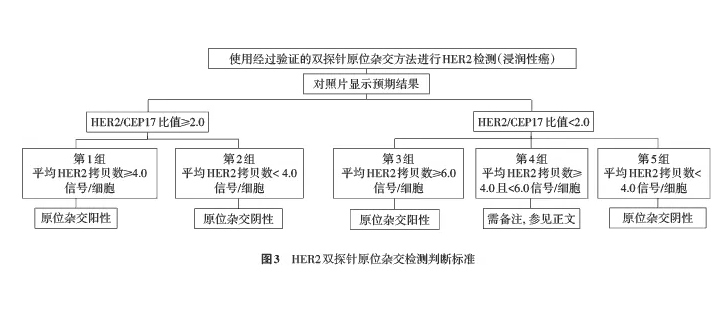
图2 浸润性乳腺癌HER2免疫组织化学染色结果,图A~D分别示0,1+,2+,3+ 高倍放大 3.质量控制: 包括标本的制备、抗体的选择、抗原修复方法、染色及其他相关实验室技术,均应严格按SOP进行。IHC自动染色系统更易达到标准化,但也应进行严格的比对试验和程序优化。IHC染色须设立阳性对照和阴性对照,以不同染色强度的组织芯片作为外对照为最佳。被检测切片中癌旁正常乳腺上皮细胞是很好的阴性内对照。利用计算机图像分析或人工智能有利于判断的准确性和可重复性,但必须经过病理医师确认其结果,且设备使用前必须进行校验。 (二)FISH FISH技术通过荧光标记的DNA探针与细胞核内的DNA靶序列杂交。在荧光显微镜下观察并分析细胞核内杂交于DNA靶序列的探针信号,以获得细胞核内染色体(或染色体片段)上基因状态的信息。目前进行HER2基因状态检测的探针多为同时含有HER2基因和该基因所在的第17号染色体着丝粒(CEP17)序列的双探针,也可采用仅含有HER2基因的单探针。 1.观察程序: 应在低倍镜下观察整张FISH切片,初步判断检测质量(如观察标本内血管内皮细胞、正常乳腺上皮细胞或淋巴细胞信号是否正常)以及是否存在HER2基因扩增的异质性。建议至少在2个代表性区域内计数≥20个浸润癌细胞,细胞数量过少的微浸润灶不宜行FISH检测。可以参照IHC切片先确定可能存在扩增的浸润性癌区域,然后于高倍镜(60倍或100倍物镜)下通过特异通道滤光片观察HER2和CEP17信号,并进行信号计数和比值计算。 2.结果判读及注意事项: 应选择细胞核大小一致、核的边界完整、4′6-二脒基-2-苯基吲哚(DAPI)染色均一、细胞核无重叠、信号清晰的肿瘤细胞进行判读。随机计数至少20个浸润癌细胞核中的双色信号。在观察信号时,应根据情况随时调节显微镜的焦距,准确观察位于细胞核不同平面上的信号以免遗漏。双探针FISH的判读标准分以下5种情况(图3,图4):(1)第1组,HER2/CEP17比值≥2.0,且平均HER2拷贝数/细胞≥4.0:此种情况判为FISH阳性。若众多HER2信号连接成簇时可直接判断为FISH阳性。(2)第2组,HER2/CEP17比值≥2.0,平均HER2拷贝数/细胞2.0,平均HER2拷贝数/细胞≥6.0。此组特殊人群宜有更多循证医学依据的积累[21,22]。(4)第4组,HER2/CEP17比值
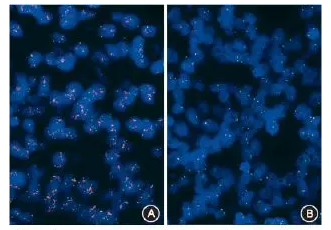
图3 HER2双探针原位杂交检测判断标准
图4 浸润性乳腺癌HER2双探针荧光原位杂交检测结果,图A示阳性;图B示阴性 FISH法 高倍放大 无论上述哪一种情况,若出现IHC与原位杂交检测结果不一致的病例,建议进行多学科讨论,分析原因,并制定相应的治疗策略。必要情况下,还需和患者进行充分的沟通。建议在HER2的FISH检测报告中包括如下内容:患者信息(包括姓名、性别、年龄、门诊/住院号)、送检医师姓名、送检日期、病理编号、标本部位和类型、探针信息、检测方法、是否使用图像分析、对照设置情况、样本量是否适合评估、判读结果(包括评估的细胞数量、平均HER2拷贝数/细胞、平均CEP17拷贝数/细胞、平均HER2拷贝数/平均CEP17拷贝数的比值)、检测结论(如阳性、阴性、需结合IHC结果、无法判读)。 3.质量控制: (1)内对照:使用上述同时含有HER2基因和CEP17序列的混合探针时,组织中≥75%的细胞核显示出双色信号视为杂交成功,并且双色信号互为对照,癌与非癌细胞互为对照。出现下列情况时应视为FISH检测失败,包括:①对照样本未出现预期结果;②浸润癌病灶太小;③可计数信号的细胞10%的荧光信号位于细胞核外;⑤细胞核结构难以分辨;⑥有强的自发荧光。(2)外对照:应选择已知FISH阳性和阴性的标准片(或采用试剂盒提供的对照片)作为外对照,且杂交染色结果与预期相符。(3)如有可能,建议设置低扩增对照。 4.关于第17号染色体数目: FISH双探针检测中加入CEP17探针的目的是为了在检测HER2基因的同时检测第17号染色体数目,从而将第17号染色体的非整倍体与单纯的HER2基因扩增(尤其是低水平扩增)区分开[25]。但近年来的研究显示整条第17号染色体的多体罕见,CEP17的增加并不能代表整条第17号染色体多体[26,27]。部分乳腺癌中第17号染色体存在HER2基因和着丝粒的共同扩增[28]。越来越多的学者认为,与HER2/CEP17比值相比,HER2拷贝数对于HER2基因扩增的判断更为重要[29]。因此在HER2的FISH检测结果中除报告HER2/CEP17比值外,还应分别报告HER2拷贝数和CEP17的数值。有文献报道可使用多个第17号染色体上的其他基因探针替代CEP17进行FISH检测,以此来解决FISH结果特殊的困难病例的判读问题[24,27]。但这种检测经常会由于采用多个不同探针而获得多个不同结果,最后如何综合判断缺乏依据,因此目前不推荐常规应用。 5.关于HER2基因的异质性: 浸润性乳腺癌中HER2表达或扩增可存在异质性。虽然目前HER2基因异质性的临床意义尚不明确,但它可导致IHC与原位杂交、原发灶与转移灶、穿刺标本与手术切除标本的检测结果不一致[30,31]。在原位杂交计数之前,应观察整张切片或使用IHC切片确定可能存在的HER2扩增区域。需要强调的是,即使存在异质性,但只要扩增细胞连续、均质,且占浸润癌10%以上,就应明确报告为原位杂交阳性。可补充报告不同细胞群(>10%)的计数值(包括计数的细胞总数、HER2拷贝数、CEP17数值、HER2/CEP17比值),并报告扩增细胞群占所有浸润癌细胞的比例。 (三)SISH SISH中目前运用最广泛的是双色原位杂交(dual-color in situ hybridization, DISH)[15,32]。在此检测中通过二硝基苯(DNP)标记的探针检测HER2,并利用银染原位杂交DNP染色液进行显色。用地高辛标记探针检测CEP17,采用地高辛红染显色液。可在光镜下观察DISH结果,其中HER2在肿瘤细胞的细胞核中表现为黑色信号,CEP17为红色信号。也可采用仅针对HER2基因的单探针SISH。 1.观察程序: 结合HE染色,选定含有浸润性乳腺癌的靶区进行观察。选定区域内的大部分细胞需同时显示黑色和红色信号,且这些信号没有被非特异性背景染色覆盖。在4倍物镜下扫描整张切片,观察是否存在HER2扩增的异质性以及标本质量。然后于高倍镜(40倍或60倍物镜)下观察结果并进行信号计数和比值计算。建议至少在2个代表性区域内计数≥20个浸润癌细胞。 2.结果判读: (1)应选择细胞核大小一致、核的边界完整、细胞核无重叠、红色和黑色两种信号清晰的细胞。随机计数至少20个浸润癌细胞核中的双色信号。(2)当存在HER2信号簇时,可根据单个拷贝大小估计拷贝数。双探针SISH的判读标准见双探针FISH(图3),单探针SISH的判读标准同CISH(见后文)。报告格式可参照FISH检测。 3.质量控制: (1)内对照:可以乳腺组织中的正常细胞(如成纤维细胞、血管内皮细胞、淋巴细胞、正常乳腺上皮细胞)的HER2信号和CEP17信号作为内对照。出现下列情况时应视为检测失败,包括:①对照未出现预期结果;②浸润癌病灶太小;③缺乏红色染色或黑色染色;④斑点伪影干扰计数;⑤严重消化过度或细胞核中空泡干扰计数;⑥非特异性背景染色强,干扰计数。(2)外对照:建议在每次染色过程中都加入阳性和阴性对照,以用于确认试剂质量和仪器功能。 (四)CISH 在CISH检测中多使用地高辛标记的探针,在石蜡切片上进行原位杂交反应,再用鼠抗地高辛抗体和辣根过氧化物酶-抗鼠抗体进行免疫结合,二氨基联苯胺显色后,在普通显微镜亮视野下观察HER2基因信号。也有关于双探针CISH的报道。CISH检测可以同时显示基因状态与组织形态学,且检测切片可长期保存。 1.观察程序: 结合HE染色,选定含有浸润性乳腺癌的靶区进行观察,区域内的大部分细胞需有棕色信号,且这些信号没有被非特异性背景染色覆盖。在低倍镜下观察整张切片,确定标本质量及是否存在HER2扩增的异质性。然后于高倍镜(40倍或60倍物镜)下进行信号计数。建议至少在2个代表性区域内计数≥20个浸润癌细胞。 2.结果判读: (1)应选择细胞核大小一致、核的边界完整、细胞核无重叠、信号清晰的细胞。随机计数至少20个浸润癌细胞核中的HER2信号。(2)判读标准:肿瘤细胞平均HER2拷贝数/细胞 3.质量控制: (1)内对照:可以乳腺组织中的正常细胞(如成纤维细胞、血管内皮细胞、淋巴细胞、正常乳腺上皮细胞)的HER2信号作为内对照。出现下列情况时应视为检测失败,包括:①对照未出现预期结果;②浸润癌病灶太小;③缺乏细胞核内的棕色信号;④严重消化过度或细胞核中空泡干扰计数;⑤非特异性背景染色强,干扰计数。(2)外对照:建议在每次染色过程中都加入阳性和阴性对照(可采用试剂盒提供的质控对照片),用于确认试剂质量和仪器功能。 六、实验室要求 HER2蛋白和基因扩增的检测均应在内、外部质量控制良好的病理实验室进行,必须严格按照指南要求的程序操作,以保证结果的可靠性和准确性。不具备HER2检测条件的单位应按照指南规定妥善地准备好标本,提供给有质量保证的病理实验室进行检测。实验室内、外部质量控制和SOP的主要要求如下。 1.开展乳腺癌HER2检测的实验室有责任确保其检测结果的可靠性和准确性。无论哪一种检测方法的开展均需要通过严格的比对验证,也可通过参加有关外部质量控制活动(建议每年进行1~2次)来实现。 2.内部质量控制工作包括定期对相同组织的不同批次染色结果进行重复性分析,每次染色设置阳性、阴性对照,如有可能还应设置低表达/低扩增对照。检测相关的仪器和设备需定期维护、校验。 3.应建立完善的SOP,并做好检测情况的记录和存档工作。 4.任何操作程序和试剂的变化均应重新进行严格的比对验证。 5.从事乳腺癌HER2检测的技术人员和病理医师应进行必要的培训和能力评估。 总之,准确的HER2检测是保障乳腺癌患者得到正确治疗的基石。影响HER2检测的各种因素贯穿于检测前、检测中及检测后的多个环节,规范化的操作程序和标准化的结果判读能提高HER2检测的准确性和可重复性。在HER2检测过程中一定要重视多学科合作的重要性,加强临床与病理的沟通交流有助于对HER2检测结果的正确判断及对治疗疗效的客观评价。 《乳腺癌HER2检测指南(2019版)》编写组成员 《乳腺癌HER2检测指南(2019版)》编写组成员(按拼音字母顺序排列):白雪峰、鲍炜、步宏、曹友德、柴晓菲、常秀青、陈定宝、陈刚、陈林莺、崔树德、邓永键、邓云特、丁华野、方娜、冯振博、付丽、高鹏、高雪、郭德玉、郭凌川、郭双平、韩静绮、何洁华、何向蕾、赫淑倩、胡骏、胡夕春、黄波、黄传生、贾影、江泽飞、孔令非、郎荣刚、郎志强、李惠翔、李金范、李挺、李晓梅、李新军、梁锐、梁智勇、刘斌、刘冬耕、刘健、刘梅、刘霞、刘毅强、刘月平、刘志红、柳剑英、陆元志、路喜安、马韵、孟刚、牟坤、聂秀、牛昀、戚基萍、瞿伟、任国平、任国胜、阮秋蓉、邵牧民、邵志敏、沈丹华、师永红、石慧娟、水若鸿、孙文勇、孙兴旺、汤红平、唐峰、滕晓东、王超、王成勤、王聪、王鸿雁、王宽松、王丽霞、王明华、王强、王晓稼、王妍、王永胜、魏兵、翁阳、邬黎青、吴炅、吴焕文、肖秀丽、徐兵河、徐承平、徐方平、徐澍、薛德彬、薛卫成、杨承纲、杨华、杨举伦、杨荣、杨文涛、杨雯娟、杨向红、杨映红、姚敏、于宝华、袁静萍、曾瑄、张帆、张清富、张庆慧、张巍、张祥盛、张雨涛、张璋、张智弘、郑闪、郑唯强、周珏、周晓燕 参考文献略 免责声明:本指南只代表本编写组观点,供各临床病理实验室结合各单位实际情况参照使用。随着科学知识的迅速发展,在本指南出版或更新之前可能出现新的证据。本编写组不对因使用本指南而引起的直接或间接损失承担任何责任。 执笔作者:杨文涛(复旦大学附属肿瘤医院)步宏(四川大学华西医院) 通信作者:步宏([email protected]) 原文参见:中华病理学杂志. 2019;48(3):169-175. |
【本文地址】
今日新闻 |
推荐新闻 |