基础免疫学:B细胞发育及其调控分子 |
您所在的位置:网站首页 › 免疫学细胞因子是什么 › 基础免疫学:B细胞发育及其调控分子 |
基础免疫学:B细胞发育及其调控分子
|
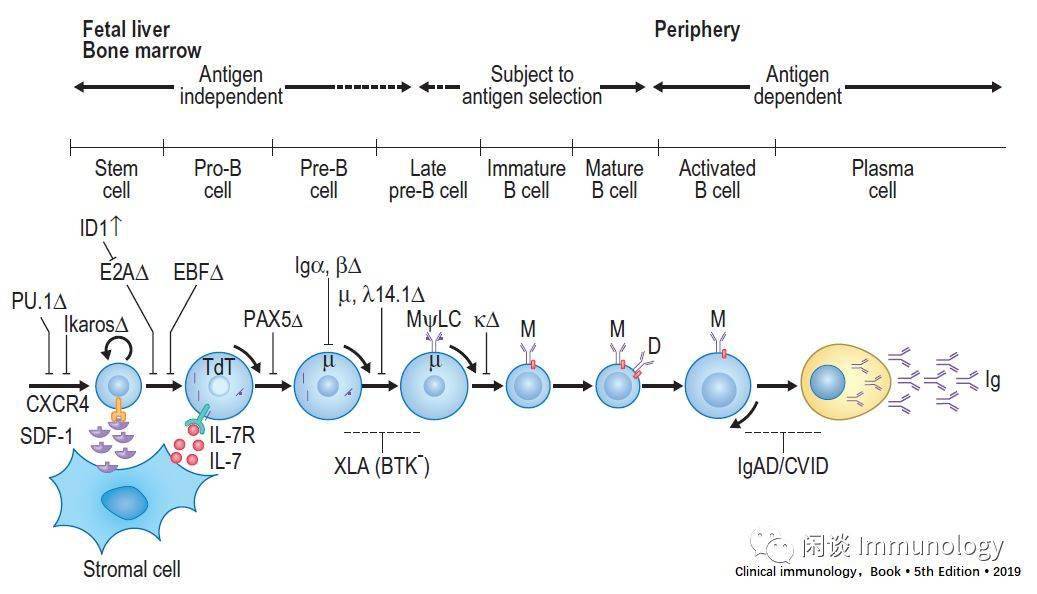
产生功能BCR是B细胞发育的关键 Ig重排是分阶段完成的,在Pre-B细胞,先是重链重排DH和JH先重排,DJH,然后VH加入为VH-DJH,再之后在Pre-B细胞晚期啊,轻链VL和JL加入。 完整功能的B细胞受体(BCR)的产生对于preB及后期的发育都是至关重要的。 成功形成稳定的前BCR后,终止进一步的H链重排(等位基因重排),随后是四到六个周期的细胞分裂,这一过程与细胞大小的逐渐减少有关。 表达自身反应型IgM抗体的未成熟B细胞,可重新进行轻链重排,以降低抗体的自身反应性,所述过程称为 受体编辑。 成功产生可接受的IgM BCR的未成熟B细胞,延申重链基因座转录到Cδ外显子下游Cμ。替代剪接允许联合生产IgM和IgD。这些新成熟的IgM+IgD+B细胞进入血液并迁移到外周,在那里他们形成了脾脏和其他次级淋巴器官中的大部分B细胞池。这些细胞中的每一个IgM和IGD共享相同的可变结构域。 酪氨酸激酶在B细胞的发育中起重要作用 通过BCR传导的信号对于B细胞发育是必需的。Brutton酪氨酸激酶(BTK)是在BCR信号中使用的磷脂酶C型(PCLγ))途径的重要组分。BTK功能缺失导致人B细胞发育阻滞于前B细胞期,是X-连锁无丙种球蛋白血症(XLA)的遗传基础。 BLNK是一种SRC同源性2(SH2)结构域的信号转导适配器.当SYK磷酸化时,BLNK作为用于组装细胞活化靶的支架,所述细胞活化靶包括Grb2、VAV、NCK和磷脂酶C-[γ](PLCγ)。BLNK中的LOF突变可导致PreB和成熟B细胞的丢失,从而导致无丙种球蛋白血症。Flt3(Flk2)是属于与C-FMS相同的家族的受体酪氨酸激酶,是集落刺激因子-1(CSF-1)的受体。 与B细胞发育相关的细胞表面抗原 B细胞的发育与表面蛋白级联的表达有关,每一种蛋白在细胞的命运中都起着关键的作用。这些蛋白质出现的时间可以用来进一步分析B细胞的发育过程。 CD34是一种高度糖基化的I型跨膜糖蛋白,能与CD62L(L-选择素)和CD62E(E-选择素)结合,从而有助于细胞的转运。它在包括造血干细胞(HSCs)在内的一小部分骨髓细胞(1-4%)上表达。 CD10也称为Neutrilysin、中性内肽酶和常见的急性淋巴细胞性白血病抗原(CALLA),是II型膜糖蛋白金属蛋白酶。CD10有一个短的N端细胞质尾,一个信号肽跨膜结构域和一个胞外C端结构域,其中包括6个N链糖基化位点。胞外结构域包含12个半胱氨酸,其二硫键有助于稳定其锌结合的五肽基序,该结构域参与了锌依赖性金属蛋白酶的催化活性。由于它的蛋白酶活性,它被认为是下调细胞对肽激素和细胞因子的反应。对骨髓基质细胞CD10活性的抑制促进了B细胞的成熟。CD10(CALLA)作为急性淋巴细胞白血病(ALL)和某些淋巴瘤的标记物。 CD19是免疫球蛋白超家族(IgSF)的一种细胞表面糖蛋白,在B细胞从原细胞期到浆细胞期的整个发育过程中都有表达。CD19存在于CD21(补体受体2:CDR 2)、CD 81(TAPA-1)和Leu13的复合物中。在CD21的帮助下,CD19可与补体C3裂解产物C3d结合。同时,SIgM和CD19与C3d抗原复合物结合,使CD19和BCR相互作用,从而提供先天和适应性免疫反应之间的联系。CD19-BCR相互作用允许细胞减少需要刺激的抗原受体的数量来激活细胞。协同激活还降低了B细胞对特定抗原的增殖所需的阈值。CD19的胞浆结构域包含9个保守的酪氨酸残基,磷酸化后,CD19与PI-3K和酪氨酸激酶VAV结合。缺乏CD19的患者血液中CD20B细胞数正常,但存在全低血球血症,易受体外循环感染。 CD20包含四个跨膜结构域和细胞质C-和N-末端。它是白细胞表面抗原CD20/FcεRIβ超家族的成员。差分磷酸化产生三种形式的CD20(33KD,35KD,37KD)。活化的B细胞增加了35KDa和37 kDa抗原。 CD20似乎是调节细胞周期进程的B细胞钙通道亚单位.它可以直接与MHCⅠ、Ⅱ类分子,以及其他四种跨膜结构域蛋白(称为TM4SF)的成员相互作用。它似乎也间接与LYN,FYN和LCK相互作用。CD20缺乏的患者,B细胞数目正常,循环记忆B细胞减少,IgG低,IgM和IgA正常,躯体高突变(SHM)减少。利妥昔单抗是1997年批准单克隆药物,针对CD20,通常用于治疗某些自身免疫性疾病和淋巴肿瘤。 CD21(补体受体2[CR2])是一种细胞表面蛋白,包含一个小的细胞质结构域和一个由一系列短的一致重复序列组成的胞外结构域,称为补体控制蛋白(CCP)结构域。这些胞外结构域可结合补体C3裂解、iC3b、C3dg和C3d三种不同的产物。当与这些产物结合时,CD 21作为CD19-CD21-CD81复合物的配体结合亚基,将天然免疫系统与适应性免疫反应结合在一起。 CD24是一种糖基-磷脂酰肌醇(GPI)连接的唾液蛋白,作为P-选择素(CD62P)的配体.它在祖细胞、未成熟的B细胞和成熟的B细胞上表达。它在活化的B细胞中表达减少,在浆细胞中完全丧失。抗CD24单克隆抗体抑制人B细胞向浆细胞的分化。 CD38是一种双功能酶,将NAD+合成cADPR,并将cADPR水解成ADP-核糖。CD38表达于preB细胞、活化B细胞和早期浆细胞,但不在未成熟或成熟B细胞或成熟浆细胞上表达。CD38抗体可抑制B淋巴细胞生成,诱导B细胞增殖,并保护B细胞免于凋亡。 控制B-细胞分化的转录因子 PU.1属于环-螺旋-环转录因子ETS家族,它与富含嘌呤的DNA序列结合。在B细胞中,PU.1调控许多关键基因,包括CD79a(Igα)、J链、μ链、κ链、λ链、RAG 1和末端脱氧核苷酸转移酶(TDT)。ETS家族成员是相对弱的转录激活因子,并且通常需要存在其它因素来激活或抑制它们的靶基因。 Ikaros和 Aiolos属于锌指转录因子家族。虽然两者在淋巴发育过程中都有表达,但Ikaros在干细胞和成熟淋巴细胞中表达,而Aiolos只在有向B细胞谱系发育后才表达。Ikros转录物受到交替剪接。它可以产生几种亚型,每种亚型在其DNA结合模式、二聚化倾向和核定位方面不同。 E2A位点编码两个基本螺旋-环-螺旋转录因子,E12和E47。E2A的靶点包括RAG-1和TDT。虽然E12和E47的功能重叠,但E47似乎在驱动TDT和RAG-1中起着更大的作用,而E12是EBF和PAX 5的更好的激活剂,从而帮助发育中的细胞向B细胞谱系转移。 ID-1具有螺旋-环-螺旋域,但缺少DNA结合域。因此,它可以作为结构域副调节因子,抑制螺旋-环-螺旋转录因子如E2A的功能。 EBF或早期B细胞因子是螺旋-环-螺旋样转录因子。它在除浆细胞以外的所有分化阶段表达。 PAX5是一个配对盒,或结构域,转录因子,在HSCs的后代中,在B细胞谱系的细胞中表达。PAX5对B细胞的分化既有正效应,也有负作用。 参与B细胞发育的miRNA miRNA是一种小的、非编码的RNA,其在转录后水平下调靶基因。miR-150, miR-155, 和miR-17-92可能在B细胞的早期和后期发育都有作用。这些miRNAs功能异常可能与肿瘤的发生和免疫功能障碍有关。 调节B细胞发育的细胞因子、趋化因子、和激素 基质细胞为B细胞发育和分化提供微环境,趋化因子 CXCL12,也被称为Preb-细胞生长刺激因子和基质细胞衍生因子-1(PBSF/SCF-1),促进prob-细胞增殖。 虽然在小鼠白, IL-7在B-谱系分化中起着重要作用,但在人类中,其对人B细胞祖细胞具有微弱的增殖作用。然而,IL-7增强CD19表达,这在BCR信号转导中起重要作用。人proB细胞的IL-7治疗也导致RAG-1、RAG-2和TDT的表达减少。因此IL-7可以调节人的Ig基因片段重排的过程。 干扰素-α和-β( IFN-α/β)通过诱导凋亡,抑制IL-7诱导B-谱系细胞生长,是骨髓巨噬细胞是其来源。另一种巨噬细胞衍生细胞因子 IL-1也可作为B淋巴细胞发生的剂量依赖性的阳性或阴性调节因子. 全身 激素也调节淋巴细胞生成。怀孕期间Pre-B细胞的减少提示了性激素的作用。雌二醇还能改变B细胞发育的后期,促进边缘区(MZ)室的扩张。催乳素似乎增强了MZ和卵泡B细胞的生产。
外周B细胞发育 表达表面IgM和IgD的成熟B细胞的寿命完全取决于抗原选择。离开骨髓后,未受刺激的细胞只存活几天。 BAFF和APRIL在成熟B细胞发育中的关键作用 B细胞在初次成熟的同时离开骨髓,随着IgM的降低,IgD的表达水平逐渐升高。脾环境在成熟过程中起着关键作用。移入性脾成熟B细胞经历两个过渡阶段,即过渡期1(T1)和过渡阶段2(T2)。这些细胞中只有一小部分成功地完成了这一转变,这一分化步骤是控制自我反应性的关键检查点。 通过这个检查点需要肿瘤坏死因子(TNF)家族的可溶性B细胞活化因子(BAFF)与其受体BAFF-R相互作用,BAFF-R主要在B细胞上表达。 通过BCR与自身抗原的相互作用触发的死亡信号可以通过刺激BAFF-R来抵消,从而增强生存因子的表达,如Bcl-2,同时下调促凋亡因子。 BAFF和第二个TNF家族成员APRIL(一种增殖诱导配体)是B细胞发育和长期维持的基本因素。 参考文献返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |