从ICH Q3D元素杂质指导原则欧美药典实施历程探索《中国药典》转化路径 |
您所在的位置:网站首页 › 元素杂质限度规定ICHQ3D › 从ICH Q3D元素杂质指导原则欧美药典实施历程探索《中国药典》转化路径 |
从ICH Q3D元素杂质指导原则欧美药典实施历程探索《中国药典》转化路径
|
ICH Q3D; elemental impurities; pharmacopoeia; implementation; guideline
元素杂质包括可能存在于原料药、辅料或制剂中的催化剂和环境污染物,主要是指药品生产或贮藏过程中生成、加入或无意引入的物质。由于某些元素杂质具有毒性,还可能对药品的稳定性、保质期产生不利影响,或可能引发有害的不良反应 [1-2] ,故世界各国药品监管机构对药品元素杂质的控制越来越严格。ICH Q3D 元素杂质指导原则被认为是目前变化比较复杂的法规之一,这主要是由于目前全球对如何评估或量化辅料(水)、包装系统等风险因素认识有限,难以确定哪些风险因素通过科学评估需要提供数据,或可忽略不计。当经风险评估确定须要进行元素限度测定时,又需要采用专属性更强、灵敏度更高的新分析技术,这进一步增加了实施的复杂性。过去10 年间,欧美药典出台了一系列举措,来贯彻Q3D 在本区域内的实施。本文综述了欧美药典实施Q3D 的历程,旨在为《中国药典》转化Q3D 提供借鉴和参考。
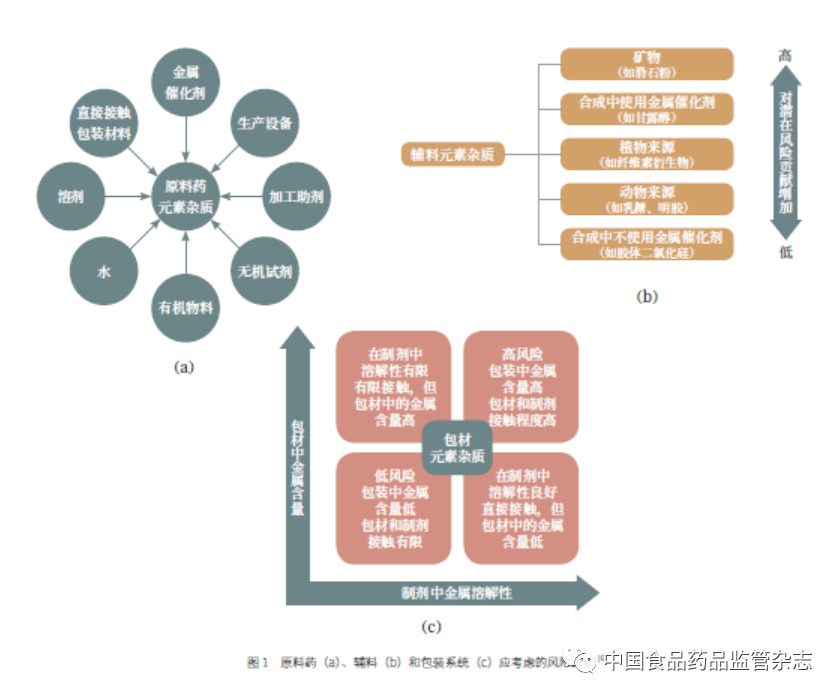
01 ICH Q3D 简介 1.1 背景、目的与意义 近年来,元素污染的风险因素发生了变化。随着药品生产过程中催化剂和试剂的应用日益广泛,药品合成中使用的低水平催化剂和试剂残留的问题日益突出,导致了药典中重金属检查法的不适用。重金属检查法主要控制铅、铜等金属,不是针对低水平金属催化剂和试剂残留设计的,专属性弱、灵敏度低,不能对单个元素杂质进行定量分析,已不能满足药品安全性控制的需要 [2-3] ,所以《美国药典》(USP)在2008 年提出了元素杂质控制理念。Q3D 为药品中的元素杂质定性和定量控制提供了全球性政策,帮助企业通过风险评估来判断对哪些元素进行额外控制,为药品制订合理的元素限度,同时促进元素分析方法的现代化。 1.2 发展历程 2009 年10 月,ICH 批准制定Q3D。2014 年11 月,Q3D 被最终确定并正式对外发布。2016 年,Q3D 增加了培训模块,欧盟和北美区域开始实施。2019 年3 月,Q3D(R1) 正式执行。2020 年9月,ICH 发布了Q3D(R2)第二阶段草案,公示征求意见。该草案修订了Q3D(R1)附录2 金、银、镍的允许日暴露量(permitted daily exposure,PDE),附录3 金、银的安全性评估内容。此外还新增附录5,介绍了皮肤和透皮给药途径各元素杂质限度的考虑。附录5 适用于局部或全身作用的皮肤和透皮药品,不适用于黏膜给药(口服、经鼻、阴道)、眼科外用、直肠或皮下和真皮给药途径。经皮肤吸收进入体循环的程度(全身吸收)是元素安全性评估的重要组成部分。附录5 介绍了利用皮肤修饰因子(CMF)和注射给药途径各元素杂质的PDE 计算皮肤给药途径各元素杂质的 PDE 的方法。从Q3D 的文件历史看,实质性的修订包括2013 年将钨和铝分别从2B 类和3 类元素杂质中删除、镍的分类由2 类变为3 类、全文中的“metal”替换为“elemental”(包括砷、硒等非金属元素),2019 年修订镉吸入途径PDE 为0.3μg/g[4] 。目前,Q3D 的实施已拓展到欧盟、美国、日本以外的市场范围,各国药典正处于实施阶段。 1.3 主要内容 1.3.1 适用范围 Q3D 适用于新制剂以及含已上市原料药的新制剂(但实际的风险评估涉及药品生产的所有方面),包括纯化蛋白和多肽(含重组或非重组来源的蛋白和多肽)及其衍生物,以及以它们作为组分的药品(如偶联物),还包括含化学合成多肽、多聚核苷酸、寡糖的药品。Q3D不适用于植物药、放射性药物、疫苗、细胞代谢产物、DNA 产品、过敏原提取物、细胞、全血、血细胞成分或包括血浆及血浆衍生物在内的血液衍生物、非体循环透析液以及为了治疗作用而特意添加到药品中的元素,也不适用于基于基因(基因治疗)、细胞(细胞治疗)和组织(组织工程)的药品。在颁布Q3D 的36 个月内(即2017 年11 月前),已上市药品无需实施Q3D。 1.3.2 元素杂质分类 Q3D 为口服、注射、吸入制剂中的24 种元素杂质建立了PDE,同一元素不同给药途径对应不同的PDE。考虑元素杂质的毒性、出现的概率和引发风险的高低,24 种元素杂质被分为3 类。1 类元素为砷、汞、铅、镉,需要对所有剂型和来源进行风险评估。2 类元素根据其出现的概率,分为2A 类和2B 类:2A 类包括钴、镍、钒,其出现概率相对较高,应对所有的给药途径进行评估;2B 类元素出现的概率较小,除非是特意加入的,一般不需要进行风险评估。3 类元素口服给药途径的毒性相对较低,但在吸入和注射给药途径的风险评估中仍需考虑。此外,Q3D 还提到其他元素,包括铝、硼、钙、铁、钾、镁、锰、钠、钨和锌。这些元素由于毒性低或区域监管的差异,未被确定PDE 值。如果药品中存在这些元素,应遵从相关指导原则和地方法规。比如,美国FDA 发布的21CFR 201.323 文件中规定,在全静脉营养液中铝的含量不能高于25μg/L [5] 。 1.3.3 元素杂质风险评估
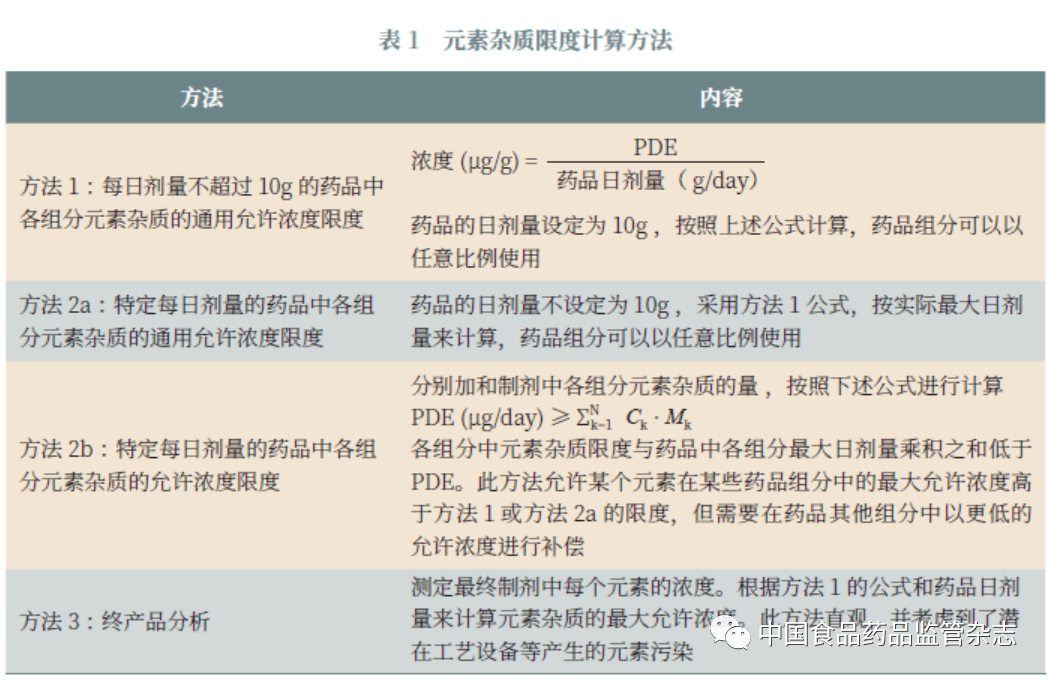
1.3.4 元素杂质限度计算方法 Q3D 给出了4 种元素杂质的限度计算方法(表1)。方法的选择应由制剂生产商根据自身产品选择决定。
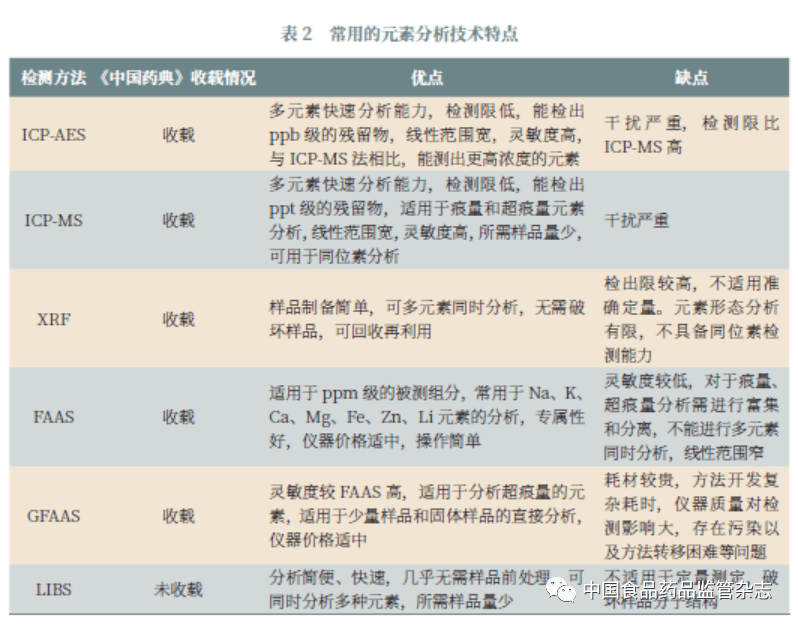
1.3.5 元素杂质分析方法 Q3D 中的元素杂质限量标准,对分析方法的灵敏度和专属性提出了更高的要求。但是Q3D 并未提供分析方法,只是要求分析方法具有专属性,可采用药典方法或其他适合的方法测定元素杂质水平。 1.4 实施挑战
02 各国药典的实施方式
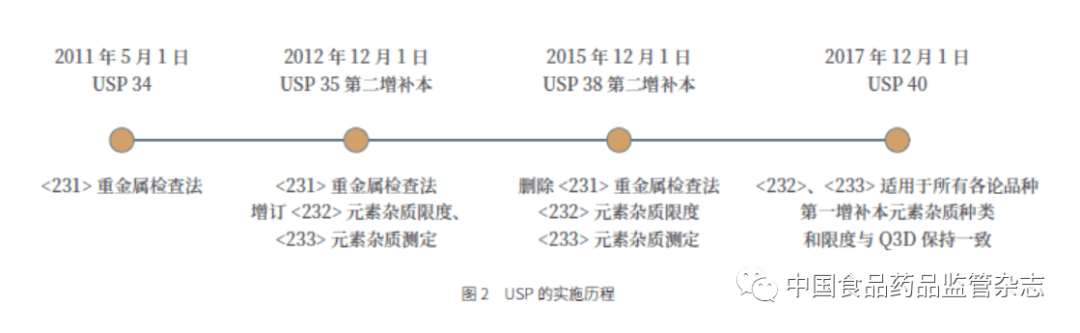
2.1 USP 的实施 2.1.1 USP 的实施历程
2.1.2 通则 元素杂质限度
2.1.3 通则 元素杂质测定
2.1.4 通则、 引发的其他通则的修订
2.1.5 辅料各论中特定元素杂质的实施
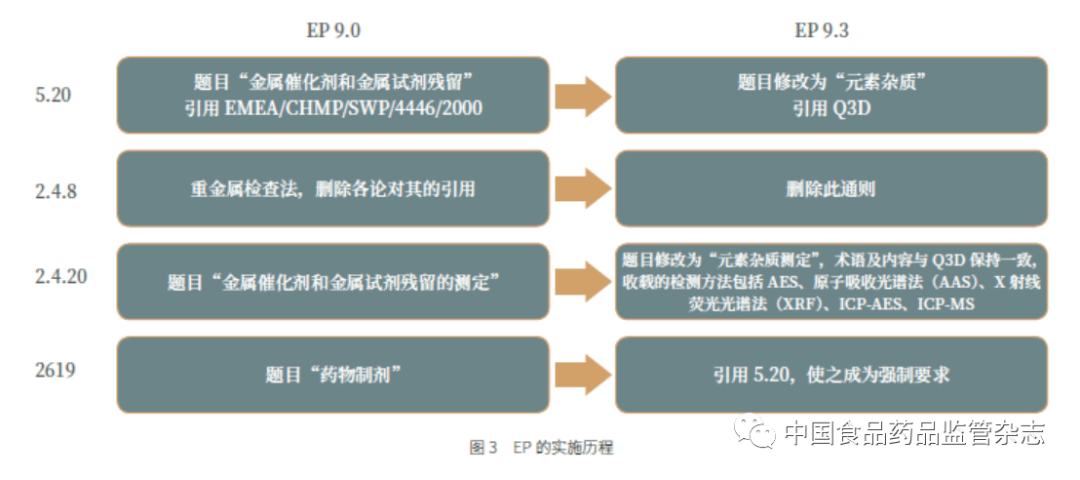
2.2《 欧洲药典》(EP)的实施 2.2.1 EP 的实施历程
2.2.2 通则2.4.20 元素杂质测定
2.2.3 通则2.4.27 草药和草药制剂中的重金属
2.2.4 天然来源辅料的实施
03 《中国药典》的转化
3.1 通则的转化
3.2 各论的转化
04 小 结
【来源:中国食品药品监管杂志】 免责声明: 本文信息部分内容来自网络文章,不保证所有信息、文本、图形、链接及其他项目的绝对准确性和完整性,故仅供访问者参照 使用。如您(单位或个人)认为本文某部分内容有侵权嫌疑,敬请立即通知我们,我们将在第一时间予以更正或删除。以上声明之解释权归本公众号所有。法律上有相关解释的,以中国法律之解释为基准。如有争议限在我方所在地司法部门解决。谢谢。 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |