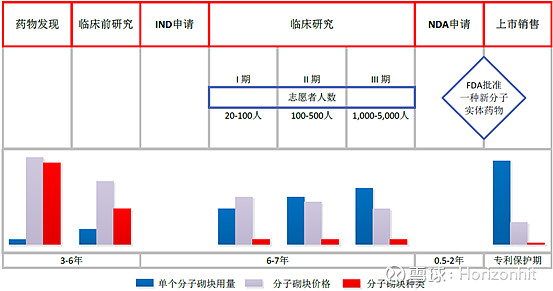
新药审批二三事 1 新药研发流程由上图可知,从需求出现到批量上市销售需要经过六大阶段,其中药物发现为科研院所或者药企自己做研发。临床前研... |
您所在的位置:网站首页 › 仿制药药物研发流程 › 新药审批二三事 1 新药研发流程由上图可知,从需求出现到批量上市销售需要经过六大阶段,其中药物发现为科研院所或者药企自己做研发。临床前研... |
新药审批二三事 1 新药研发流程由上图可知,从需求出现到批量上市销售需要经过六大阶段,其中药物发现为科研院所或者药企自己做研发。临床前研...
|
来源:雪球App,作者: Horizonhit,(https://xueqiu.com/4144205621/127994189)  1 新药研发流程 1 新药研发流程
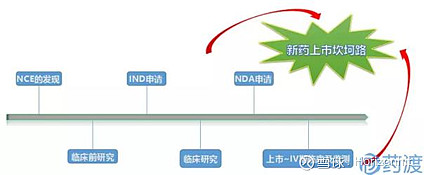
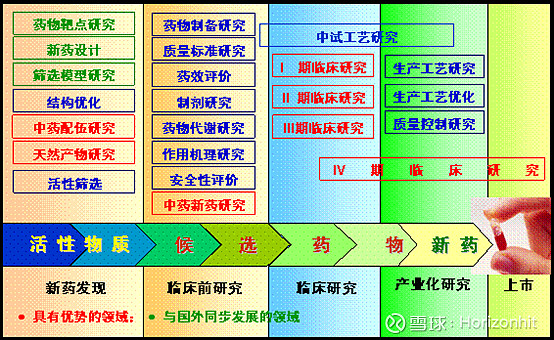
由上图可知,从需求出现到批量上市销售需要经过六大阶段,其中药物发现为科研院所或者药企自己做研发。 临床前研究是为了保证新药在人体上使用时的安全性和有效性,即保证安全的前提下且有较好的治疗效果,该阶段的研究主要包括药学研究、药效学研究、安全性研究、药动力学研究。 而涉及到国家药品监督管理局把关的则是临床研究和上市许可
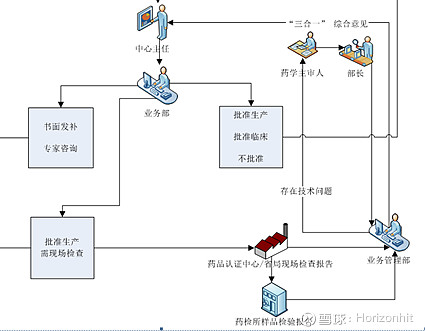
通过评审的终点即可看出
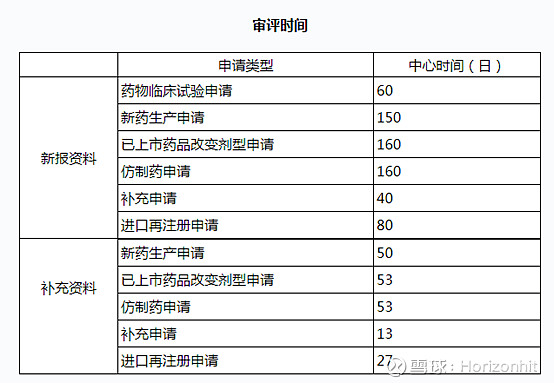
CDE对各种审批有明确的时间规定
并且去年新出的文件法规规定,临床试验申请缴费60天后依然没有收到评价结论的,可以自行开展临床试验
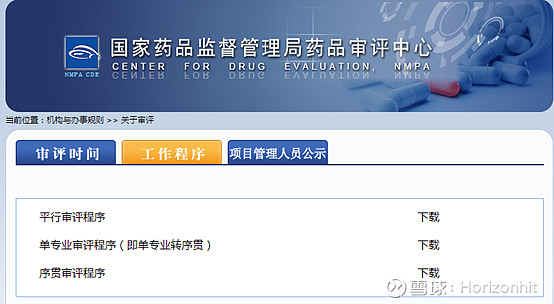
以上流程并不单独针对药品,在CDE网站上我们可以看到有三大类
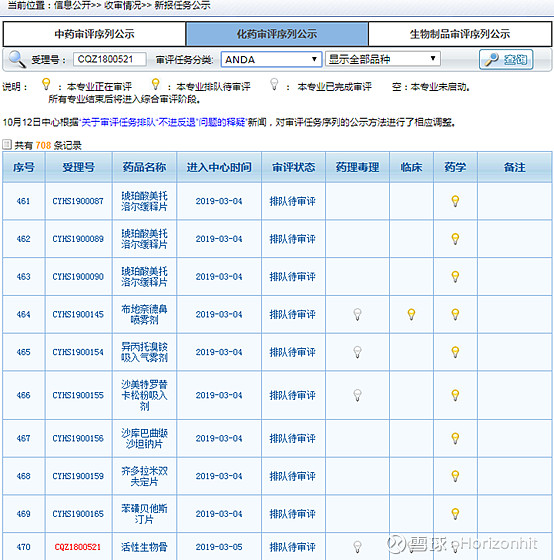
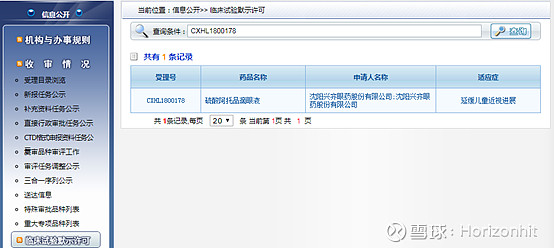
这也是为啥正海生物的活性生物骨也在CDE网站上评审的原因。 我们查阅正海生物的活性生物骨,发现在任务分类的ANDA里面才能找到
查阅结果如下所示
那么就说明正海生物的这个活性生物骨是ANDA类型的,而IDA、NDA和ANDA分别表示什么意思呢? INA:Investigational New Drug,IND主要目的是提供足够信息来证明药品在人体进行试验是安全的,以及证明针对研究目的的临床方案设计是合理的。IND主要包括Ⅰ、Ⅱ、Ⅲ期临床试验申请,其中Ⅰ、Ⅱ期临床试验为初期临床试验,是疗效的探索阶段;Ⅲ期临床试验为扩大临床试验,是疗效的验证性阶段,只有在初期临床试验IND获准后,申请人才可以提交扩大临床试验申请。详细的介绍在一文读懂什么是IND、NDA、ANDA可以看到,这里不再展开做详细解读。总的来说IND是跟临床Ⅰ、Ⅱ、Ⅲ期挂钩的,距离上市还差两步。 NDA:New Drug Application是指未曾在中国境内上市销售的药品的注册申请,下图也可以看出NDA与IDA的关系,也就是说完成NDA了就可以申请上市了,依据时间快慢,可能半年到两年左右。
ANDA:Abbreviated New Drug Application简略新药申请,ANDA的申请即为“复制”一个已被批准上市的产品。其中,这里的“复制”是指其与该上市药品具有相同的活性成分、剂型、规格、服用方式及适应症等。仿制药申请被称为简短的 (abbreviated),是因为这类申请不需要提供临床前(动物)和临床(人体)数据来证明其安全性和有效性。取而代之的是,仿制药申请者必需提供产品生物等效性的证明材料(比如与原研药相比没有区别)。一旦此类药品获得批准,申请者可以生产并上市这一安全有效且价格低廉的替代物。简单说就是仿制药。 我们回看新报材料的仿制药申请周期为160天,正海生物5月14号的调研信息显示,活性生物骨于2018年11月获得CDE受理,那么假定11月底受理,最慢也到5月底(粗算6个月,180天)会完成ANDA审批,这也与最近的三盏灯全灭时间点对应上。 根据以上的流程图,可以看出NDA或者ANDA获批之后就可以上市了,虽然流程上写的有Ⅳ期临床,但是那是上市之后的跟踪调查。 这里补充一个之前报道的非瘟疫苗研发提到的“中试”,对应的流程阶段如下
2 药物类型 既然是ANDA,那么就说明不是创新药,不同药物等级对应着不同的市场空间,之前研究药石科技的时候做过这方面的研究,直接抄过来: 首先从“仿制”转型为“创新”,即从研制“me-too”做起,如恒瑞医药的艾瑞昔布是“me-too”类药物; 第二步是“me-better”:围绕原NCE结构基础上进行二次创新,虽然有结构上仿的特点,但更有创造其自身独特优势的地方,素有“国产易瑞沙”之称的浙江贝达药业的埃克替尼、抗肿瘤作用优于同类药物PTK787(诺华和德国先灵联合研发)的恒瑞医药的阿帕替尼都属于此类药物; 第三步是“best-in-class”(BIC):是“me-better”里更强的一个,例如辉瑞的立普妥; 第四步就是“first-in-class”(FIC)药物:即全新化合物,同时靶点也是新的,此类药物研发风险极高,但成功者也是有不少,获得诺贝尔奖的青蒿素就属于此类。 而FIC药物是我国从医药大国变为医药强国的重要途径。 这里直接选取近期炒作过的几个标的对应的药的做下简答分析。 正海生物: 活性生物骨在原有的基础上添加了骨形态发生蛋白(BMP),并有望成为市场上首个含BMP类骨修复材料。
姑且算一个me-better的产品,因为国内空白,享有先发优势。 兴齐眼药: 主要是阿托品滴眼液,雪球有简单粗暴的估算
这药也确实还在临床试验挣扎,到转身为价值驱动型还有的等。 冠昊生物 苯烯莫德属于1.1类新药,关于一类新药,百科解释为在国内外均未上市过的新药,那么就属于FIC,先发优势满满。 在二期临床时就被3.3亿美金买断海外权益,可以侧面证实其市场空间。 在成本文的期间,正好看到康泰生物出了一则公告:
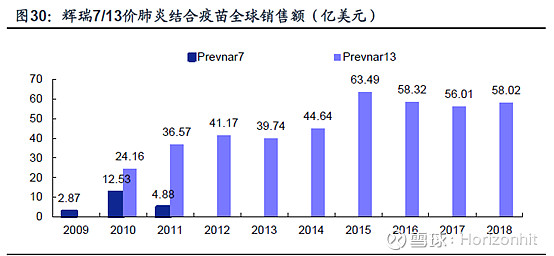
13价疫苗的市场空间在我研究康泰生物的文章里面给了:市场空间较大
券商预计“2019年1月17日公司公告,13价肺炎球菌结合疫苗已完成临床3期数据的揭盲工作,在获得临床研究总结报告并在符合GMP的车间连续生产三批上市规模的合格品后即可报产,我们预计上半年有望完成此项工作并于2020年底前获批上市。” 目前来看应该是符合预期,明天预计也就一个高开了事。 |
【本文地址】
今日新闻 |
推荐新闻 |