为什么中国PD |
您所在的位置:网站首页 › 什么是非劣性研究 › 为什么中国PD |
为什么中国PD
|
来源:雪球App,作者: 斛芸贞谈医论股,(https://xueqiu.com/9956679466/242572338) (一)美国🇺🇸一个大众忽视的事实是, 尽管默沙东K药,百时美施贵宝O药,罗氏T药,阿斯利康I药也都获批用于IV期NSCLC(非小细胞肺癌)的PD-1/PD-L1单抗一线治疗。 但是, 默沙东K药做了两个III期临床研究,才获批了用于鳞癌和非鳞癌一线治疗。 百时美施贵宝O药联合伊匹木单抗(CTLA-4)才获批,且之前曾在2个III期临床研究中失败。 罗氏T药只获批用于非鳞癌一线,且之前曾在2个III期临床研究中失败。 阿斯利康I药联合替西木单抗(CTLA-4)才最终获批,且之前在5个III期临床研究中失败。 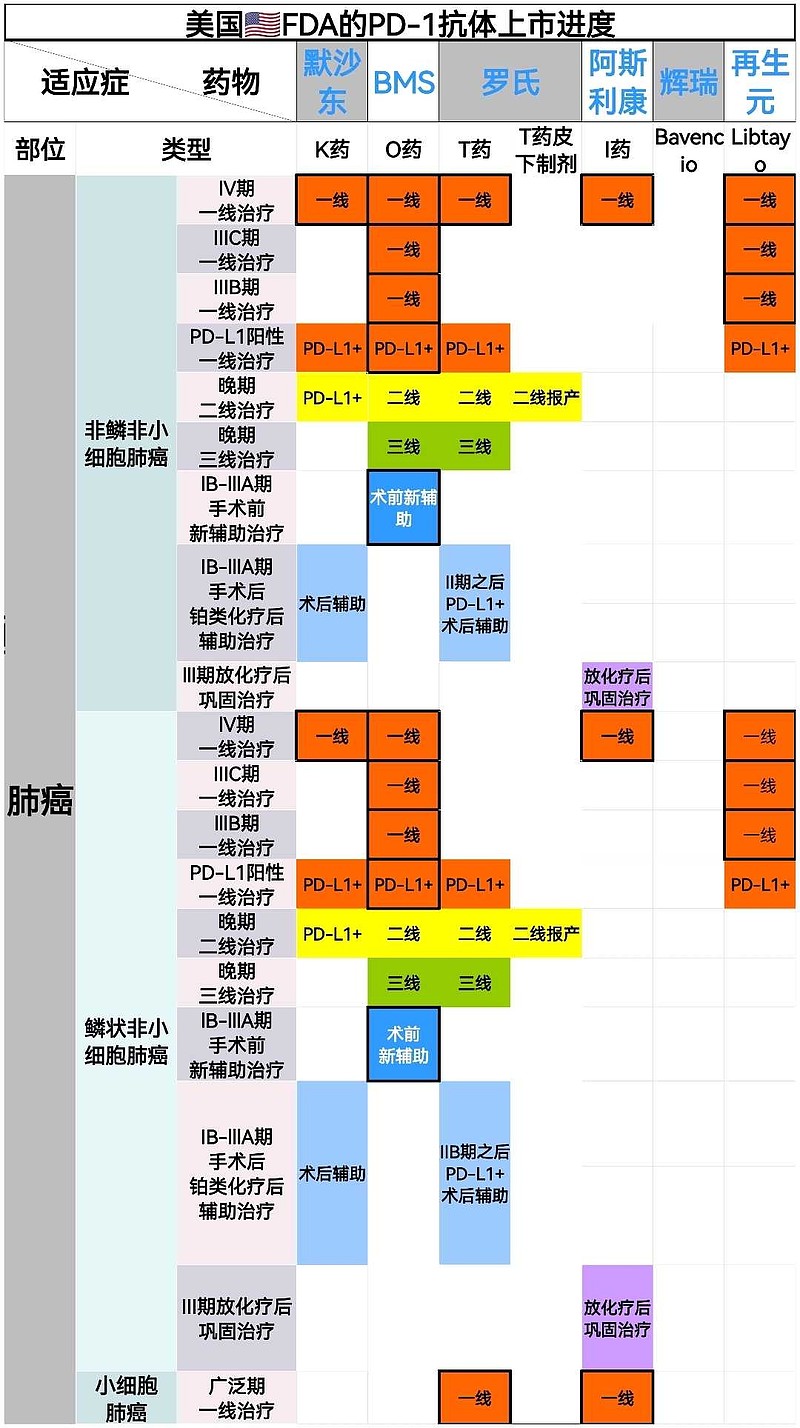 (二)中国🇨🇳 (二)中国🇨🇳中国CDE关于PD-1一线治疗晚期非小细胞肺癌上市标准逐渐升级, 不是双盲试验PFS数据 → 双盲试验PFS数据 → 双盲试验OS数据→ 不是双盲试验,与替雷利单抗头对头对照,非劣效试验。 (1)不是双盲试验,也能获批上市恒瑞医药PD-1和$百济神州-U(SH688235)$ PD-1一线治疗晚期非鳞非小细胞肺癌III期临床,的确是最早开展并且PFS数据达到主要终点。 【不足之处】但却是开放标签,#不是双盲试验# 。而且OS不是主要终点。 需要注意,默沙东K药的keynote407研究III期临床试验启动时间更早,却是双盲试验。 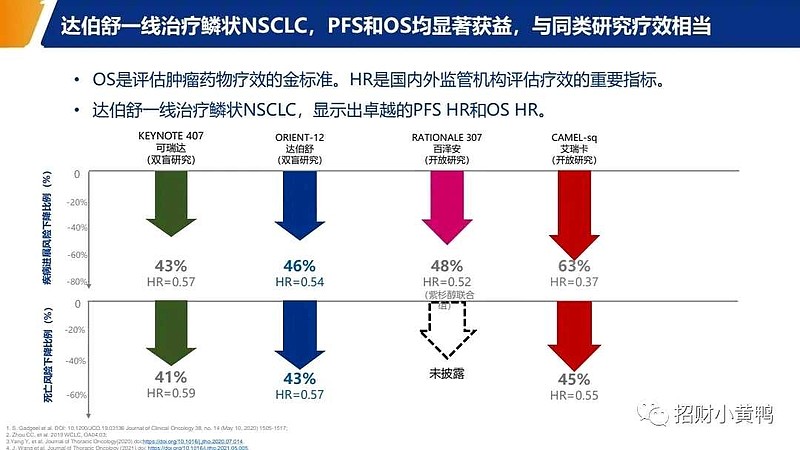 (2)总生存期OS不是主要终点,也能获批上市 (2)总生存期OS不是主要终点,也能获批上市$信达生物(01801)$ PD-1一线治疗晚期非鳞非小细胞肺癌III期临床,的确是双盲试验。 【不足之处】但是,#OS不是主要终点# 。中国🇨🇳CDE允许PFS数据支持获批上市。 目前为止,美国🇺🇸FDA对转移性非小细胞肺癌一线免疫治疗 (IO) 产品的所有上市完全批准(full approval)都是基于总体生存OS的统计学上的改善。免疫治疗相对于靶向治疗和化疗的优势主要体现在OS生存期的延长,所以TKI靶向药物的批准是可以用PFS作为终点的,但是所有PD-1药物的完全批准都要求用OS作为终点。(见下图) Keytruda的Keynote-189三期临床一开始也是用PFS做主要终点,但是后来加上了OS作为主要终点,在试验成功后获得了非小细胞肺癌一线治疗的完全批准上市。 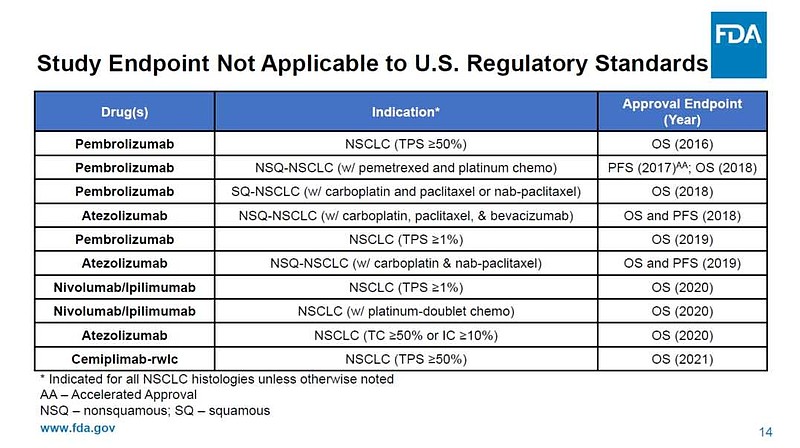 (3)君实生物PD-1被CDE严格要求,双盲试验,总生存期OS数据达到显著疗效的统计学意义,才能获批上市。 (3)君实生物PD-1被CDE严格要求,双盲试验,总生存期OS数据达到显著疗效的统计学意义,才能获批上市。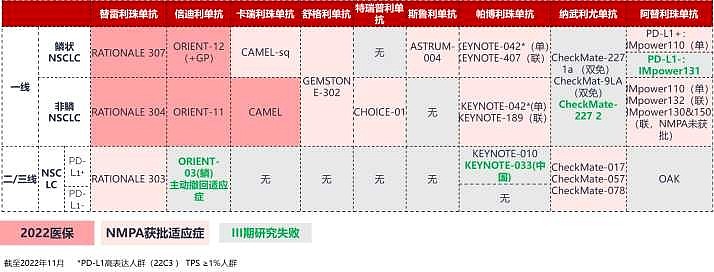 看看上图,君实生物PD-1获批一线治疗NSCLC之前,多少家药企用PFS数据支持,在中国上市销售了。 $君实生物-U(SH688180)$ Choice 01研究,非鳞亚组,双盲试验。君实生物 PD-1联合化疗 vs 化疗,一线治疗晚期非鳞非小细胞肺癌,OS HR =0.48(0.32,0.71),P值=0.002。 君实生物PD-1研究允许交叉,在对照组患者交叉至特瑞普利单抗治疗比例高达65.4%情况下,特瑞普利单抗联合化疗组依旧具有OS改善(未校正数据),证实了特瑞普利单抗的长生存优势。 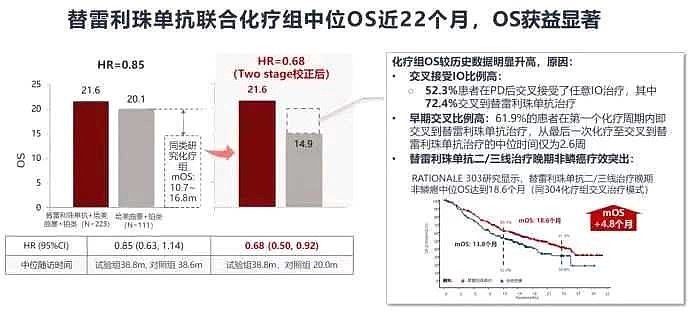 有兴趣的,可以看看上图,百济神州自行公布的PD-1一线治疗晚期非鳞非小细胞肺癌的 OS校正前数据 vs OS校正后数据。 OS HR=0.85(0.63,1.14) vs OS HR=0.68(0.50,0.92)。 (4)正大天晴PD-L1需要头对头对照百济神州替雷利珠单抗,一线治疗晚期非鳞非小细胞肺癌才能获批上市但是,这个III期临床试验,不是双盲试验,是非劣效试验(不是优效)。 至少,PD-1上市速度和新增适应症速度明显减慢了。 @今日话题 |
【本文地址】
今日新闻 |
推荐新闻 |