SDS |
您所在的位置:网站首页 › 什么是不连续电泳原理 › SDS |
SDS
|
SDS-PAGE介绍 SDS-PAGE(十二烷基硫酸钠)聚丙烯酰胺凝胶电泳是遗传学、生物化学和分子生物学中用于根据蛋白质的分子量分离蛋白质的方法之一。 蛋白质的电泳迁移率取决于它们的大小。 SDS-PAGE 的目标是根据蛋白质的尺寸分离蛋白质。 由于蛋白质是两性物质并带有净电荷,因此可以根据它们悬浮在其中的介质的 pH 值来测量它们的电荷。 因此,在一定的 pH 值和非变性条件下,蛋白质之间的电泳分离取决于分子的尺寸和电荷。 由于蛋白质是重分子量化合物,因此需要多孔凝胶才能分离。 由于凝胶是多孔的,因此聚丙烯酰胺凝胶可用于按大小分离蛋白质。 该试剂盒可让学生掌握 SDS-PAGE 的艺术。 什么是 SDS 页?SDS-PAGE 是定性分析任何基于蛋白质的混合物、检查蛋白质纯度和确定蛋白质分子量的最广泛使用的方法之一。 它基于根据蛋白质的大小对蛋白质进行分类,然后通过与染料结合来找到它们。 为了分离具有不同大小和形状的不同蛋白质,它们必须首先变性,以使蛋白质不包含额外的、二级或四级结构。 十二烷基硫酸钠 (SDS) 是一种阴离子洗涤剂,可通过“包裹”多肽骨架使蛋白质变性。 SDS 将所有蛋白质去除回其原始结构。 SDS 按多肽长度的比例赋予多肽负电荷。 SDS 处理有两个关键方面: 所有蛋白质仅保留其一级结构。所有的蛋白质都带有大量的负电荷。聚丙烯酰胺是创造这种环境的理想凝胶。 聚丙烯酰胺是一种合成凝胶,具有透明、热稳定性和耐热性。 它坚固且化学惰性。 它可以创建具有一系列孔径。 它能够承受高电压梯度,可用于各种脱色和染色方法,可消化分离组分,或干燥用于放射自显影或永久记录。 聚合物凝胶由丙烯酰胺单体组成。 通过电泳将蛋白质推过凝胶,整个过程称为聚丙烯酰胺凝胶电泳 (PAGE)。 两层分别由凝胶、间隔胶或浓缩胶和分离胶或分离胶组成。 堆叠或间隔凝胶: 用于堆叠的凝胶包含由聚丙烯酰胺制成的巨大孔隙(通常为 5%)。 凝胶由 pH 6.8 的 Tris 缓冲液制成,比电泳缓冲液的 pH 值高大约两个 pH 单位。 凝胶形成在分离凝胶的顶部。分离或拆分凝胶: 用于分离的凝胶具有由聚丙烯酰胺 (5-30 5-30%) 制成的小孔。 使用的 Tris 缓冲液的 pH 值为 8.8。 这种凝胶是根据分子大小分离大分子的地方。 什么是 SDS 页?目的了解如何制备十二烷基硫酸钠聚丙烯酰胺凝胶 (SDS-PAGE)通过 SDS-PAGE 测定蛋白质的纯度以及测定经 SDS-PAGE 纯化的蛋白质的分子量。SDS-PAGE的原理 什么是 SDS 页?目的了解如何制备十二烷基硫酸钠聚丙烯酰胺凝胶 (SDS-PAGE)通过 SDS-PAGE 测定蛋白质的纯度以及测定经 SDS-PAGE 纯化的蛋白质的分子量。SDS-PAGE的原理十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (SDS-PAGE) 在不连续的缓冲液系统中进行,其中储存缓冲液与用于流延凝胶的缓冲液具有不同的 pH 值和离子强度。 应用于凝胶的样品中的 SDS 多肽复合物被电流在电极之间通过时产生的移动边界扫过。 通过高孔隙率的浓缩胶迁移后,复合物沉积在分离胶表面的一个非常薄的区域。 在进一步的电泳中,多肽根据它们在分离凝胶中的大小得到分离。  SDS-PAGE的原理SDS-PAGE中使用的材料及其作用三: Tris 被用作缓冲液,因为它对大多数蛋白质是一种无害的化学物质。 其在 8.3oC 时的 pKa 值为 20,被认为是 7.0 至 9.0 pH 范围内的合适缓冲液。丙烯酰胺: 丙烯酰胺是一种白色粉末,当它溶于水时,会发生自聚合。 这是一个缓慢而自发的过程,其中丙烯酰胺分子以头对尾的方式结合。 然而,在系统中不存在自由基的情况下,丙烯酰胺单体转化为自由基状态。 被活化的单体迅速聚合并产生长链聚合物。 这种类型的反应在乙烯基加成聚合领域中被提及。双丙烯酰胺(N,N'-亚甲基双丙烯酰胺): 双丙烯酰胺是最常用的聚丙烯酰胺凝胶交联剂。 在化学上,它由两个丙烯酰胺分子在其非反应性末端头对头结合而成。十二烷基硫酸钠 (SDS): SDS 是使用最广泛的变性剂,可将天然蛋白质还原为多肽。 当蛋白质混合物在 SDS 存在的情况下被加热到 100 摄氏度时,洗涤剂就会包裹在多肽的主链上。 这以每克多肽 1.4 克不变的比例结合多肽。 这个过程导致多肽的电荷可以忽略不计它们与 SDS 产生的负电荷相比。 因此,处理过的多肽转变成具有均匀电荷密度的棒状结构,每一个具有相等的负电荷。过硫酸铵 (APS): APS 化学品是凝胶形成的催化剂。6. N, N, N', N'-四甲基乙二胺(TEMED): 丙烯酰胺凝胶的化学聚合用于 SDS-PAGE。 它可以由过硫酸铵和季胺 N,N,N',N'-四甲基乙二胺 (TEMED) 引发。SDS PAGE 要求丙烯酰胺/双丙烯酰胺溶液 30% (29:1)2.5X Tris-SDS 缓冲液 (pH 8.8) 65 ml 125 ml 2-8o5X Tris-SDS 缓冲液 (pH 6.8)预染蛋白梯5X Tris-甘氨酸-SDS 凝胶电泳缓冲液 5X 上样缓冲液蛋白质样品 1蛋白质样品 2染色液脱色液过硫酸铵 (APS)四甲基乙二胺 (TEMED)琼脂糖 SDS-PAGE的原理SDS-PAGE中使用的材料及其作用三: Tris 被用作缓冲液,因为它对大多数蛋白质是一种无害的化学物质。 其在 8.3oC 时的 pKa 值为 20,被认为是 7.0 至 9.0 pH 范围内的合适缓冲液。丙烯酰胺: 丙烯酰胺是一种白色粉末,当它溶于水时,会发生自聚合。 这是一个缓慢而自发的过程,其中丙烯酰胺分子以头对尾的方式结合。 然而,在系统中不存在自由基的情况下,丙烯酰胺单体转化为自由基状态。 被活化的单体迅速聚合并产生长链聚合物。 这种类型的反应在乙烯基加成聚合领域中被提及。双丙烯酰胺(N,N'-亚甲基双丙烯酰胺): 双丙烯酰胺是最常用的聚丙烯酰胺凝胶交联剂。 在化学上,它由两个丙烯酰胺分子在其非反应性末端头对头结合而成。十二烷基硫酸钠 (SDS): SDS 是使用最广泛的变性剂,可将天然蛋白质还原为多肽。 当蛋白质混合物在 SDS 存在的情况下被加热到 100 摄氏度时,洗涤剂就会包裹在多肽的主链上。 这以每克多肽 1.4 克不变的比例结合多肽。 这个过程导致多肽的电荷可以忽略不计它们与 SDS 产生的负电荷相比。 因此,处理过的多肽转变成具有均匀电荷密度的棒状结构,每一个具有相等的负电荷。过硫酸铵 (APS): APS 化学品是凝胶形成的催化剂。6. N, N, N', N'-四甲基乙二胺(TEMED): 丙烯酰胺凝胶的化学聚合用于 SDS-PAGE。 它可以由过硫酸铵和季胺 N,N,N',N'-四甲基乙二胺 (TEMED) 引发。SDS PAGE 要求丙烯酰胺/双丙烯酰胺溶液 30% (29:1)2.5X Tris-SDS 缓冲液 (pH 8.8) 65 ml 125 ml 2-8o5X Tris-SDS 缓冲液 (pH 6.8)预染蛋白梯5X Tris-甘氨酸-SDS 凝胶电泳缓冲液 5X 上样缓冲液蛋白质样品 1蛋白质样品 2染色液脱色液过硫酸铵 (APS)四甲基乙二胺 (TEMED)琼脂糖 其他所需材料; 玻璃器皿: 锥形瓶、量筒、烧杯试剂: 蒸馏水其它要求: 蛋白质电泳仪、微量移液器、吸头、微波/燃烧器/热板 SDS 或十二烷基硫酸钠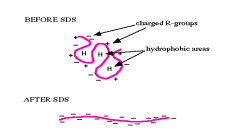 SDS 使蛋白质变性 | 图片来源:https://himedialabs.com/TD/HTP001.pdf SDS 使蛋白质变性 | 图片来源:https://himedialabs.com/TD/HTP001.pdfSDS,或十二烷基硫酸钠是一种阴离子洗涤剂,能够与蛋白质紧密结合,导致蛋白质变性。 在过量 SDS 存在的情况下,大约 1.4 克洗涤剂会与每克蛋白质结合,从而使每质量蛋白质具有相同的负电荷。 最后,SDS-蛋白质复合物在电泳过程中移向阳极,并且由于聚丙烯酰胺凝胶中的分子筛分特性,根据它们的分子单位重量进行分离。 该方法的原理是将已知分子量的标准蛋白与未知蛋白在同一凝胶上应用时,根据大小差异分离蛋白,即可测出未知蛋白的分子量。 SDS 电泳凝胶中蛋白质的迁移率是根据相对于用于追踪溴酚蓝的染料的相对迁移率 (R f) 来定义的。  通过将相对于每个 Rf 值的分子量放在半对数图上,利用大小已知的蛋白质标记的 Rf 值生成非典型曲线。 然后根据 Rf 值推断出未知蛋白质的分子量。 通过将相对于每个 Rf 值的分子量放在半对数图上,利用大小已知的蛋白质标记的 Rf 值生成非典型曲线。 然后根据 Rf 值推断出未知蛋白质的分子量。通过将相对于每个 Rf 值的分子量放在半对数图上,利用大小已知的蛋白质标记的 Rf 值生成非典型曲线。 然后根据 Rf 值推断出未知蛋白质的分子量。 SDS PAGE 是如何工作的?当施加电压时,样品缓冲液和浓缩胶中的氯离子迅速向正电荷极移动,并形成一个边缘,导致移动的离子前沿。 甘氨酸分子在凝胶堆积中的电荷很少,因此它们移动到离子前面的后面。 甘氨酸和氯化物迁移率的差异导致凝胶内出现显着的电压梯度,该电压梯度扫过蛋白质和 SDS 的负电荷复合物。 浓缩胶的大孔对蛋白质-SDS 复合物的移动提供了最小的阻力。 然后,它们能够“堆叠”到堆积胶和电泳胶交汇处的一个极其集中的区域(右)。 ProteinSDS 复合物集中在界面附近,直到逐渐移动的甘氨酸分子到达凝胶的边界。  SDS PAGE 是如何工作的? | 资料来源:https://www.sigmaaldrich.com/IN/en/technical-documents/protocol/protein-biology/gel-electrophoresis/sds-page SDS PAGE 是如何工作的? | 资料来源:https://www.sigmaaldrich.com/IN/en/technical-documents/protocol/protein-biology/gel-electrophoresis/sds-page当甘氨酸离子进入凝胶时会发生显着变化。 它们使电泳胶的pH值接近甘氨酸氨基的pKa值,这意味着甘氨酸分子的重要部分获得了负电荷。 带负电荷的甘氨酸分子开始以与氯离子相同的速度移动,从而消除了控制蛋白质通过床的运动的电压间隙。 运行凝胶的孔比用于堆叠的凝胶小,因此孔提供了对蛋白质运动的阻力。 由于凝胶的筛分特性,蛋白质开始以不同的速率迁移。 较小的蛋白质-SDS 复合物比含有大量蛋白质 SDS 的复合物移动得更快(右)。 在由孔隙度定义的特定范围内,运行凝胶中蛋白质的迁移速率与 MW 的对数成正比。 SDS 页协议 SDS 页流程图 | 图片来源:https://himedialabs.com/TD/HTP001.pdf确保玻璃面板固定在设备上,同时垫片位于两个边缘。制备 1% 琼脂糖(0.05g 在 5ml 蒸馏水中)。 煮沸直至琼脂糖溶解,然后在板底部倒一层均匀的水平琼脂糖以固定板。 让它凝固冷却 5-10 分钟。 SDS 页流程图 | 图片来源:https://himedialabs.com/TD/HTP001.pdf确保玻璃面板固定在设备上,同时垫片位于两个边缘。制备 1% 琼脂糖(0.05g 在 5ml 蒸馏水中)。 煮沸直至琼脂糖溶解,然后在板底部倒一层均匀的水平琼脂糖以固定板。 让它凝固冷却 5-10 分钟。12%分离胶的制备 制备分离凝胶包括以下成分:烘焙材料金额30% 丙烯酰胺-双丙烯酰胺溶液6毫升蒸馏水3毫升2.5X Tris-SDS 缓冲液 (pH 6.8)6毫升10% APS 溶液125微升泰美18微升 将凝胶放在板之间,静置约一小时。 凝胶冷却后,立即将其倒在盘子上。 倒入,加入蒸馏水,直到它是水平的凝胶。 大约一小时后,通过翻转铸件去除所有液体。 5%浓缩胶的制备 要制备浓缩胶,请按以下顺序混合成分:烘焙材料金额30% 丙烯酰胺-双丙烯酰胺溶液1.3毫升蒸馏水5.1毫升5X Tris-SDS 缓冲液 (pH 6.8)1.6毫升10% APS 溶液75微升泰美10微升 添加 TEMED 后,通过旋转烧杯彻底混合所有成分。 将浓缩胶放在分离胶的顶部。 然后,立即放置梳子,确保避免气泡。 应该让它静置约 30 分钟。 重要提示:丙烯酰胺是一种潜在的神经毒素,必须格外小心处理。 始终戴上口罩并戴上手套。 将 1X Tris-甘氨酸-SDS 凝胶电泳缓冲液以连接两个电极的方式放入装置中,从而完成流动。 小心地从浓缩凝胶中取出梳子。样品制备:取 2 管用于蛋白质样品。 相应地标记它们。 您应该从试管中取出 20 毫升的每个样品,并添加 5 毫升的 5X 样品加载缓冲液。 含有 100oC 蛋白质样品的试管在沸水浴中。 不要煮沸带有 PrestainedProtein Ladder 的试管。取 5ml 预染蛋白梯和 20ml 样品,在对堆叠凝胶内的梳孔进行热处理后立即取下。电源线应根据标准协议连接到电泳电源:红色阳极和黑色阴极。 电泳过程为 100 V、10 mA,直到染料前沿比凝胶密封的前沿高 0.5 cm。将凝胶放入装有蒸馏水的塑料托盘中,将凝胶从板之间取出。 凝胶应清洗 1 分钟。 然后,用水冲洗凝胶并进行脱色程序。凝胶的染色和脱色除去水后,在盛有凝胶的托盘中加入 50 毫升染色溶液,直到条带出现明显为止。 有时,凝胶需要在染色溶液中保存一夜,以确保条带可见。从染色液中取出凝胶。 可重复使用 染色液可重复使用 XNUMX 次。用蒸馏水冲洗凝胶,直到凝胶上的污渍被去除。 每 3-4 次重复更换蒸馏水的过程。向凝胶中加入 50ml 脱色液。 应通过以恒定速率摇动凝胶来进行脱色。继续脱色,直到条带清晰可辨。 看得到。从脱色液中取出凝胶。 脱色液可重复使用 XNUMX 次。SDS-PAGE观察及结果 SDS-PAGE观察及结果泳道 1:预染蛋白梯泳道 3:蛋白质样品 1泳道 5:蛋白质样品 2 解释 SDS-PAGE观察及结果泳道 1:预染蛋白梯泳道 3:蛋白质样品 1泳道 5:蛋白质样品 2 解释染色、脱色、凝胶后,您可以将样品的分子量与蛋白质标记物的重量进行比较。 蛋白质样品 1 是血清样品,因此观察到多个条带。 蛋白质样品 2 是一种纯化的蛋白质,因此可以看到 1 个主要条带。 SDS-PAGE 样品制备取 1ml 大肠杆菌菌株 DH5α 培养液于 1.5 ml eppendorf 管中。然后以 12000 rpm 离心 5 分钟。然后丢弃上清液。然后在试管中加入 500 μl TE,轻轻摇动溶解试管。然后加入相同体积的样品缓冲液。最后将样品在沸水浴中加热 5 分钟,然后立即继续冰。如果需要,要分析的样品可选择与化学变性剂混合,通常为 SDS核酸用蛋白质或尿素。 SDS 是一种阴离子洗涤剂,可使二次和非-变性二硫键连接的三级结构,另外对每个蛋白质施加负电荷与其质量成正比。 尿素破坏核酸碱基对之间的氢键,导致组成链分离。 将样品加热到至少 60 °C 会进一步促进变性。 SDS PAGE 重要说明在开始测试之前花时间阅读整个过程。10% APS 溶液的制备:在开始实验之前,您需要将 0.2 克过硫酸铵溶解在水馏出物中以产生 2.0 毫升的量。 储存在 2-8oC。 3个月内使用。1XTris-甘氨酸 SDS 凝胶电泳缓冲液的制备 要制备 500 ml 1X Tris-甘氨酸凝胶电泳缓冲液,您需要取 100 ml Tris-甘氨酸-SDS 凝胶电泳缓冲液并混合 400 ml 无菌蒸馏水*。 储存在 2-8oC。 使用前充分混合。 确保在使用前充分混合。 1X Tris-甘氨酸 SDS 凝胶电泳缓冲液最多可重复使用 4-5 次。使用前解冻所有冷藏样品。使用清洁剂和蒸馏水*清洁整个机器。 检查您的盘子是否干净。解决方案的问题小电流下,Run时间异常长,解决这个问题 将电压提高25-50% 如果将太多样品加载到孔中,凝胶分辨率可能会很差,为避免这种情况,切勿过度填充孔,因为这可能会导致伪影。 给定的凝胶加载体积是针对标准凝胶大小的。 如果凝胶尺寸较小,则相应地加载样品 始终倒入浓缩胶,使孔底到分离胶顶部的长度为 1 厘米,以便正确堆叠蛋白质样品 如果运行速度非常快,则将电压降低 25-50%,因为施加的电流非常高。如果在纯化的蛋白质样品中看到更多条带,请在样品准备好后立即进行电泳。在取出梳子之前让浓缩胶聚合至少 30 分钟,否则样品在加载时不会沉入孔底。确保在浇注时凝胶中没有气泡(部分平板上的条带不会向下移动凝胶)。不要将夹具组件上的螺钉拧得过紧。在倒入凝胶之前确保凝胶混合物充分混合 |
【本文地址】
今日新闻 |
推荐新闻 |