临床试验中严重不良事件一致性核对的优化 |
您所在的位置:网站首页 › 不良事件报告的范围包括 › 临床试验中严重不良事件一致性核对的优化 |
临床试验中严重不良事件一致性核对的优化
|
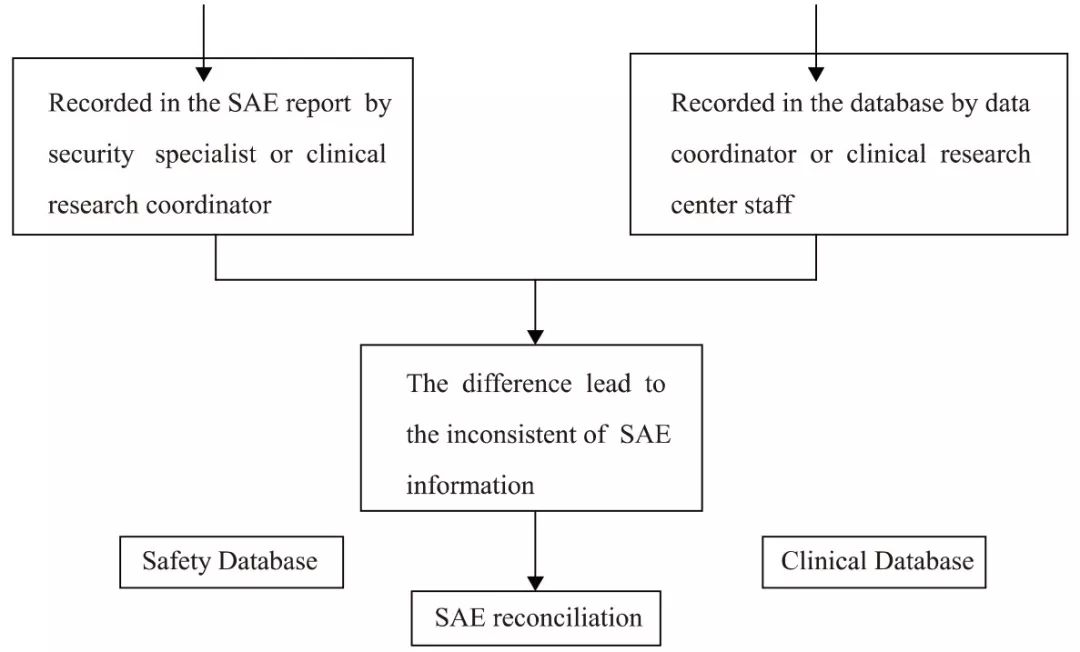
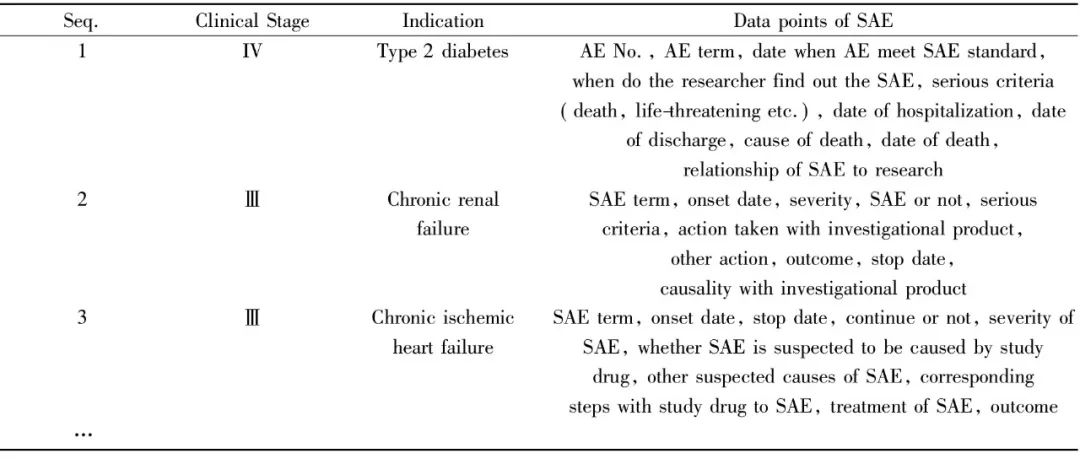
Fig.1 SAE reconciliation 1 材料与方法 本研究以某CRO公司的临床研究项目为例。根据项目的不同及各制药企业操作标准的不同,有些临床试验将严重不良事件包括在不良事件页中,有些则会单独设计严重不良事件页。常规的严重不良事件数据点通常包括严重不良事件名称、开始日期、结束日期、是否SAE、严重程度、转归、采取的措施等,需对两份数据库中同时存在的数据点进行核对。临床试验中的SAE收集情况如Tab.1所示。
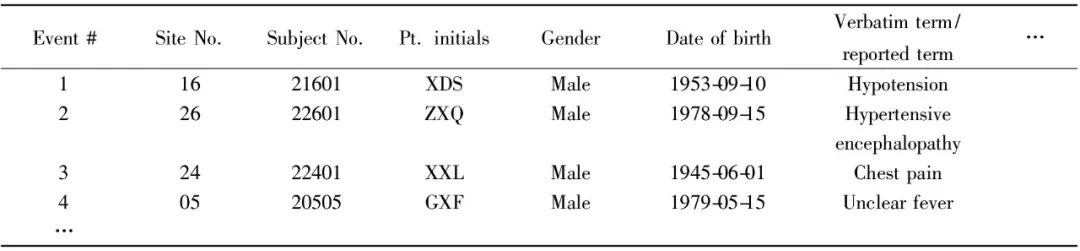
Tab.1 SAE data collection in different projects 由安全部门代表或临床运营团队专员处理的现场24h内需报告的SAE,部分项目可能配有安全性数据库(如药物上市后用于不良反应监测的药物警戒数据库),可定期导出为EXCEL文件。另外也可由现场操作人员录入整理至EXCEL中,提供至数据管理处,使采用SAS进行一致性核对具有可操作性。某项目提供的SAE报告格式举例如Tab.2所示。
Tab.2 Example of SAE report 安全性数据库及临床数据均可能补充更新,需定期根据最新的数据针对两份数据中共同存在的数据点进行核对,以确保安全性数据的一致。 1.1 方法 1.1.1 导入安全性数据库 将提供至数据管理人员处的安全性数据(需整理为EXCEL格式)通过SAS Proc Import语句将其读入生成为SAS数据集。语句如下,根据SAS版本及EXCEL版本的不同可相应调整程序,此处使用的为SAS9.2及EXCEL2007。
读入后,保留需进行比较的变量,对变量名、标签、变量顺序等进行处理以增加其可读性,方便后续与临床数据库进行拼接比较。
1.1.2 处理临床数据库 无论是PDC或是EDC,通常系统均可将临床试验数据导出处理为SAS数据集。将SAE数据取出,存为一个临时数据集,以便之后使用。 若SAE记录在AE表中,则可将其从AE数据集中取出:
同样,临床试验数据库中的SAE也进行一定的处理,方便两者拼接核对。
1.1.3 临床数据库与安全性数据库的SAE合并 两部分数据均导入SAS后,通过Data set步将两个数据集合并。数据应与原始数据一致,不应进行更改,以防止导出后的数据与原始数据库的不一致,通过SAE编号或不良事件名称进行排序,使同一条SAE(名称相同或SAE编号相同) 能处于上下两行,方便审阅。处理如下:
两份数据整理并合并后,此时已具有一定的可读性,能一定程度上简化数据核查人员进行人工核对的过程,整理后格式如Tab.3所示。
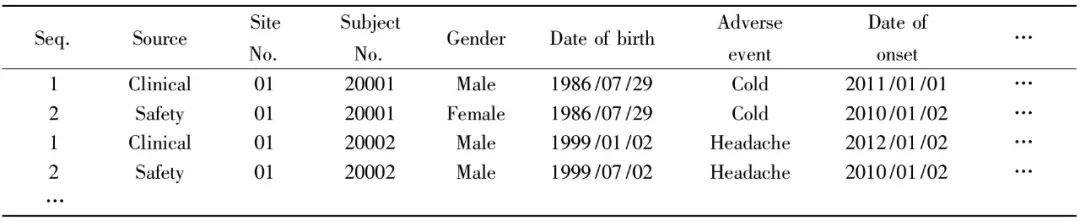
Tab.3 Combination of clinical SAE and safety SAE Tab.3虽已具有一定的可读性,但两份数据合并后仍然缺乏重点,需数据管理人员进行逐条逐点的核对。我们考虑将不一致的数据点标出,使数据管理人员能够有所针对的进行核查。 1.1.4 利用DDE语言针对不一致处进行标记 步骤“1.1.3”通过SAS的Data set语句将两份数据纵向合并,此步骤中需对两份数据进行比较定位,我们通过SAS的merge语句将步骤“1.1.1”及步骤“1.1.2”中的两份数据横向合并以便比较,并另存为一数据集以便与表“1.1.3”中的数据集区分。 两份SAE由于数据来源、填写人员的不同,同一个SAE变量的同一个内容其表达方式、书写格式可能不尽相同,如Tab.4所示。
Tab.4 Different form of the same information 因此我们还需对变量进行一定的处理,使相同含义的变量能够匹配而后才能进行通过SAS程序进行核对比较,并在核对之后对变量进行标记,同时不改变其原始值。程序举例如下:
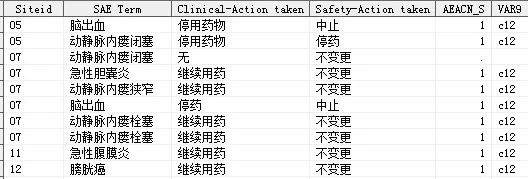
Fig.2 Mark the inconsistent data point 通过上述程序对两份数据中的不一致数据进行了标记(如试验药物处理不一致则标记为AEACN_S=1),根据变量顺序确定不一致变量所在的列并对其进行赋值(如中心所在为第1列,则VAR1='c1',试验药物处理所在为第12列,则VAR9 ='c12'),明确数据不一致的受试者及其不一致数据点所在位置后,将其合并至步骤“1.1.3”中的总数据集中并通过DDE语句对其进行标记颜色。程序如下所示:
上述语句通过循环遍历数据集中的字符变量,筛选出列位置变量VAR,然后通过观测所在行+1(因标签导入EXCEL中占1行,因此需+1)及列位置变量VARx=Cx(如Fig.2中VAR9='c12')来确认EXCEL中标记颜色的范围range。 2 结果 通过上述步骤处理标记后结果如Tab.5所示,即在原始两份数据合并后进一步对不一致数据点进行了标记,数据核查人员在进行核对时可以重点针对已标色的数据点进行审查,一定程度上减轻了工作量并降低人工核查可能导致的随机错误。
Tab.5 Inconsistent data point after tagged 3 讨论 临床试验数据是整个新药研发过程中的核心,是分析、提交、批准及上市的基础,不良事件数据更是药物安全性评价的重要佐证。其中SAE的报告要求一定的时效性,首次报告时无法进行细致的核查,因此几乎100%的初次SAE报告均存在各种问题。
临床操作中记录及报告的SAE与数据管理部门接收的CRF上记录的SAE,两份数据无法完全衔接,人工核查是在所难免的。 人工核查在临床试验数据核查过程中非常常见,针对一些开放填写数据点及一些外部数据的核对,程序无法完全替代人工进行。但人工核查的问题在于,人工肉眼核对难免会有疏漏及错误,为保证数据质量及核对的准确性可能需要反复核对,所需的工作量非常大,即使如此,仍无法避免出错的可能性。 在临床试验中,SAS主要用于进行数据处理和分析,可以通过撰写SAS程序处理临床试验数据,对数据进行清理、整合、输出,其功能强大、操作灵活、使用方便。本方法利用SAS将计算机逻辑核查(edit check)及人工核查(manual check)相结合,辅助数据管理人员进行有针对性的核对及定位,使其能更准确的进行核查。同时本程序并不仅适用于SAE的一致性核对,也可将其推广至其他内外部数据的一致性核对,为减轻人工核查工作量、提高核查准确性提供一定的思路。 但此方法仍有一定的局限性,程序对于开放文本数据的核查辨别程度不高,如某SAE同时存在于两份数据中,但因SAE名称填写有差异,导致无法完全匹配核对,仍需由程序将此类SAE筛选出,由人工进行核实整理;另外某些SAE相关描述可能出现含义一致但填写方式、文字组织方式不一致的情况,此类不一致程序无法辨别,仍会被标记,由数据管理人员进行整理。利用此方法进行核对时在前期需由数据管理人员及程序员协同合作进行测试、调试,并在之后不断进行完善,以达到提高数据核查质量的效果。 作者:周蓓(嘉兴泰格数据管理有限公司) ,于浩(南京医科大学公共卫生学院) 选自:中国临床药理学与治疗学 2018年4月 第23卷 第4期 428-433 记得投稿时一定要留下联系方式,若被选中发表,有稿费支付! 小研 除金玉良研原创文章外,他人通过本平台发布的原创文章及转载文章观点仅代表原作者本人,不代表本平台立场。如有侵权请联系删除! END返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |