IL |
您所在的位置:网站首页 › t细胞会呈递抗原吗为什么 › IL |
IL
|
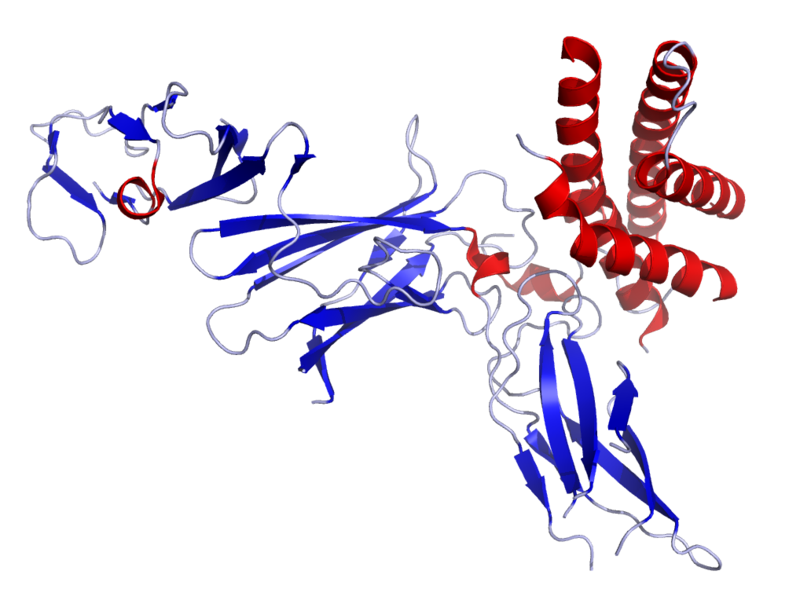
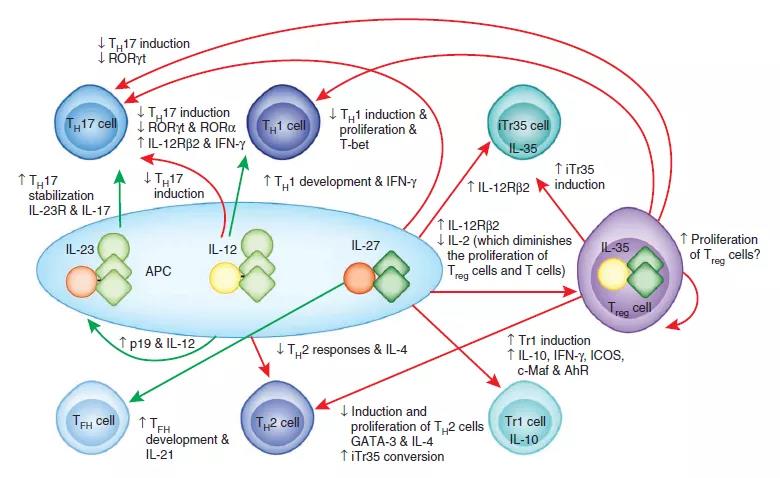
白细胞介素12 (IL-12)是由树突状细胞,巨噬细胞,嗜中性粒细胞和人B淋巴母细胞(NC-37)响应抗原刺激而自然产生的白介素。IL-12属于白介素12家族。IL-12家族独特之处在于仅包含异二聚体细胞因子,包括IL-12,IL-23,IL-27和IL-35。尽管具有许多结构特征和分子伴侣,但它们介导了令人惊讶的各种功能作用。 白细胞介素12(IL-12)由活化的抗原呈递细胞(树突状细胞,巨噬细胞)产生。它促进Th1反应的发展,是T细胞和NK细胞产生IFNγ的有力诱导剂。 IL-12与自身免疫有关。已证明向患有自身免疫疾病的人服用IL-12可加重自身免疫现象。据信这是由于其在诱导Th1免疫应答中的关键作用。相反,小鼠中的IL-12基因敲除或用IL-12特异性抗体对小鼠的治疗改善了该疾病。 一项发表在《变态反应与临床免疫学杂志》上的研究结果表明,对花生过敏的小鼠白细胞介素12并不存在,这表明该分子通常会停止对食物发育的变态反应。三、IL-12与受体1、IL-12细胞因子家族的体系结构 IL-12细胞因子家族的成员与它们的受体和Jak-STAT信号传导伴侣一起出现。关键(底部)指示了这些细胞因子的功能范围,从最促炎的(IL-23)到最抑制的(IL-35)。Tyk2,Jak家族的激酶。2、IL-12家族作为免疫学联系的细胞因子 IL-12细胞因子家族的成员介导无数的功能联系和影响。绿色箭头表示导致促炎或刺激作用的动作;红色箭头指示导致抑制作用的作用(即使在某些情况下,这是由上调事件介导的,例如IL-27诱导Tr1细胞);黑色箭头表示向上调节(向上箭头)或向下调节(向下箭头)。3、白介素(IL)-12,IL-23及其受体的表达 白介素12(IL-12)受体由两条链组成,即IL-12Rβ1和IL-12Rβ2(参考文献18),两者均与IL-6-的常见受体β链gp130具有广泛的同源性。像细胞因子超家族一样。他们是I型跨膜糖蛋白,分子量约为100 kDa(IL-12Rβ1)和130 kDa(IL-12Rβ2)。IL-12Rβ1和IL-12Rβ2的共表达是产生高亲和力(50 pM)IL-12结合位点所必需的,而IL-12Rβ2亚基则充当高亲和力受体复合物的信号传导成分18。与IL-12Rβ1相关的85 kDa蛋白会响应IL-12磷酸化,可能是IL-12R140的另一种成分。通过IL-12R进行的信号转导诱导酪氨酸磷酸化,主要是Janusfamily激酶JAK2和TYK2的磷酸化,进而磷酸化并激活信号转导子和转录激活子1(STAT1),STAT3,STAT4和STAT5(参考文献18)。IL-12的特定细胞作用主要归因于其诱导STAT4激活的能力。四、IL-12与细胞1、IL-12生物学摘要 IL-12和IL-23是由组织前哨(例如树突状细胞和巨噬细胞)响应微环境信号而产生的。信号特异性决定了两种细胞因子中的哪一种占主导。IL-12与IL-27一起将原始CD4 + T辅助(TH)细胞分化为具有T-bet(也称为TBX21)和信号转导和转录激活因子4(STAT4)作为转录主调节因子的IFNγ产生TH1细胞。IL-12的其他靶细胞是造血祖细胞(HPC),其IL-12与其他细胞协同作用IL-3和干细胞因子(SCF)等集落刺激因子可促进增殖和集落形成。IL-12进一步激活自然杀伤(NK)细胞,CD8 +细胞毒性T细胞(CTL)和第1组先天淋巴样细胞(ILC1s)以产生细胞因子,例如IFNγ和TNF。值得注意的是,特异的效应子TH细胞和ILC亚群在其发育和功能上共享相似的主转录调节因子137。IL-23与包括转化生长因子-β(TGFβ),IL-1β,IL-21和IL-6在内的细胞因子相结合,将幼稚的CD4 + T细胞与类维生素A相关的孤儿受体γt(RORγt)分化为TH17反应STAT3作为转录主调节子。IL-23还刺激其他17型细胞,包括不变型NK T(iNKT)细胞,γδT细胞和ILC3s的亚型,产生IL-17家族细胞因子,例如IL-17A和IL-17F以及IL-22。通过诱导成骨细胞上的NF-κB配体(RANKL)受体激活剂,IL-23与巨噬细胞集落刺激因子(M-CSF)结合,促进破骨细胞生成和骨吸收。已经提出了变化的环境条件作为效应物TH细胞和ILC可塑性的调节剂,从而保证了对潜在免疫刺激的最佳免疫力。失去RORγt表达并上调ILC1典型IFNγ的ILC3有时称为ex-RORγtILC3 / ILC1。3、IL-6和12种细胞因子对T细胞活性的影响 (A)树突状细胞以及其他先天细胞产生IL-6,通过促进CXCR5,IL-21和Bcl6的表达,支持CD4 + T细胞分化为T滤泡辅助细胞(Tfh)。Tfh细胞随后通过CD40-CD40L相互作用向B细胞提供信号,从而诱导B细胞增殖和分化为抗体分泌细胞。 (B)树突状细胞产生IL-6可抑制TGF-b上调CD4 + T细胞中Foxp3表达的能力,阻止其发育为Treg细胞,而有利于其发育响应RORgt表达进入Th17细胞。这些宿主保护性Th17细胞促进粘膜防御,屏障组织完整性和嗜中性白细胞募集。Th17细胞暴露于树突状细胞来源的IL-23有助于其成熟,使其表达IL-17,IFN-g和GM-CSF并促进慢性组织炎症。IL-27的作用是拮抗CD4 + T细胞向Th17细胞的分化。 (C)树突状细胞分泌的IL-12支持CD4 +和CD8 + T细胞中T-bet的上调,从而促进它们分化为Th1细胞。IL-27支持CD8 + T细胞的扩增及其IFN-g的产生。IL-12和IL-27也可以诱导Tr1的发育(1型调节因子)以共表达IL-10和IFN g的能力为特征的细胞。Tr1细胞的功能是限制炎症性T细胞反应。4、TH1细胞分化模型 在体内和体外,白介素12(IL-12)都是CD4 + T细胞最佳分化为产生高水平干扰素γ(IFN-γ)的T辅助1(TH1)细胞所必需的。但是,最近的研究分析了遗传缺陷型小鼠,其他指导性细胞因子的作用,T细胞受体(TCR)信号的作用以及与TH1细胞承诺有关的可能的随机事件,这些研究表明,IL-12的存在可能不是一种TH1细胞分化的绝对要求。的确,IL-12对于克隆扩展,扩增和固定其表型可能更为重要。 与直接启动幼稚的CD4 + T细胞直接用于TH1细胞分化相比,已经定型的TH1细胞。TCR信号的强度,早期作用的细胞因子(例如IL-27)以及指示性信号或随机事件对T-bet的表达上调可能比IL-12信号在TH1细胞定向中更重要。T-bet由信号转导和转录激活因子1(STAT1)诱导,但不是由STAT4诱导。因此,尽管IFN-γ以及STAT4之外还具有激活STAT1的能力,但IFN-γ以及最有可能的IFN-α和IFN-β都是T-bet的有效诱导剂。因此,IL-12和后续作用因子(例如IL-23和IL-18)对于固定,扩增和维持TH1细胞效应子功能至关重要。值得注意的是,大多数参与TH1细胞分化调节的因素(IL-12,IL-18,IL-23,IL-27,IFN-γ,IFN-α/β等)在对病原体的早期炎症/先天反应期间,吞噬细胞,树突状细胞(DC)和自然杀伤(NK)细胞产生带有抗原–TCR信号的信号,这表明先天反应与适应性免疫之间的相互干扰对于适应性疾病的重要性对病原体的有效反应。5、IL-12抑制肿瘤的Th1细胞的发育 向原始T细胞呈递吸入抗原会导致T细胞分化为产生TH1或TH2细胞因子的细胞。在分化过程中存在的细胞因子环境极大地影响免疫应答的方向性。如果存在IL-12,则T细胞沿TH1模式分化。TH1细胞产生IFN-γ,它抑制TH2细胞分化,并直接抑制许多已知在变应性疾病中重要的效应子过程,例如IgE产生和肥大细胞活化。尽管尚不清楚驱动TH2细胞分化的确切机制,但人们认为IL-4在TH2细胞增殖和TH1细胞因子产生的抑制中很重要。另一方面,IL-13被认为是免疫反应的效应子的关键介体。该细胞因子的过量生产已显示出可诱发该疾病的标志性表现,例如IgE合成,肥大细胞活化,嗜酸性粒细胞炎症和平滑肌收缩。大量证据表明,这两种关键的免疫调节细胞因子的产生失衡发生在特应性和哮喘个体的肺部,从而导致IL-13过度产生,IL-12产生受到损害。尽管尚不清楚什么能提示这两种细胞因子之间的平衡,但最近的证据表明可能与IL4RA或IL13基因的主要缺陷有关。4、IL-23间接或直接促进肿瘤发生,生长和转移的机制的示意图 髓样细胞响应外源或内源性信号(例如损伤相关分子模式(DAMPs),病原体相关分子模式(PAMPs)或肿瘤分泌因子,例如前列腺素E2(PGE2))而产生IL-23。IL-23可以直接作用于肿瘤细胞以促进其转化,增殖和/或转移。在小鼠中,IL-23R在几种先天性和适应性免疫细胞类型中表达,它们在肿瘤中的比例不同。IL-23R在这些免疫细胞上的刺激导致细胞因子(例如IL-17和/或IL-22)的产生,它们可能对基质或肿瘤细胞产生直接的增殖作用。IL-17和/或IL-22还从各种造血和非造血细胞中诱发一系列因素,这些因素可能直接影响肿瘤的增殖和转移,或诱导其他炎症性细胞因子,趋化因子和介体(如IL-6)的产生, IL-8,基质金属肽酶(MMPs)和血管内皮生长因子(VEGF),所有这些都可以促进肿瘤微环境的产生,其中CD8和NK细胞效应子功能被抑制。 5、IL-12的抗肿瘤活性 Reference: [1].Ngiow SF, Teng MW, Smyth MJ. A balance of interleukin-12 and -23 in cancer. Trends Immunol. 2013 Nov;34(11):548-55. doi: 10.1016/j.it.2013.07.004. Epub 2013 Aug 13. PMID: 23954142. [2].Watford WT, Hissong BD, Bream JH, Kanno Y, Muul L, O'Shea JJ. Signaling by IL-12 and IL-23 and the immunoregulatory roles of STAT4. Immunol Rev. 2004 Dec;202:139-56. doi: 10.1111/j.0105-2896.2004.00211.x. PMID: 15546391. [3].Vignali DA, Kuchroo VK. IL-12 family cytokines: immunological playmakers. Nat Immunol. 2012 Jul 19;13(8):722-8. doi: 10.1038/ni.2366. PMID: 22814351; PMCID: PMC4158817. [4].Hunter CA. New IL-12-family members: IL-23 and IL-27, cytokines with divergent functions. Nat Rev Immunol. 2005 Jul;5(7):521-31. doi: 10.1038/nri1648. PMID: 15999093. [5].Langrish CL, McKenzie BS, Wilson NJ, de Waal Malefyt R, Kastelein RA, Cua DJ. IL-12 and IL-23: master regulators of innate and adaptive immunity. Immunol Rev. 2004 Dec;202:96-105. doi: 10.1111/j.0105-2896.2004.00214.x. PMID: 15546388. [6].Pope RM, Shahrara S. Possible roles of IL-12-family cytokines in rheumatoid arthritis. Nat Rev Rheumatol. 2013 Apr;9(4):252-6. doi: 10.1038/nrrheum.2012.170. Epub 2012 Oct 23. PMID: 23090510. [7].Tait Wojno ED, Hunter CA, Stumhofer JS. The Immunobiology of the Interleukin-12 Family: Room for Discovery. Immunity. 2019 Apr 16;50(4):851-870. doi: 10.1016/j.immuni.2019.03.011. PMID: 30995503; PMCID: PMC6472917. [8].Teng MW, Bowman EP, McElwee JJ, Smyth MJ, Casanova JL, Cooper AM, Cua DJ. IL-12 and IL-23 cytokines: from discovery to targeted therapies for immune-mediated inflammatory diseases. Nat Med. 2015 Jul;21(7):719-29. doi: 10.1038/nm.3895. Epub 2015 Jun 29. PMID: 26121196. [9].Wills-Karp M. IL-12/IL-13 axis in allergic asthma. J Allergy Clin Immunol. 2001 Jan;107(1):9-18. doi: 10.1067/mai.2001.112265. PMID: 11149983. [10].Sinigaglia F, D'Ambrosio D, Panina-Bordignon P, Rogge L. Regulation of the IL-12/IL-12R axis: a critical step in T-helper cell differentiation and effector function. Immunol Rev. 1999 Aug;170:65-72. doi: 10.1111/j.1600-065x.1999.tb01329.x. PMID: 10566142. [11].Moschen AR, Tilg H, Raine T. IL-12, IL-23 and IL-17 in IBD: immunobiology and therapeutic targeting. Nat Rev Gastroenterol Hepatol. 2019 Mar;16(3):185-196. doi: 10.1038/s41575-018-0084-8. PMID: 30478416. [12].Trinchieri G. Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat Rev Immunol. 2003 Feb;3(2):133-46. doi: 10.1038/nri1001. PMID: 12563297. [13].Yan J, Smyth MJ, Teng MWL. Interleukin (IL)-12 and IL-23 and Their Conflicting Roles in Cancer. Cold Spring Harb Perspect Biol. 2018 Jul 2;10(7):a028530. doi: 10.1101/cshperspect.a028530. PMID: 28716888; PMCID: PMC6028064. [14].Bohnacker S, Hildenbrand K, Aschenbrenner I, Müller SI, Bieren JE, Feige MJ. Influence of glycosylation on IL-12 family cytokine biogenesis and function. Mol Immunol. 2020 Oct;126:120-128. doi: 10.1016/j.molimm.2020.07.015. Epub 2020 Aug 18. PMID: 32823236. [15].Pan W, Wang Q, Chen Q. The cytokine network involved in the host immune response to periodontitis. Int J Oral Sci. 2019 Nov 5;11(3):30. doi: 10.1038/s41368-019-0064-z. PMID: 31685798; PMCID: PMC6828663. [16].Hunter CA. New IL-12-family members: IL-23 and IL-27, cytokines with divergent functions. Nat Rev Immunol. 2005 Jul;5(7):521-31. doi: 10.1038/nri1648. PMID: 15999093. [17].Mirlekar B, Pylayeva-Gupta Y. IL-12 Family Cytokines in Cancer and Immunotherapy. Cancers (Basel). 2021 Jan 6;13(2):E167. doi: 10.3390/cancers13020167. PMID: 33418929. |
【本文地址】
今日新闻 |
推荐新闻 |
 一、IL-12的功能
一、IL-12的功能 二、自身免疫性
二、自身免疫性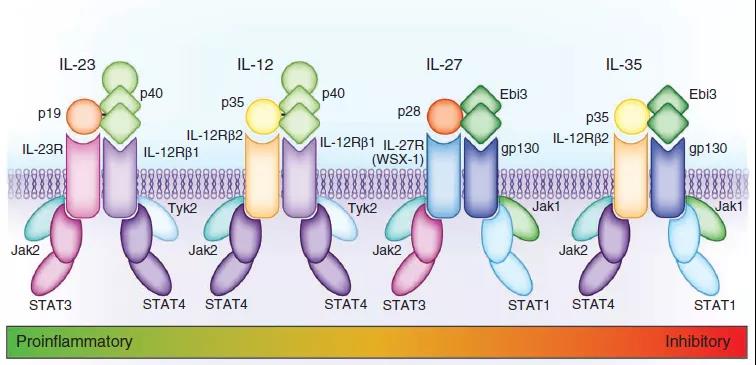
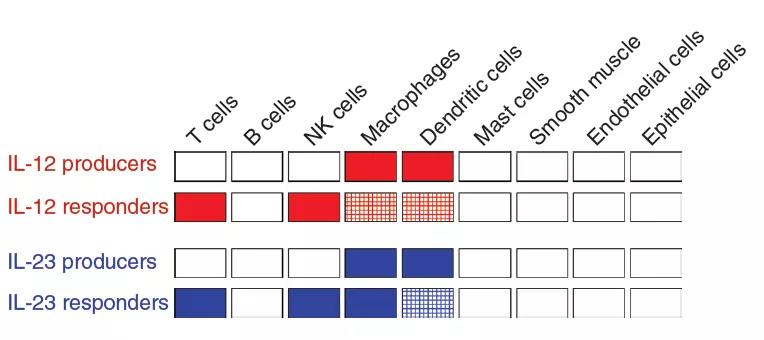 产生IL-12的细胞(p40p35)的细胞分布概述,IL-12应答细胞(IL-12Rb1þIL-12Rb2þ),产生IL-23的细胞(p40p19)和IL-23应答剂(IL-12Rb1þIL-23Rþ)在各种细胞中类型,在人类和小鼠样品之间观察到相似的模式。通常,IL-12和IL-23由巨噬细胞和树突状细胞(DC)产生,其中T细胞,天然杀伤(NK)细胞和某些抗原呈递细胞亚群响应。4、IL-12细胞因子及其受体之间的相互作用
产生IL-12的细胞(p40p35)的细胞分布概述,IL-12应答细胞(IL-12Rb1þIL-12Rb2þ),产生IL-23的细胞(p40p19)和IL-23应答剂(IL-12Rb1þIL-23Rþ)在各种细胞中类型,在人类和小鼠样品之间观察到相似的模式。通常,IL-12和IL-23由巨噬细胞和树突状细胞(DC)产生,其中T细胞,天然杀伤(NK)细胞和某些抗原呈递细胞亚群响应。4、IL-12细胞因子及其受体之间的相互作用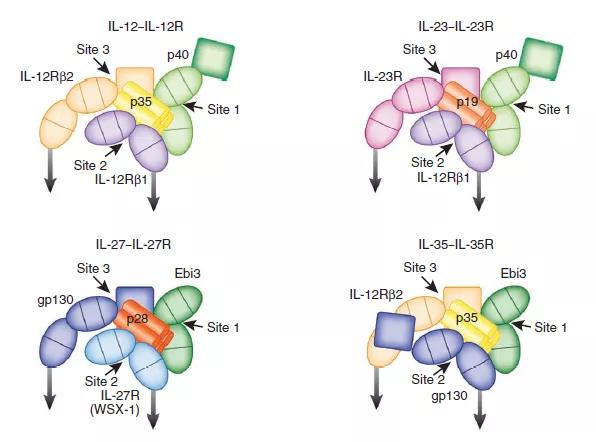 IL-12家族的细胞因子受体复合物的这些结构模型基于IL-6复合物的结构。但是,还有其他复杂形式的模型。灰色的向下箭头表示跨膜锚定的受体链的羧基末端延伸。5、白介素(IL)-12和IL-23信号传导的机制
IL-12家族的细胞因子受体复合物的这些结构模型基于IL-6复合物的结构。但是,还有其他复杂形式的模型。灰色的向下箭头表示跨膜锚定的受体链的羧基末端延伸。5、白介素(IL)-12和IL-23信号传导的机制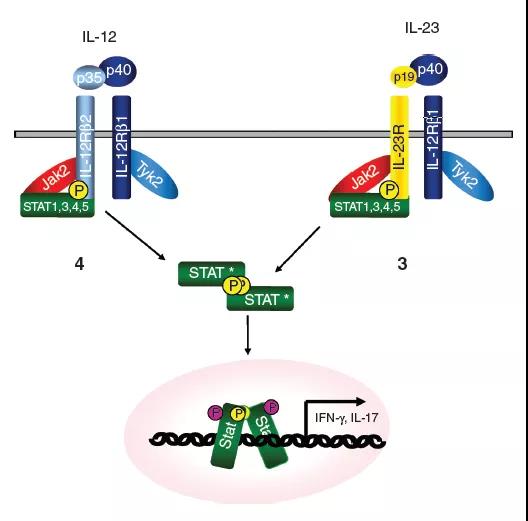 IL-12和IL-23激活Jak / STAT通路。IL-12由分别与IL-12Rb1和b2结合的IL-12p40和p35亚基组成。配体结合使受体链和相关的Jaks(Jak2和Tyk2)紧密接近,从而导致Jak转磷酸化并随后被活化的Jaks磷酸化受体链。IL-12Rb2被磷酸化并充当STAT4的停靠位点。STAT4结合到受体链上,并且自身被磷酸化。STAT4同型二聚体穿梭进入细胞核,并与干扰素(IFN)-g启动子中的STAT结合位点结合,并通过尚不完全清楚的机制诱导IFN-g基因的转录。IL-23是由p40和p19组成的异二聚体细胞因子,分别与IL-12Rb1和IL-23受体(IL-23R)结合。IL-23刺激也会激活Jaks和STAT,但是STAT3而非STAT4似乎是激活的主要STAT。IL-23诱导IFN-g的产生以及促炎细胞因子IL-17的产生。6、参与白介素(IL)-12和IL-23信号传导的途径
IL-12和IL-23激活Jak / STAT通路。IL-12由分别与IL-12Rb1和b2结合的IL-12p40和p35亚基组成。配体结合使受体链和相关的Jaks(Jak2和Tyk2)紧密接近,从而导致Jak转磷酸化并随后被活化的Jaks磷酸化受体链。IL-12Rb2被磷酸化并充当STAT4的停靠位点。STAT4结合到受体链上,并且自身被磷酸化。STAT4同型二聚体穿梭进入细胞核,并与干扰素(IFN)-g启动子中的STAT结合位点结合,并通过尚不完全清楚的机制诱导IFN-g基因的转录。IL-23是由p40和p19组成的异二聚体细胞因子,分别与IL-12Rb1和IL-23受体(IL-23R)结合。IL-23刺激也会激活Jaks和STAT,但是STAT3而非STAT4似乎是激活的主要STAT。IL-23诱导IFN-g的产生以及促炎细胞因子IL-17的产生。6、参与白介素(IL)-12和IL-23信号传导的途径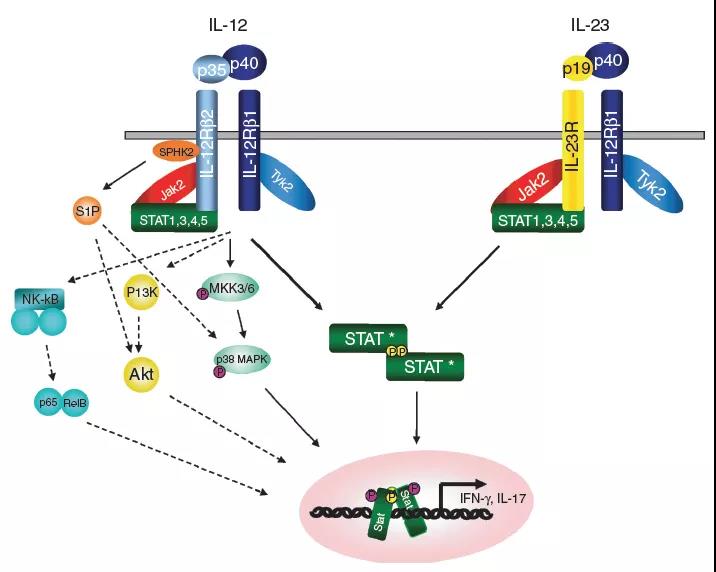 除了特征明确的Jak / STAT途径外,其他途径也显示出对于最佳IL-12信号传导至关重要。IL-12诱导的MKK3 / 6和p38 MAPK激活以及随后的STAT4丝氨酸磷酸化是产生最佳干扰素(IFN)-g的必要条件,以响应IL-12。其他途径可能也可能参与了IL-12受体的信号转导,包括通过PI3K和/或SPHK2激活Akt激活和核因子(NF)-kB分子激活,但是这些途径均参与了IL- 12或IL-23信号缺失或存在争议。7、IL-12受体和信号转导
除了特征明确的Jak / STAT途径外,其他途径也显示出对于最佳IL-12信号传导至关重要。IL-12诱导的MKK3 / 6和p38 MAPK激活以及随后的STAT4丝氨酸磷酸化是产生最佳干扰素(IFN)-g的必要条件,以响应IL-12。其他途径可能也可能参与了IL-12受体的信号转导,包括通过PI3K和/或SPHK2激活Akt激活和核因子(NF)-kB分子激活,但是这些途径均参与了IL- 12或IL-23信号缺失或存在争议。7、IL-12受体和信号转导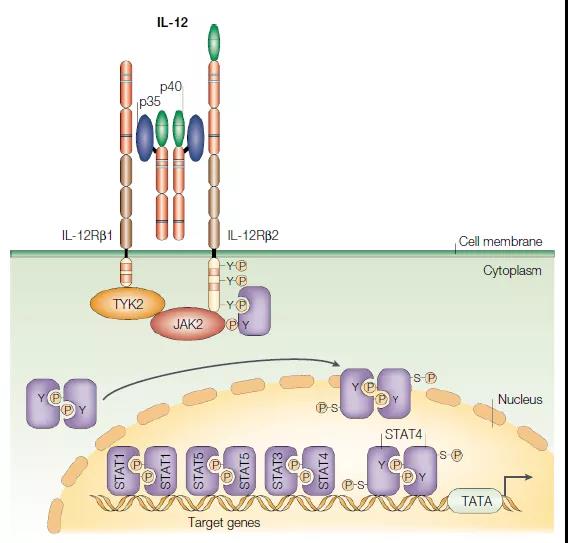
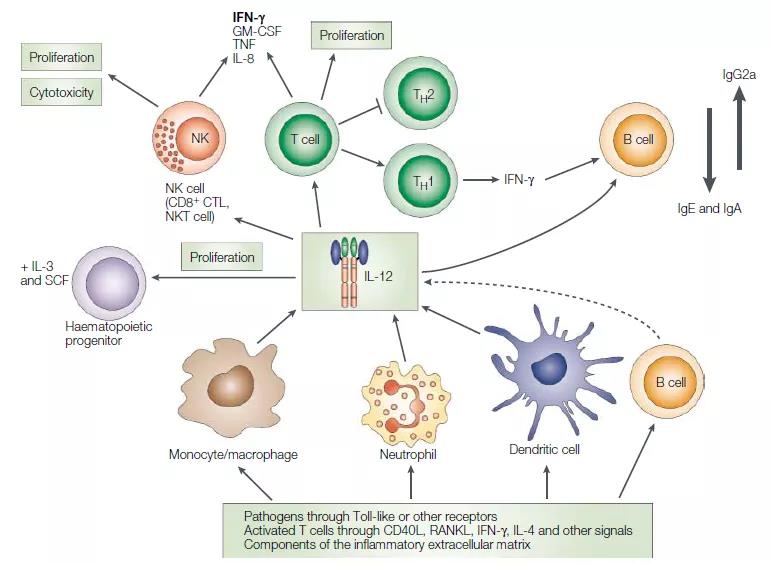 白细胞介素12(IL-12)的主要生理产生者是吞噬细胞(单核细胞/巨噬细胞和嗜中性粒细胞)和树突状细胞,它们通过Toll样受体(TLR)和其他受体对病原体(细菌,真菌,细胞内寄生虫和病毒)作出反应通过CD44和TLR传递来自活化T细胞和自然杀伤(NK)细胞的膜结合信号和可溶性信号,以及炎性细胞外基质的成分(例如低分子量透明质酸)。IL-12在生理上最重要的靶细胞是:造血祖细胞,与其他集落刺激因子协同作用,IL-12诱导增殖和集落形成增加。IL-12诱导NK细胞,NKT细胞和T细胞增殖,增强细胞毒性和细胞毒性介质的表达以及产生细胞因子,尤其是干扰素-γ(IFN-γ),并有利于分化为产生1型细胞因子的细胞(TH1,TC1和NK1细胞);对于B细胞,IL-12直接或通过1型细胞因子(如IFN-γ)的作用增强了TH1相关类免疫球蛋白(例如小鼠的IgG2a)的激活和产生。 2、Il-12和Il-23的生物学
白细胞介素12(IL-12)的主要生理产生者是吞噬细胞(单核细胞/巨噬细胞和嗜中性粒细胞)和树突状细胞,它们通过Toll样受体(TLR)和其他受体对病原体(细菌,真菌,细胞内寄生虫和病毒)作出反应通过CD44和TLR传递来自活化T细胞和自然杀伤(NK)细胞的膜结合信号和可溶性信号,以及炎性细胞外基质的成分(例如低分子量透明质酸)。IL-12在生理上最重要的靶细胞是:造血祖细胞,与其他集落刺激因子协同作用,IL-12诱导增殖和集落形成增加。IL-12诱导NK细胞,NKT细胞和T细胞增殖,增强细胞毒性和细胞毒性介质的表达以及产生细胞因子,尤其是干扰素-γ(IFN-γ),并有利于分化为产生1型细胞因子的细胞(TH1,TC1和NK1细胞);对于B细胞,IL-12直接或通过1型细胞因子(如IFN-γ)的作用增强了TH1相关类免疫球蛋白(例如小鼠的IgG2a)的激活和产生。 2、Il-12和Il-23的生物学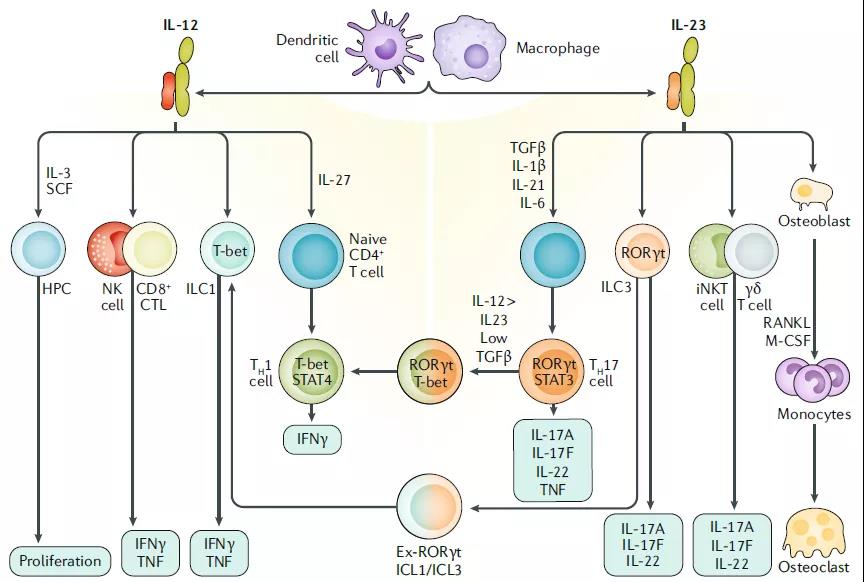
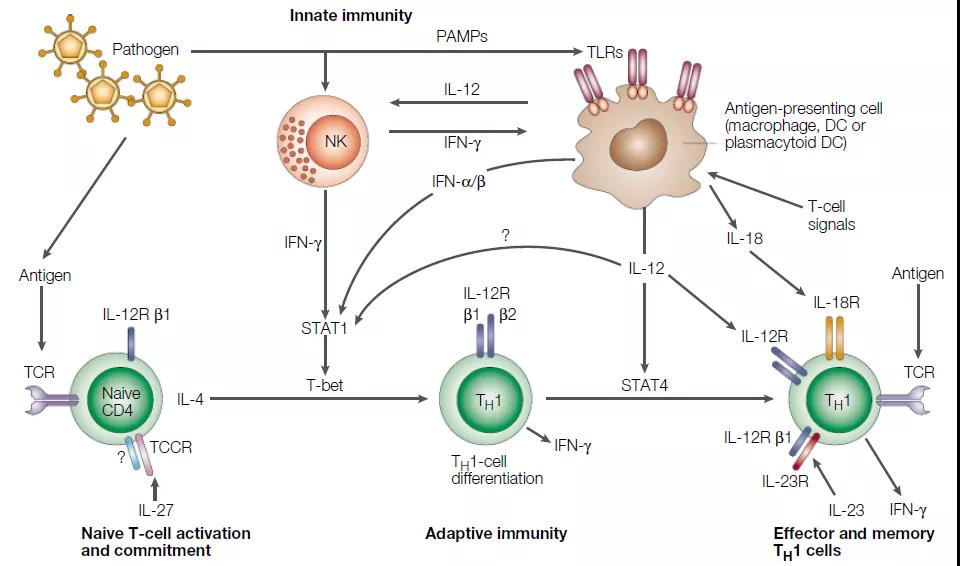
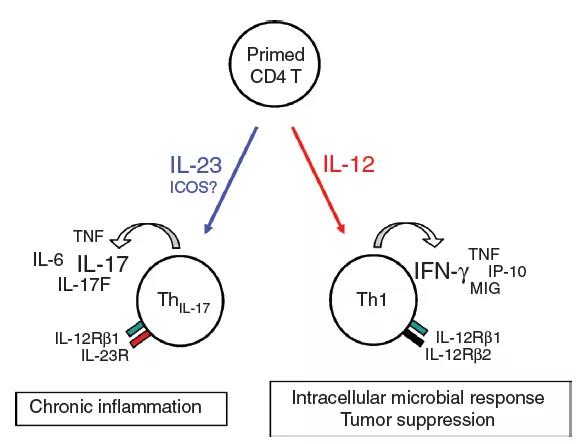 IL-12主要通过诱导干扰素(IFN)-g介导负责抗菌反应和抑制肿瘤的Th1细胞的发育。IL-23推动了以IL-17(ThIL-17)产生为特征的新型T细胞亚群的发展,后者在介导慢性炎症反应中起着核心作用。6、与某些T淋巴细胞群密切相关的细胞因子
IL-12主要通过诱导干扰素(IFN)-g介导负责抗菌反应和抑制肿瘤的Th1细胞的发育。IL-23推动了以IL-17(ThIL-17)产生为特征的新型T细胞亚群的发展,后者在介导慢性炎症反应中起着核心作用。6、与某些T淋巴细胞群密切相关的细胞因子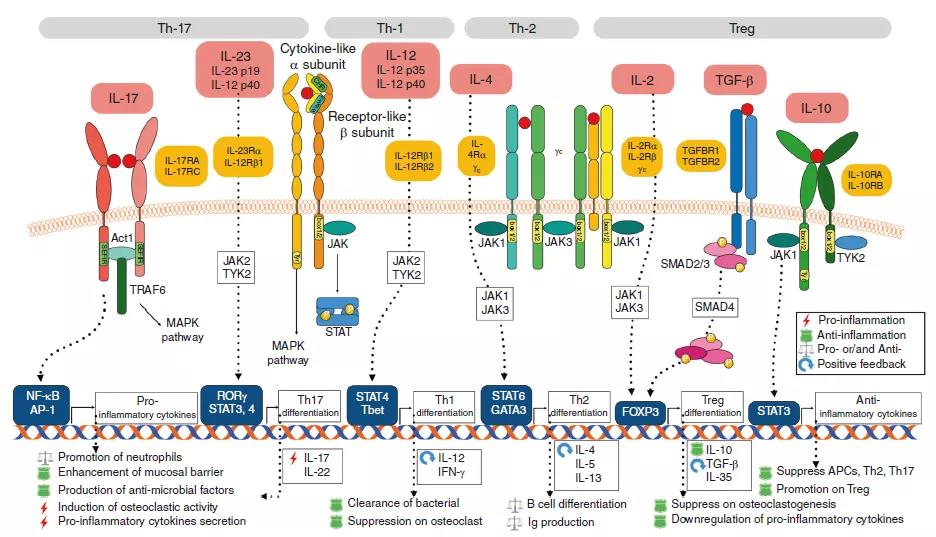 其余大多数细胞因子与特定免疫细胞亚群的分化和/或作用密切相关。在某些炎性细胞因子的刺激下,幼稚的CD4 + T细胞向多个方向分化,包括主要具有保护作用的Th1(IL-12)和Treg(IL-2和TGF-β)细胞,以及Th17(IL-23)和 Th2(IL-4)细胞,主要具有多效作用。如图中所示,IL-17(由Th17细胞分泌)和IL-10(由Treg细胞分泌)下游的信号传导途径对牙周宿主免疫反应具有特异性,并且具有特殊意义。7、白细胞介素(IL)-12在自身免疫中
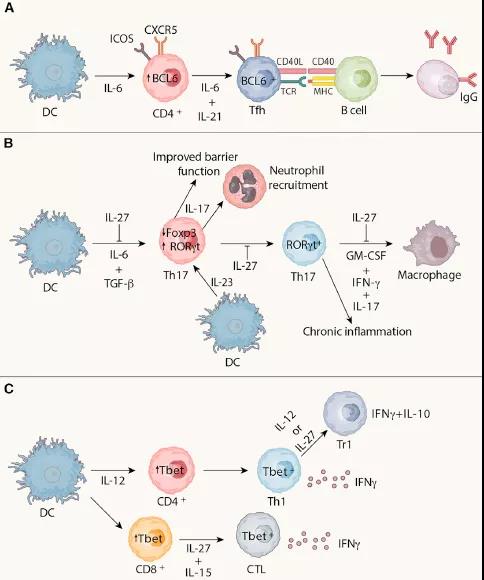
其余大多数细胞因子与特定免疫细胞亚群的分化和/或作用密切相关。在某些炎性细胞因子的刺激下,幼稚的CD4 + T细胞向多个方向分化,包括主要具有保护作用的Th1(IL-12)和Treg(IL-2和TGF-β)细胞,以及Th17(IL-23)和 Th2(IL-4)细胞,主要具有多效作用。如图中所示,IL-17(由Th17细胞分泌)和IL-10(由Treg细胞分泌)下游的信号传导途径对牙周宿主免疫反应具有特异性,并且具有特殊意义。7、白细胞介素(IL)-12在自身免疫中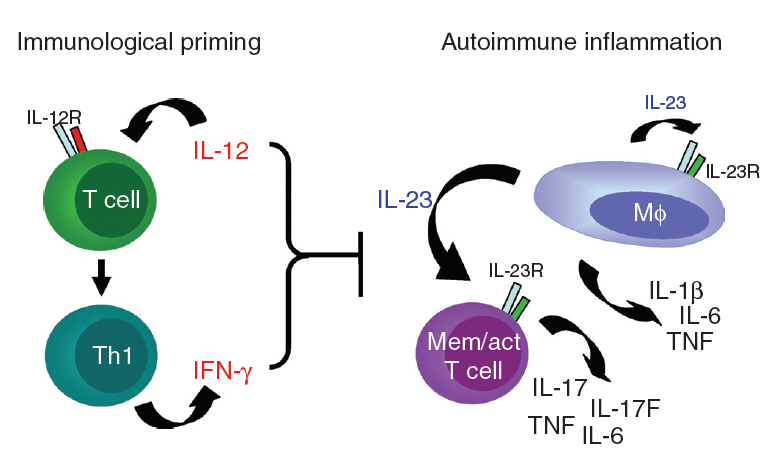 显示了IL-12 /干扰素(IFN)-g和IL-23在T细胞引发事件与终末期自身免疫炎症中各自作用的模型。IL-12 / IFNg可例如通过减少IL-17产生而下调炎症反应的幅度。公认的是,IFN-g在晚期炎症中可能具有双重作用:通过终止活化的T细胞应答而同时刺激巨噬细胞功能的抗炎作用。IL-23R存在于CD4βCD45RBlo记忆T细胞上,但该细胞表型可能还包括严格不是记忆T细胞的活化CD4βT细胞。五、IL-12与疾病1、炎症和肿瘤免疫力
显示了IL-12 /干扰素(IFN)-g和IL-23在T细胞引发事件与终末期自身免疫炎症中各自作用的模型。IL-12 / IFNg可例如通过减少IL-17产生而下调炎症反应的幅度。公认的是,IFN-g在晚期炎症中可能具有双重作用:通过终止活化的T细胞应答而同时刺激巨噬细胞功能的抗炎作用。IL-23R存在于CD4βCD45RBlo记忆T细胞上,但该细胞表型可能还包括严格不是记忆T细胞的活化CD4βT细胞。五、IL-12与疾病1、炎症和肿瘤免疫力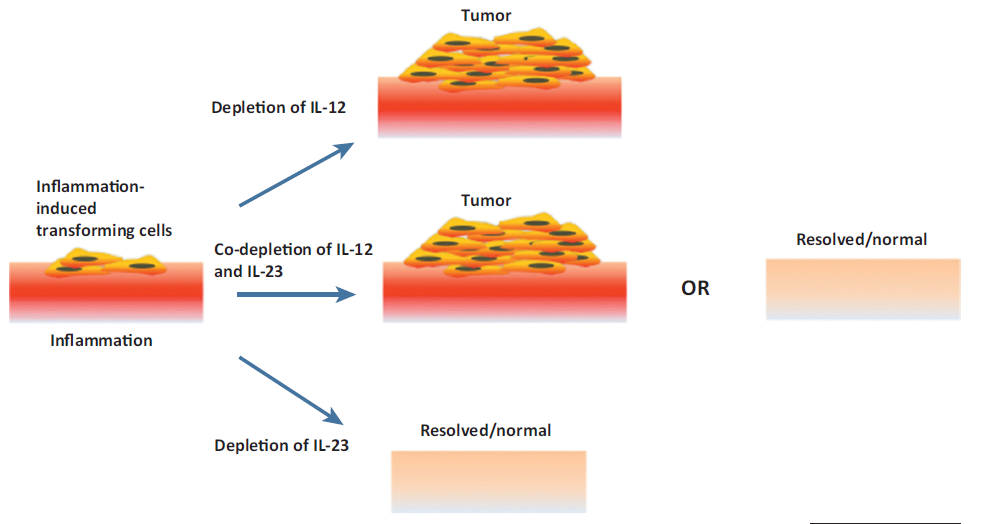 白介素(IL)-23和IL-12的共耗竭可能导致炎症消退或炎症诱导的转化细胞扩增。IL-12的缺乏会损害抗肿瘤T辅助(Th)1反应,从而有可能在宿主体内形成肿瘤。相比之下,在IL-23缺失的宿主中完整的抗肿瘤Th1反应可抑制潜在的肿瘤形成。2、IL-12家族细胞因子对RA发病机制的潜在影响
白介素(IL)-23和IL-12的共耗竭可能导致炎症消退或炎症诱导的转化细胞扩增。IL-12的缺乏会损害抗肿瘤T辅助(Th)1反应,从而有可能在宿主体内形成肿瘤。相比之下,在IL-23缺失的宿主中完整的抗肿瘤Th1反应可抑制潜在的肿瘤形成。2、IL-12家族细胞因子对RA发病机制的潜在影响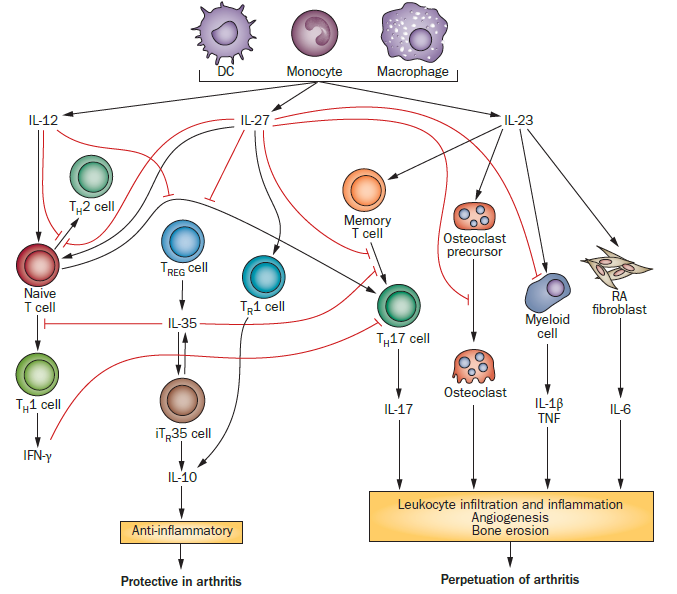 IL-12,IL-23和IL-27由抗原呈递细胞产生,而IL-35由TREG细胞产生。在RA中,IL-12,IL-27和IL‑35可以预防疾病的发病。IL-12和IL-27刺激TH1细胞分化并抑制TH2和TH17极化。IL-12和IL-27抑制TH17细胞分化可能会抑制IL-17介导的RA血管生成和骨侵蚀。IL-27刺激TR1细胞产生IL-10,具有抗炎作用。IL-27还下调了髓样细胞上TNF和IL-1β的受体,并抑制破骨细胞生成。IL-35可能抑制TH17分化并刺激iTR35细胞的产生,进而刺激IL-35的进一步产生和IL-10的分泌。与IL-12和IL-27不同,IL-35可以抑制TH1细胞发育。IL-23可能通过维持TH17细胞并诱导髓样细胞和RA成纤维细胞产生IL-6来诱导IL-1β和TNF的产生,从而使RA病程持久化。3、IL-12和IL-13在过敏性素质中的相互作用的示意图
IL-12,IL-23和IL-27由抗原呈递细胞产生,而IL-35由TREG细胞产生。在RA中,IL-12,IL-27和IL‑35可以预防疾病的发病。IL-12和IL-27刺激TH1细胞分化并抑制TH2和TH17极化。IL-12和IL-27抑制TH17细胞分化可能会抑制IL-17介导的RA血管生成和骨侵蚀。IL-27刺激TR1细胞产生IL-10,具有抗炎作用。IL-27还下调了髓样细胞上TNF和IL-1β的受体,并抑制破骨细胞生成。IL-35可能抑制TH17分化并刺激iTR35细胞的产生,进而刺激IL-35的进一步产生和IL-10的分泌。与IL-12和IL-27不同,IL-35可以抑制TH1细胞发育。IL-23可能通过维持TH17细胞并诱导髓样细胞和RA成纤维细胞产生IL-6来诱导IL-1β和TNF的产生,从而使RA病程持久化。3、IL-12和IL-13在过敏性素质中的相互作用的示意图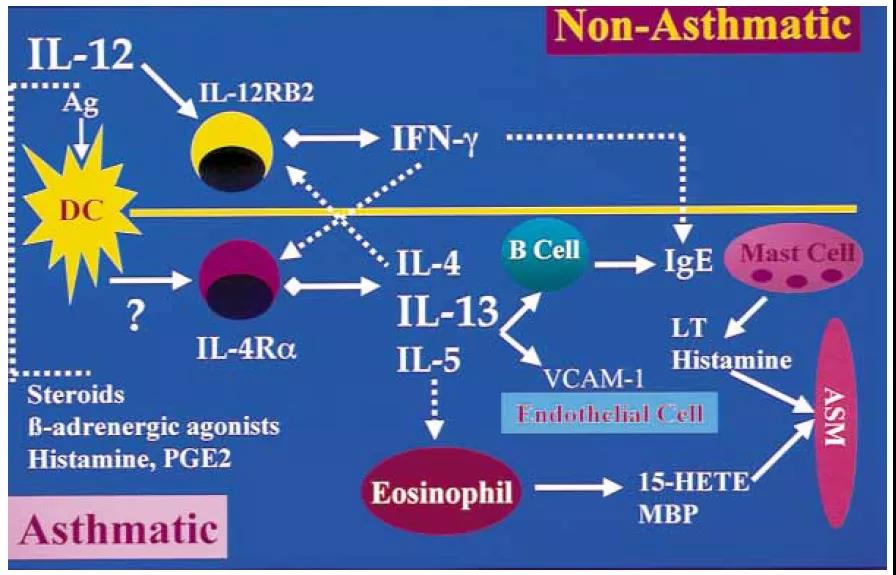
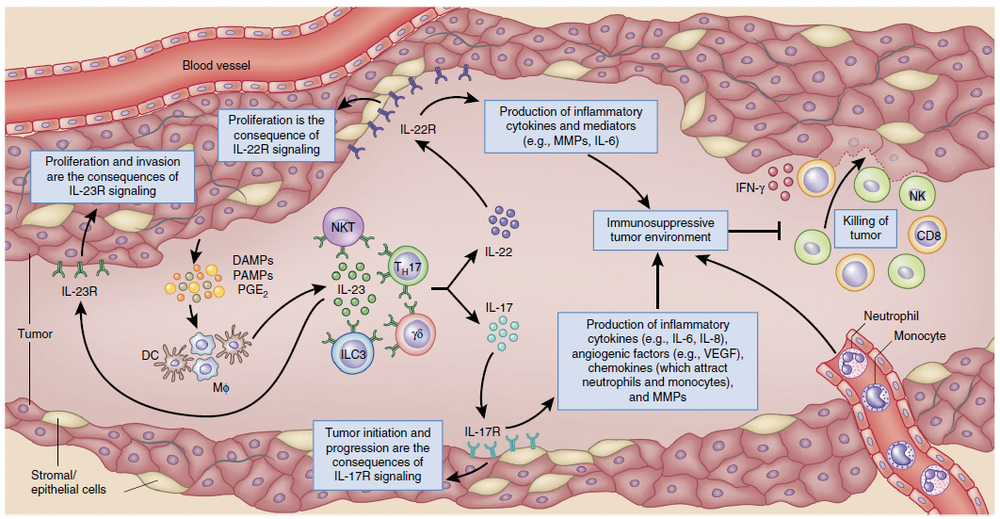
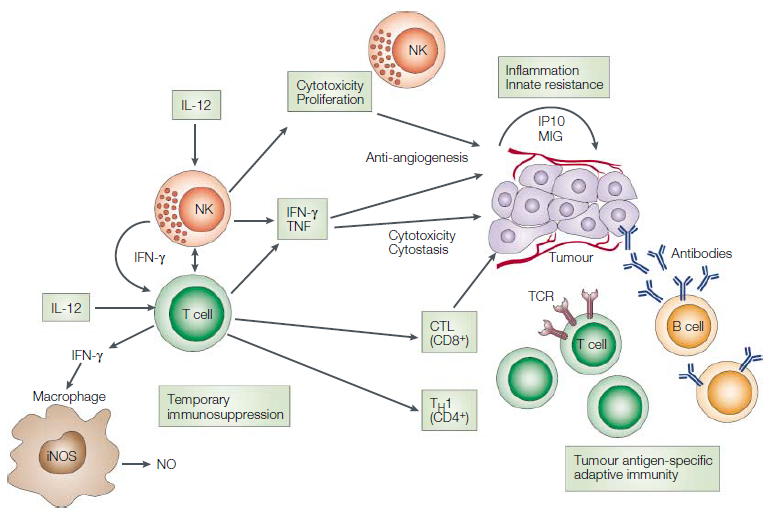 内源性白介素12(IL-12)对于抵抗可移植肿瘤129和抗癌性诱导的纤维肉瘤很重要.IL-12的治疗通过抑制肿瘤的形成或诱导消退对小鼠肿瘤具有显着的抗肿瘤作用。IL-12的抗肿瘤作用很复杂,并利用先天性抵抗力和适应性免疫的效应器机制,因此,IL-12的作用不一定总是需要特异性识别肿瘤抗原。细胞毒性淋巴细胞(CD8 + T细胞,自然杀伤(NK)细胞和NKT细胞)通常参与IL-12的作用机制,但是在某些情况下,由于其抗肿瘤活性,不需要它们的细胞毒活性。干扰素-γ(IFN-γ)和由IL-12诱导的其他继发性和三级促炎细胞因子的级联对肿瘤细胞具有直接毒性作用,并且/或者可能激活有效的抗血管生成机制135-137。IL-12诱导抗原特异性免疫的能力主要取决于其诱导或增强TH1细胞和细胞毒性T淋巴细胞(CTL)反应的能力。除了增强细胞免疫应答外,IL-12还可以通过诱导TH1应答来增强调理素和补体固定类IgG抗体的产生,这些抗体已被证明在体内具有抗肿瘤活性。为了诱导炎性反应,IL-12的施用会产生相当大的毒性,类似于与对严重感染的反应相关的炎性综合征。6、牙周组织的动态平衡,慢性牙周炎的发病机制以及所涉及的细胞因子的作用
内源性白介素12(IL-12)对于抵抗可移植肿瘤129和抗癌性诱导的纤维肉瘤很重要.IL-12的治疗通过抑制肿瘤的形成或诱导消退对小鼠肿瘤具有显着的抗肿瘤作用。IL-12的抗肿瘤作用很复杂,并利用先天性抵抗力和适应性免疫的效应器机制,因此,IL-12的作用不一定总是需要特异性识别肿瘤抗原。细胞毒性淋巴细胞(CD8 + T细胞,自然杀伤(NK)细胞和NKT细胞)通常参与IL-12的作用机制,但是在某些情况下,由于其抗肿瘤活性,不需要它们的细胞毒活性。干扰素-γ(IFN-γ)和由IL-12诱导的其他继发性和三级促炎细胞因子的级联对肿瘤细胞具有直接毒性作用,并且/或者可能激活有效的抗血管生成机制135-137。IL-12诱导抗原特异性免疫的能力主要取决于其诱导或增强TH1细胞和细胞毒性T淋巴细胞(CTL)反应的能力。除了增强细胞免疫应答外,IL-12还可以通过诱导TH1应答来增强调理素和补体固定类IgG抗体的产生,这些抗体已被证明在体内具有抗肿瘤活性。为了诱导炎性反应,IL-12的施用会产生相当大的毒性,类似于与对严重感染的反应相关的炎性综合征。6、牙周组织的动态平衡,慢性牙周炎的发病机制以及所涉及的细胞因子的作用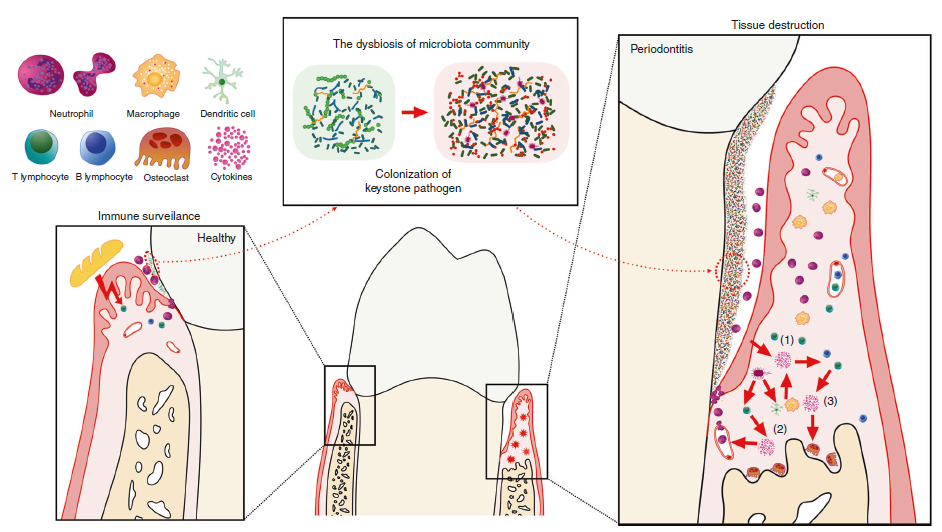 在健康状态下,局部攻击和轻度的宿主免疫反应是平衡的。咀嚼引起的共生菌群和机械刺激均参与局部粘膜免疫的训练。在这种状态下,牙龈沟中有适量的浸润性中性粒细胞,在牙龈组织中有一些驻留的免疫细胞,包括Th17细胞和先天性淋巴样细胞。但是,如果局部微生物群的免疫致病性因梯形病原体的定殖而提高,从而过度激活了宿主的免疫反应,则会引发组织破坏。微生物群与所有宿主细胞之间的相互作用导致细胞因子分泌的第一波(1),其主要参与促炎性细胞因子级联的扩增以及特异性免疫细胞的募集,活化和分化。另外,微生物组刺激后,MNP和APC分泌一组与特定淋巴细胞分化密切相关的细胞因子(2)。这些细胞亚群中的每一个都分泌一定类型的细胞因子,可能充当正反馈因子或直接效应器(3),最终导致组织破坏。7、细胞因子网络在牙周炎的发病机理中
在健康状态下,局部攻击和轻度的宿主免疫反应是平衡的。咀嚼引起的共生菌群和机械刺激均参与局部粘膜免疫的训练。在这种状态下,牙龈沟中有适量的浸润性中性粒细胞,在牙龈组织中有一些驻留的免疫细胞,包括Th17细胞和先天性淋巴样细胞。但是,如果局部微生物群的免疫致病性因梯形病原体的定殖而提高,从而过度激活了宿主的免疫反应,则会引发组织破坏。微生物群与所有宿主细胞之间的相互作用导致细胞因子分泌的第一波(1),其主要参与促炎性细胞因子级联的扩增以及特异性免疫细胞的募集,活化和分化。另外,微生物组刺激后,MNP和APC分泌一组与特定淋巴细胞分化密切相关的细胞因子(2)。这些细胞亚群中的每一个都分泌一定类型的细胞因子,可能充当正反馈因子或直接效应器(3),最终导致组织破坏。7、细胞因子网络在牙周炎的发病机理中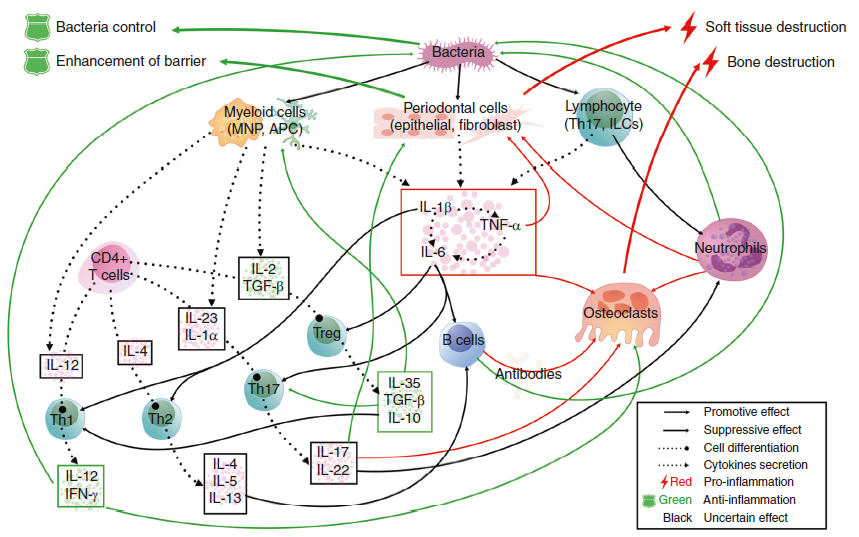 在该图中,在细胞间相互作用的水平上显示了细胞因子在宿主免疫应答中的作用。简而言之,病原体刺激后,宿主牙周细胞和免疫细胞分泌出来自IL-1,IL-6和TNF家族的成熟的促炎细胞因子,激活并募集特定的免疫细胞亚群,并造成直接的组织损伤。然后,幼稚T细胞和B细胞在特定细胞因子的作用下分化为成熟的T细胞或浆细胞,并进一步激活或促进其他效应细胞,例如破骨细胞和嗜中性粒细胞,这些细胞通过分泌细胞促炎剂发挥促炎或抗炎作用。特定的细胞因子簇。在这些细胞亚群中,Th1和Treg细胞主要起保护作用,而Th2 / B和Th17细胞发挥复杂的作用,在某些情况下可能导致组织破坏或保护(实线:细胞因子对细胞的作用以及细胞之间的相互作用;虚线:细胞因子的分泌)8、IL-12家族细胞因子在维持肿瘤发生中效应器和调节性免疫反应之间的平衡中的作用
在该图中,在细胞间相互作用的水平上显示了细胞因子在宿主免疫应答中的作用。简而言之,病原体刺激后,宿主牙周细胞和免疫细胞分泌出来自IL-1,IL-6和TNF家族的成熟的促炎细胞因子,激活并募集特定的免疫细胞亚群,并造成直接的组织损伤。然后,幼稚T细胞和B细胞在特定细胞因子的作用下分化为成熟的T细胞或浆细胞,并进一步激活或促进其他效应细胞,例如破骨细胞和嗜中性粒细胞,这些细胞通过分泌细胞促炎剂发挥促炎或抗炎作用。特定的细胞因子簇。在这些细胞亚群中,Th1和Treg细胞主要起保护作用,而Th2 / B和Th17细胞发挥复杂的作用,在某些情况下可能导致组织破坏或保护(实线:细胞因子对细胞的作用以及细胞之间的相互作用;虚线:细胞因子的分泌)8、IL-12家族细胞因子在维持肿瘤发生中效应器和调节性免疫反应之间的平衡中的作用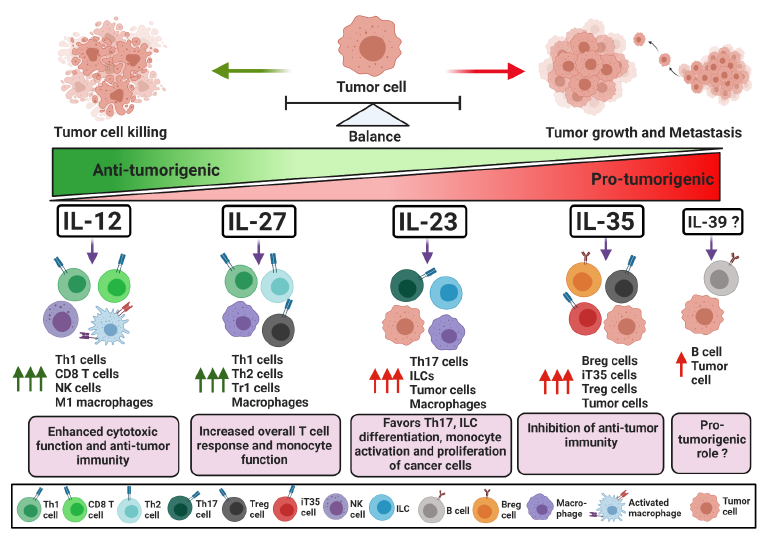 IL-12通过促进M1巨噬细胞极化和Th1细胞产生的IFN-激活激活针对肿瘤细胞的效应免疫反应,进而刺激抗肿瘤细胞毒性CD8 +和NK细胞。IL-27和IL-23对癌症免疫细胞具有双重作用。IL-27和IL-23可以诱导总体T细胞介导的免疫反应,也可以调节免疫抑制性巨噬细胞。此外,IL-23可以刺激肿瘤细胞的增殖和生长。相反,IL-35是一种强免疫抑制细胞因子。它诱导调节性B和T细胞活化和增殖,从而破坏抗肿瘤免疫力并刺激肿瘤生长和转移。最近显示IL-39由B细胞分泌,并可能增加癌细胞的增殖。9、IL-12家族细胞因子的治疗性调节可增强常规治疗的功效
IL-12通过促进M1巨噬细胞极化和Th1细胞产生的IFN-激活激活针对肿瘤细胞的效应免疫反应,进而刺激抗肿瘤细胞毒性CD8 +和NK细胞。IL-27和IL-23对癌症免疫细胞具有双重作用。IL-27和IL-23可以诱导总体T细胞介导的免疫反应,也可以调节免疫抑制性巨噬细胞。此外,IL-23可以刺激肿瘤细胞的增殖和生长。相反,IL-35是一种强免疫抑制细胞因子。它诱导调节性B和T细胞活化和增殖,从而破坏抗肿瘤免疫力并刺激肿瘤生长和转移。最近显示IL-39由B细胞分泌,并可能增加癌细胞的增殖。9、IL-12家族细胞因子的治疗性调节可增强常规治疗的功效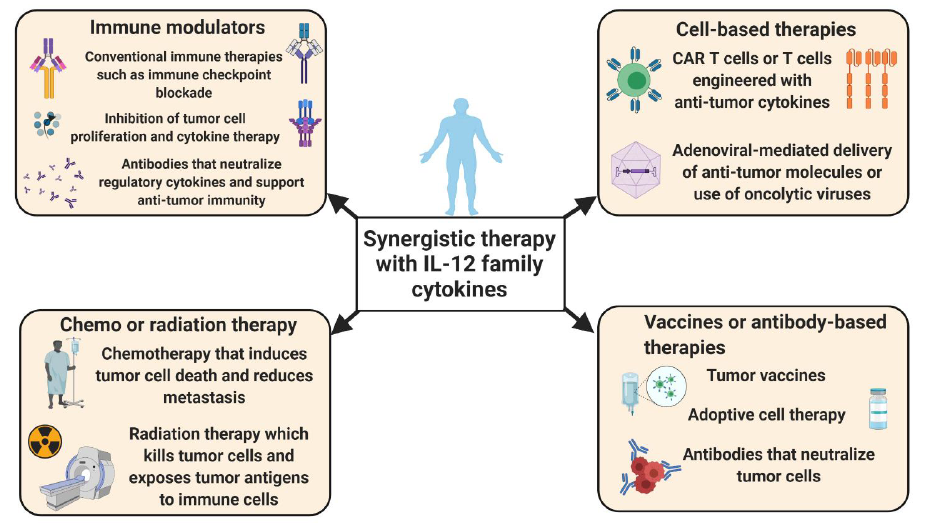 最新研究表明,靶向(上调或下调)IL-12家族细胞因子的疗法与其他标准疗法的结合可能会提高治疗效果。IL-12细胞因子在癌症中的上下文相关功能可以分别驱动抑制剂或增强治疗轴的发展。靶向IL-12家族细胞因子的药物或抗体可能有助于抑制肿瘤微环境(TME)内的免疫抑制,并允许抗肿瘤免疫细胞的浸润和增殖。另外,借助于腺病毒或嵌合抗原受体(CAR)T细胞靶向递送这些细胞因子可增强细胞毒性和肿瘤细胞清除率。这种方法可以使肿瘤细胞对放射线,化学疗法和免疫检查点封锁疗法更加敏感。产品推荐
最新研究表明,靶向(上调或下调)IL-12家族细胞因子的疗法与其他标准疗法的结合可能会提高治疗效果。IL-12细胞因子在癌症中的上下文相关功能可以分别驱动抑制剂或增强治疗轴的发展。靶向IL-12家族细胞因子的药物或抗体可能有助于抑制肿瘤微环境(TME)内的免疫抑制,并允许抗肿瘤免疫细胞的浸润和增殖。另外,借助于腺病毒或嵌合抗原受体(CAR)T细胞靶向递送这些细胞因子可增强细胞毒性和肿瘤细胞清除率。这种方法可以使肿瘤细胞对放射线,化学疗法和免疫检查点封锁疗法更加敏感。产品推荐