提高肝癌免疫治疗的疗效:将肝脏肿瘤由“冷”转“热” |
您所在的位置:网站首页 › immuse面膜用法 › 提高肝癌免疫治疗的疗效:将肝脏肿瘤由“冷”转“热” |
提高肝癌免疫治疗的疗效:将肝脏肿瘤由“冷”转“热”
|
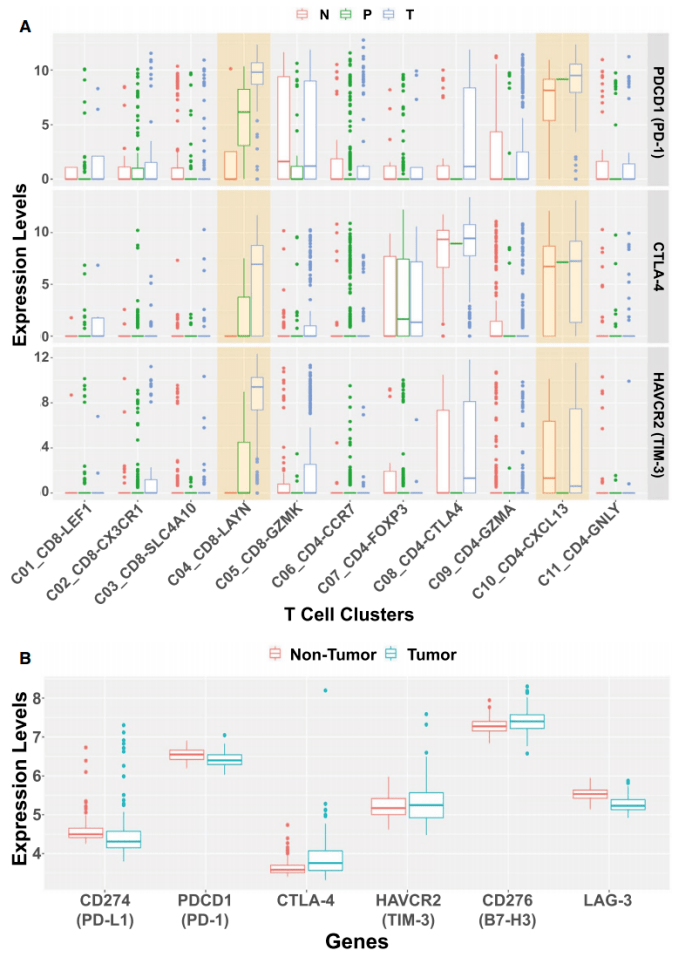
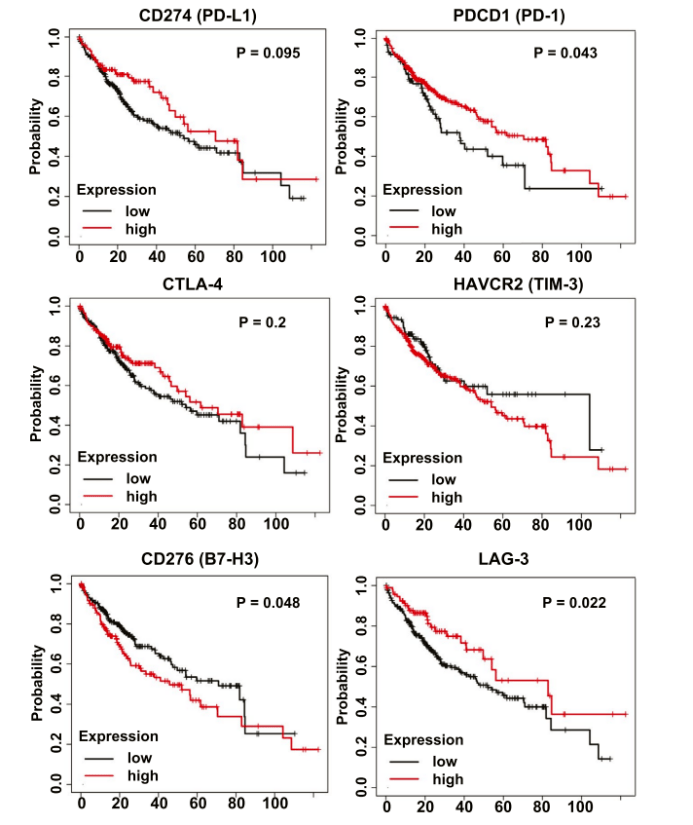
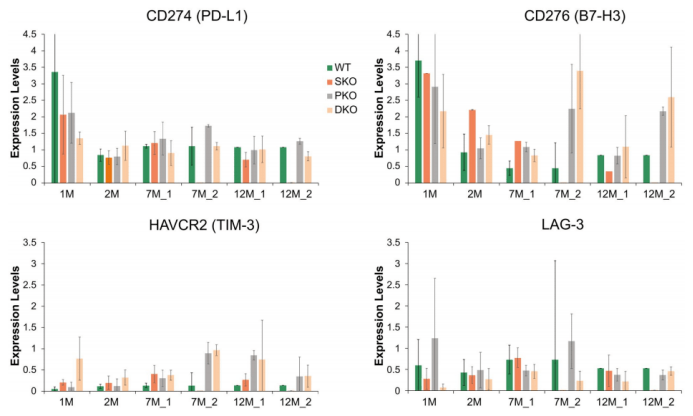
鉴于HCC的发病率不断上升,但仍未找到有效的治疗方法,因此也完全可与理解在一些晚期或接近晚期的黑色素瘤或肺癌患者接受免疫疗法取得惊人疗效后,医生们立即开始使用免疫检查点抑制剂对晚期HCC患者进行临床I/II期试验。 本文简要描述了免疫治疗的短暂历史,从动物模型的开创性工作到实体瘤的临床试验,特别是肝癌的临床试验。鉴于免疫治疗的最初突破性工作是在小鼠肿瘤模型中完成的,提高其在HCC治疗中的效率还需要更深入的机制理解和动物模型的临床前研究。 01 免疫疗法在小鼠肿瘤模型中的初步研究 几十年来,人们发现肿瘤特异性免疫反应非常微弱,不足以根除已经形成的肿瘤。肿瘤细胞已经进化出多种免疫逃逸机制帮助或促进肿瘤发展。然而,对T淋巴细胞免疫抑制辅助受体的鉴定则揭示了通过其阻断来增强抗肿瘤免疫的有趣前景。 细胞毒性T淋巴细胞抗原4(CTLA-4;也称为CD152) 是CD28辅助受体家族的成员,在活化的T细胞和调节性T细胞上表达,在幼稚T细胞上表达较弱。(12)CTLA-4以比CD28更高的亲和力与CD28配体CD80(B7-1) 和CD86(B7-2) 结合,导致T细胞活化的负调控。 1996年,Allison的研究小组发现,腹腔注射抗CTLA-4抗体而不是抗CD28抗体可有效抑制小鼠皮下接种结肠癌51BLim10细胞或Sa1N纤维肉瘤细胞的肿瘤生长。(13)这些结果为阻断T淋巴细胞共刺激途径中的抑制信号可以增强抗肿瘤免疫提供了证据。 PD-1是CD28家族的另一种免疫抑制受体,主要在CD8+T细胞以及调节性T细胞和骨髓源性抑制细胞上表达。辅助受体PD-1的主要功能是调节外周免疫耐受和自身免疫。PD-1通过与其特异性配体程序性死亡配体1(PD-L1;B7-H1,CD274)和程序性死亡配体2(B7-DC,CD273)相互作用来抑制T细胞活化和增殖,特异性配体在抗原呈递细胞(APC)、肿瘤细胞或其他细胞类型上表达。(14,15) Honjo等人证明P815肥大细胞瘤细胞上PD-L1的表达显著增强了在同基因小鼠体内的肿瘤发生和侵袭性。(16)此外,抗PD-L1抗体显著抑制了小鼠皮下接种骨髓瘤细胞的肿瘤生长。这些开创性的研究,连同其他开创性的实验数据,(17)为阻断免疫抑制信号(如T淋巴细胞中CTLA-4和PD-1介导的信号)成为一种有前景的肿瘤治疗新策略铺平了道路。 02 免疫检查点抑制剂在癌症患者中的临床研究 小鼠肿瘤模型的原始实验数据很快转化为癌症患者的临床研究。2006年,Medarex公司在小鼠体内生产的人源化抗PD-1抗体纳武单抗(nivolumab),获FDA批准。纳武单抗的临床试验相继于2006年、2008年分别在美国和日本开始,并于2012年报告了非小细胞肺癌、黑色素瘤和肾细胞癌患者的临床I期试验结果。(18)当新的免疫疗法挽救了一些晚期转移性黑色素瘤或肾癌患者的生命时,全世界为之兴奋。 2013年底,《Science》将癌症免疫疗法选为年度突破,这一决定存在争议。 免疫检查点抑制剂尽管在许多癌症中取得了显著疗效,但人们也认识到,它在相当一部分癌症患者中是无效或仅部分有效。 到目前为止,黑色素瘤、霍奇金淋巴瘤、默克尔细胞、微卫星不稳定性高肿瘤患者对抗PD-1阻断剂的有效率约为40%-70%,而在FDA批准用于免疫治疗的大多数其他癌症中的有效率则较低(10-25%)。 面临的另一个挑战是,临床数据显示,最初有效的患者会产生耐药性,导致疾病复发。因此,一个亟待解决的问题是提高免疫治疗的疗效,将肿瘤由“冷”变“热”并且产生反应。为了实现这一目标,目前许多临床试验正在进行免疫检查点抑制剂与化疗、放疗、抗血管内皮生长因子(VEGF)A药物和放化疗的不同组合试验。只有深入了解低疗效或耐药的根本机制才能使研究成功。 03 肝癌患者的临床试验 作为治疗其他类型实体瘤的先驱,在缺乏动物临床前研究的情况下,免疫检查点抑制剂很快被用于HCC全球多中心临床研究试验。(22,23) 2013年,Sangro等人报道了CTLA-4抗体曲美木单抗在20名晚期HCC(由HCV引起的肝硬化发展所致)患者的初步临床试验。(24)这项开放标签、随机对照、多中心Ⅱ临床研究试验显示曲美木单抗具有良好的安全性以及抗肿瘤和抗病毒活性,这一结果为曲美木单抗能够进一步临床研究开展提供了支持。 2017年,另一份关于纳武单抗在晚期HCC患者中的开放标签、非比较I/II期剂量递增和扩展试验报告发布。这项具有前瞻性的剂量研究共纳入262例多种病因、无论是否使用过索拉非尼治疗的晚期HCC患者。纳武单抗单药治疗的安全性可控,能够显著改善患者的客观缓解率和生存时间,使其能够作为治疗选择进行进一步的研究。 抗PD-1药物帕博利珠单抗(pembrolizumab)在一项非随机、开放标签的II期试验中对104名先前接受过索拉非尼治疗的晚期HCC患者进行了研究。(26)帕博利珠单抗的临床研究与纳武单抗的结果一致,也没有显示出严重的安全性或毒性问题,在乙型肝炎病毒或HCV感染史的HCC患者以及索拉非尼治疗后疾病进展的患者中获得17%的客观缓解率。 和帕博利珠单抗在其他癌症中所报告的免疫相关不良反应一样,最常见的不良反应是甲状腺功能减退症、肾上腺皮质功能减退症和甲状腺炎。肿瘤和免疫细胞中PD-L1的联合表达可以预测对帕博利珠单抗的反应,而单独的肿瘤表达不能预测。 此外,20% (6/30) PD-L1综合评分较低的患者仍然对抗PD -1治疗表现出应答。(26)这些结果强调了在HCC的ICI治疗中纳入生物标志物的更细化策略的需要。 全球范围内许多其他正在进行的免疫检查点抑制剂治疗HCC的临床试验(包括针对晚期HCC患者的两项III期试验),预计每年都会产生越来越多新的试验和正在进行的试验报告。这些临床试验的目的是评估抗CTLA-4和抗PD-1或PD-L1抗体与其他药物或物理治疗方案的联合治疗策略。(27,28) 特别是,随着免疫检查点抑制剂联合激酶抑制剂的化疗和局部治疗(如射频消融(RFA)、微波消融和冷冻消融)证明可以增强肿瘤特异性免疫反应,越来越多的人对其兴趣日渐浓厚。(29) 04 肝脏中的特殊免疫微环境 临床试验的初步报告表明免疫疗法在HCC中的反应率低且治疗效果有限。(25,26)肝脏的免疫耐受性对临床结果的影响不容忽视,然而,肝脏的免疫耐受性过程并没有被完全理解。 肝脏是人体主要的代谢器官,通过门静脉接收来自肝动脉和肠道的血液,在免疫调节中也起着核心作用。从肠道循环到肝脏的血液除了营养物质外,还含有微生物、微生物相关分子模式和损伤相关分子模式,(在“肝窦”结构中被有效识别、处理或去除)。 与此功能一致,肝窦内皮细胞表达的多种模式识别受体负责清除血液中的可溶性大分子和胶体废物。(30)肝脏中有最多的巨噬细胞,能表达多种类型PRR,通过吞噬作用识别和去除不溶性废物。肝脏的另一个显著特征是自然杀伤(NK)、自然杀伤T细胞和T细胞受体γδT细胞的富集以及相对于外周血更高的CD8+与CD4+T细胞比率。 肝脏最重要的免疫学特性之一是T细胞耐受的诱导状态导致肝脏耐受,防止对肠道吸收的抗原产生过度免疫反应。虽然潜在机制仍有待阐明,肝脏免疫抑制环境显然是由幼稚T细胞、肝窦内皮细胞、树突细胞、库普弗细胞(KC)和肝细胞的协调活动维持,由促炎和抗炎细胞因子环境介导。(31,32) 在没有共刺激分子和低CD4+细胞的情况下,持续抗原呈递以及来自库普弗细胞的白细胞介素-10对调节性T细胞的扩增可能会诱导肝脏中的T细胞耐受。(31)尽管这些免疫抑制策略对维持肝脏稳态至关重要,对HCC免疫逃逸的潜在作用同样不容忽视。 05 原发性肝癌的免疫学景观 众所周知,肝脏恶性肿瘤通常发生在慢性“坏死性炎症”的背景下,其特征是细胞死亡、代偿性再生、肝星状细胞和纤维化的过度激活以及浸润性炎症细胞和淋巴细胞的功能改变。在设计针对HCC的有效免疫治疗方案时,必须解决两个关键问题:(1)肝脏肿瘤细胞的免疫原性强度,(2)促进HCC进展的免疫逃逸具体机制。 在HCC患者中检测到与全身炎症反应相关的自发性肿瘤消退,表明至少有一定的肝癌基础免疫原性。(33)此外,据估计,有超过一半的HCC患者对肿瘤相关抗原产生自发性免疫应答,如纽约食管鳞状细胞癌1。(34)据报道,经皮乙醇注射和射频消融(RFA)可以引起T细胞浸润到肝肿瘤组织中。(35,36) 最近,Zhang团队的深度单细胞RNA测序 (RNA-seq) 揭示了人类HCC样本中CD8+T细胞和调节性T细胞的富集和克隆扩增。(37)在HCC样本分析中还检测到一系列已知和未充分表征的衰竭相关基因,为进一步剖析HCC浸润T细胞功能提供潜在的生物标志物。 值得注意的是,在活化CD8+T细胞和调节性T细胞中升高的细胞表面膜蛋白Layilin(LAYN)与预后不良有关,在体外抑制原代CD8+T细胞发现有γ-干扰素产生。在LAYN+CD8+和CXCL13+CD4+T细胞亚群中检测到更高水平的PDCD1、CTLA-4和甲型肝炎病毒细胞受体2(HAVCR2)表达(图1A)。 TIGER-LC联盟的Wang及其同事在对来自泰国的HCC/ICC(肝内胆管癌)患者进行了大规模基因表达谱分析。(38)用稳健多阵列平均(RMA)对微阵列数据进行归一化处理,用GEO2R进行分析。在肿瘤和周围的非肿瘤组织,PD-L1、PD-1、CTLA4、T细胞免疫球蛋白和含粘蛋白结构域-3(TIM3)、B7H3、淋巴细胞激活3(LAG3)等免疫抑制基因的表达未见显着差异(图1B)。 从癌症基因组图谱 (TCGA)数据库中提取并进行了HCC患者数据的生物信息学分析。Kaplan-Meier绘图显示患者的存活率与CD274、CTLA-4、HAVCR2和LAG3的表达水平之间没有相关性(图2)。CD276(B7-H3)的低表达比高表达组显示出适度但显着更好的存活率,而PDCD1 (PD-1) 的低表达比高表达组的预后更差(图2)。 在最近的实验中,我们证明了肝细胞中酪氨酸蛋白磷酸酶非受体Ⅱ型/Src同源区2域含磷酸酶2 (Shp2) 的额外缺失会加剧和加速非酒精性脂肪性肝炎(NASH)-HCC/ICC在磷酸酶和张力蛋白中的发展同系物(Pten) 缺陷型肝脏。(39) 因此,肝细胞特异性敲除Shp2(SKO)、Pten(PKO) 或Shp2和Pten (DKO)的小鼠品系的特征表现为:肝脏肿瘤发生的严重程度增加,为探究NASH驱动肝癌发生的潜在机制提供了很好的动物模型。然而,RNA-seq数据的详细分析表明,在这些小鼠模型中,在肿瘤起始和发展过程中,免疫抑制基因的表达谱没有明显的趋势(图3) 。 连环蛋白β-1突变和Myc过度表达是人类HCC中两种常见的基因病变。 在小鼠模型中,由水动力注射这些致癌基因驱动的肝脏肿瘤对抗PD-1治疗反应不佳。(41)从机制上讲,Wnt/β-catenin通路的异常激活导致趋化因子表达受损,尤其是C-C基序趋化因子受体5,导致树突状细胞和CD8+T细胞向肝脏募集缺陷。这些缺陷导致HCC的免疫逃逸和对PD-1抗体的低反应,与在人HCC中的β-连环蛋白激活和抗PD-1治疗耐药之间的关联一致。(42)
图1
图2
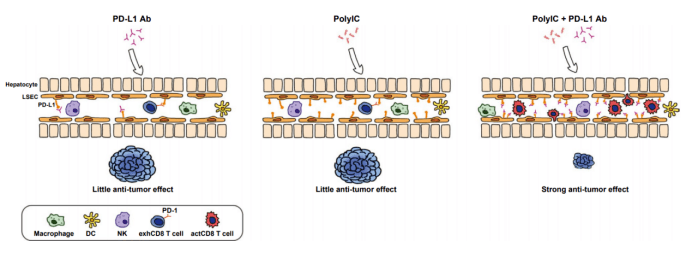
图3 06 将肝肿瘤从“冷”转“热” 如上所述,最近的小鼠和人的试验数据在一定程度上解释了为什么HCC通常是冷肿瘤,对免疫检查点抑制剂反应不佳。因此,迫切需要确定冷HCC肿瘤是否以及如何转化为热肿瘤。 合理的方法是基于动物模型机制研究的探索治疗方案。最初旨在剖析肝细胞和库普弗细胞在驱除HCC的联系时,意外发现聚肌苷-聚胞苷酸(polyIC) 对小鼠肿瘤抑制的有效作用。(43)polyIC是一种合成的双链RNA,能有效激活模式识别受体Toll样受体3、视黄酸诱导基因I/黑色素瘤分化相关蛋白5和激活的蛋白激酶RNA。(44) 它的合成成分已被用于在干扰素反应性Mx动力蛋白如GTPase1(Mx1)启动子的控制下诱导Cre重组酶的表达。(45)polyIC有效地抑制了由化学致癌物或Pten缺陷肝脏中的肝脂肪变性驱动的肝脏肿瘤发生。此外,我们证明了polyIC能有效抑制肝癌的产生,但对肿瘤进展没有治疗作用。(43) 从机制上讲,合成的双链RNA刺激了肝脏中的多种先天免疫群体,包括NK细胞、M1巨噬细胞和树突细胞。这些先天抗肿瘤功能的协同激活使“高风险”转化细胞在癌前阶段清除,从而预防肝癌的发生。 单独注射抗PD-L1抗体在小鼠HCC模型中没有显示出任何显著的肿瘤抑制作用。(46)另一组在转基因小鼠中获得了类似的结果:PD-L1/PD-1在HCC中阻断反应率较低。(41) 肿瘤发展过程中,肿瘤细胞、周围肝细胞或非实质细胞中未检测到显著的PD-L1表达,可以预测在动物模型中的低反应率。动物试验数据与在HCC患者中观察到的对免疫检查点抑制剂的低反应一致。有趣的是,RNA-seq数据分析表明,polyIC刺激了多种炎症和免疫调节分子的肝脏表达,尤其是CD274(PD-L1) 上调。(43) 进一步的实验表明,polyIC诱导的PD-L1主要在LSECs中上调,在其他非实质细胞(包括肝脏中的巨噬细胞和树突状细胞) 中检测到较低的响应。(46)LSECs已被认为是一种针对肠道微生物群的特殊结构和免疫屏障,是肝脏吸收营养的平台。最近的实验表明,LSECs在肝脏中作为一种特殊类型的APC起作用,能够将可溶性外源抗原交叉呈递给CD8+T细胞。(47)循环癌胚抗原被LSECs交叉呈递以诱导CD8+T细胞耐受。 LSEC中PD-L1的强烈诱导促使我们测试了polyIC与PD-1/PD-L1阻断的联合治疗。事实上,与单独使用polyIC或PD-L1抗体相比,polyIC和PD-L1抗体联用对几种小鼠肝癌模型的肿瘤进展有较强的抑制作用。(46)重要的是,在小鼠肿瘤进展后期组合使用时,甚至观察到了显著的抑瘤作用。虽然其分子基础仍有待阐明,但值得注意的是,该联合治疗的CD8+T细胞大量聚集和浸润到肝脏。 我们还发现LSEC中PD-L1表达的polyIC依赖性诱导与肿瘤形成无关,因为它在健康和荷瘤肝脏中均被检测到。因此,这种方法不依赖于HCC肿瘤对各种免疫逃避机制的破坏。相反,它利用了独特的肝脏先天免疫功能,尤其是LSEC在募集和激活细胞毒性CD8+T细胞方面的特定作用。 总之,小鼠的这些临床前数据证明了可以使肝脏肿瘤对免疫检查点抑制剂治疗敏感的一种可行方法(图4)。据报道,polyIC和PD-L1抗体的组合可抑制皮下肿瘤的生长。(49)然而,单独使用其中任何一种都能显著抑制该模型中的皮下肿瘤生长。 相比之下,我们获得的实验结果显示尽管PD-L1抗体抑制了同一细胞系皮下肿瘤的生长(Xin等人,未发表的数据),PD-L1抗体对肝脏中生长的肿瘤(来自结肠癌细胞的脾脏注射)没有抑制作用。这些结果强调了在特殊的肝肿瘤微环境中使用合适的动物模型来研究HCC发病机制和治疗的重要性。
图4 06 展望 毫无疑问,免疫检查点抑制剂疗法已经改变了肿瘤治疗。尽管全球正在进行许多临床试验,但尚不清楚这种范式转换策略将如何使HCC患者受益。 尽管可以通过根据可靠的生物标志物选择患者来改善低反应率,但更具变革性的方法是使用额外的药物将低反应或无反应患者转变为免疫检查点抑制剂反应者。最近的小鼠实验数据为这一前景提供了临床前支持。 鉴于免疫检查点抑制剂治疗的原理最早是在小鼠肿瘤模型中证明的,我们认为其在HCC治疗中的改善也需要详细的机制分析和动物肝脏抗肿瘤免疫的功能解剖。临床前和临床研究相结合,将识别肝脏肿瘤发生中的免疫抑制分子和途径,成为HCC治疗的特异性靶点。 尽管付出了大量努力,肝癌研究至今没有出现一个单一有效的治疗药物(因为索拉非尼最初是为肾癌开发的,而免疫检查点抑制剂最初是在其他实体瘤中有效)。这种情况可以通过阐明和利用肝脏中特殊的免疫细胞组成、动力学和功能来改变,从而开发更有效的治疗方案。 事实上,HCC研究和治疗正在取得进展。在查阅文献时,芬恩等人的一份新报告提及:阿特珠单抗(抗PD-L1)和贝伐珠单抗(抗VEGF)联合在治疗不可切除的HCC(IMbrave150)时比索拉非尼具有更好的总生存期。(50) 在这项全球、开放标签的阿特珠单抗-贝伐珠单抗临床3期试验中,一共入组336名患者,其中索拉非尼组165名患者。阿特珠单抗-贝伐珠单抗组12个月的总生存率为67.2%(索拉非尼组为54.6%),中位无生存期(PFS) 为6.8个月(索拉非尼组为4.3个月)。 作为一种成功的HCC疗法,阿特珠单抗-贝伐珠单抗联合治疗可以提高生存率,此研究也为联合免疫疗法提供了广阔的前景。 参考文献(上下滑动查看更多) 1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015;136:E359-E386. 2. Llovet JM, Zucman-Rossi J, Pikarsky E, Sangro B, Schwartz M, Sherman M, et al. Hepatocellular carcinoma. Nat Rev Dis Primers 3. 2016;2:16018. Ryerson AB, Eheman CR, Altekruse SF, Ward JW, Jemal A, Sherman RL, et al. Annual Report to the Nation on the Status of Cancer, 1975-2012, featuring the increasing incidence of liver 4. cancer. Cancer 2016;122:1312-1337. Zhang B, Zhang B, Zhang Z, Huang Z, Chen Y, Chen M, et al. 42,573 cases of hepatectomy in China: a multicenter retrospective investigation. Sci China Life Sci 2018;61:660-670. 5. Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J 6. Med 2008;359:378-390. European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASLEORTC clinical practice guidelines: management of hepatocellu- 7. lar carcinoma. J Hepatol 2012;56:908-943. Bruix J, Qin S, Merle P, Granito A, Huang YH, Bodoky G, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, 8. double-blind, placebo-controlled, phase 3 trial. Lancet 2017;389: 56-66. Kudo M, Finn RS, Qin S, Han KH, Ikeda K, Piscaglia F, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet 2018;391:1163-1173. 9. Abou-Alfa GK,Meyer T, Cheng AL, El-Khoueiry AB, Rimassa L, Ryoo BY, et al. Cabozantinib in patients with advanced and progressing hepatocellular carcinoma. N Engl J Med 2018;379:54-63. 10. Llovet JM, Hernandez-Gea V. Hepatocellular carcinoma: reasons for phase III failure and novel perspectives on trial design. Clin 11. Cancer Res 2014;20:2072-2079. Feng GS. Conflicting roles of molecules in hepatocarcinogenesis: paradigm or paradox. Cancer Cell 2012;21:150-154. 12. Chambers CA, Kuhns MS, Egen JG, Allison JP. CTLA-4- mediated inhibition in regulation of T cell responses: mechanisms and manipulation in tumor immunotherapy. Annu Rev Immunol 13. 2001;19:565-594. Leach DR, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA-4 blockade. Science 1996;271:1734-1736. 14. Dong H, Zhu G, Tamada K, Chen L. B7–H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion. Nat Med 1999;5:1365-1369. 15. Freeman GJ, Long AJ, Iwai Y, Bourque K, Chernova T, Nishimura H, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000;192:1027-1034. 17. Curiel TJ, Wei S, Dong H, Alvarez X, Cheng P, Mottram P, et al. Blockade of B7–H1 improves myeloid dendritic cellmediated antitumor immunity. Nat Med 2003;9:562-567. 19. Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell 2015;27:450-461. 20. Schoenfeld AJ, Hellmann MD. Acquired resistance to immune checkpoint inhibitors. Cancer Cell 2020;37:443-455. 21. Tang J, Shalabi A, Hubbard-Lucey VM. Comprehensive analysis of the clinical immuno-oncology landscape. Ann Oncol 2018;29:84-91. 22. Makarova-Rusher OV, Medina-Echeverz J, Duffy AG, Greten TF. The yin and yang of evasion and immune activation in HCC. J Hepatol 2015;62:1420-1429. 23. Hato T, Goyal L, Greten TF, Duda DG, Zhu AX. Immune checkpoint blockade in hepatocellular carcinoma: current progress and future directions. Hepatology 2014;60:1776-1782. 24. Sangro B, Gomez-Martin C, de la Mata M, Inarrairaegui M, Garralda E, Barrera P, et al. A clinical trial of CTLA-4 blockade with tremelimumab in patients with hepatocellular carcinoma and chronic hepatitis C. J Hepatol 2013;59:81-88. 26. Zhu AX, Finn RS, Edeline J, Cattan S, Ogasawara S, Palmer D, et al. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): a non-randomised, open-label phase 2 trial. Lancet Oncol 2018;19:940-952. 27. Greten TF, Sangro B. Targets for immunotherapy of liver cancer. J Hepatol 2017 Sep 18. https://doi.org/10.1016/j.jhep.2017.09.007. Online ahead of print. 28. Tian M, Shi Y, Liu W, Fan J. Immunotherapy of hepatocellular carcinoma: strategies for combinatorial intervention. Sci China Life Sci 2019;62:1138-1143. 29. Greten TF, Mauda-Havakuk M, Heinrich B, Korangy F, Wood BJ. Combined locoregional-immunotherapy for liver cancer. J Hepatol 2019;70:999-1007. 30. Gao B, Jeong WI, Tian Z. Liver: an organ with predominant innate immunity. Hepatology 2008;47:729-736. 31. Ringelhan M, Pfister D, O’Connor T, Pikarsky E, Heikenwalder M. The immunology of hepatocellular carcinoma. Nat Immunol 2018;19:222-232. 32. Jenne CN, Kubes P. Immune surveillance by the liver. Nat Immunol 2013;14:996-1006. 33. Prieto J, Melero I, Sangro B. Immunological landscape and immunotherapy of hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol 2015;12:681-700. 35. Ohnishi K. Comparison of percutaneous acetic acid injection and percutaneous ethanol injection for small hepatocellular carcinoma. Hepatogastroenterology 1998;45(Suppl. 3):1254-1258. 36. Shiina S, Tagawa K, Unuma T, Takanashi R, Yoshiura K, Komatsu Y, et al. Percutaneous ethanol injection therapy for hepatocellular carcinoma. A histopathologic study. Cancer 1991;68:1524-1530. 37. Zheng C, Zheng L, Yoo JK, Guo H, Zhang Y, Guo X, et al. Landscape of infiltrating T cells in liver cancer revealed by single-cell sequencing. Cell 2017;169:1342-1356.e16. 38. Chaisaingmongkol J, Budhu A, Dang H, Rabibhadana S, Pupacdi B, Kwon SM, et al. Common molecular subtypes among Asian hepatocellular carcinoma and cholangiocarcinoma. Cancer Cell 2017;32:57-70.e3. 41. Ruiz de Galarreta M, Bresnahan E, Molina-Sanchez P, Lindblad KE, Maier B, Sia D, et al. β-catenin activation promotes immune escape and resistance to anti-PD-1 therapy in hepatocellular carcinoma. Cancer Discov 2019;9:1124-1141. 42. Harding JJ, Nandakumar S, Armenia J, Khalil DN, Albano M, Ly M, et al. Prospective genotyping of hepatocellular carcinoma: clinical implications of next-generation sequencing for matching patients to targeted and immune therapies. Clin Cancer Res 2019;25:2116-2126. 43. Lee J, Liao R, Wang G, Yang BH, Luo X, Varki NM, et al. Preventive inhibition of liver tumorigenesis by systemic activation of innate immune functions. Cell Rep 2017;21:1870-1882. 44. Barton GM, Medzhitov R. Toll-like receptor signaling pathways. Science 2003;300:1524-1525. 45. Kuhn R, Schwenk F, Aguet M, Rajewsky K. Inducible gene targeting in mice. Science 1995;269:1427-1429. 47. Limmer A, Ohl J, Kurts C, Ljunggren HG, Reiss Y, Groettrup M, et al. Efficient presentation of exogenous antigen by liver endothelial cells to CD8+ T cells results in antigen-specific T-cell tolerance. Nat Med 2000;6:1348-1354. 48. Hochst B, Schildberg FA, Bottcher J, Metzger C, Huss S, Turler A, et al. Liver sinusoidal endothelial cells contribute to CD8 T cell tolerance toward circulating carcinoembryonic antigen in mice. Hepatology 2012;56:1924-1933. 49. Nagato T, Lee YR, Harabuchi Y, Celis E. Combinatorial immunotherapy of polyinosinic-polycytidylic acid and blockade of programmed death-ligand 1 induce effective CD8 T-cell responses against established tumors. Clin Cancer Res 2014;20:1223-1234. 50. Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med 2020;382:1894-905. 51. Nagy A, Lanczky A, Menyhart O, Gyorffy B. Validation of miRNA prognostic power in hepatocellular carcinoma using expression data of independent datasets. Sci Rep 2018;8:9227.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |