[题目]一定温度下.H2(g)与I2(g)反应生成HI(g).反应的能量变化如下图所示.下列说法不正确的是A.H2(g)+I2 ΔH= |
您所在的位置:网站首页 › h2和i2反应生成2hi2的熵变化 › [题目]一定温度下.H2(g)与I2(g)反应生成HI(g).反应的能量变化如下图所示.下列说法不正确的是A.H2(g)+I2 ΔH= |
[题目]一定温度下.H2(g)与I2(g)反应生成HI(g).反应的能量变化如下图所示.下列说法不正确的是A.H2(g)+I2 ΔH=
|
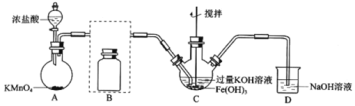
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。 资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。 制备K2FeO4(夹持装置略)
(1)A为氯气发生装置,A中反应离子方程式是:___。 (2)将除杂装置B补充完整并标明所用试剂。___。 (3)C中得到紫色固体和溶液。C中Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,另外还有:___。 (4)已知Cl2与KOH在较高温度下反应生成KClO3。为了保证生产KClO,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是:___、__。 探究K2FeO4的性质 (5)高铁酸钾常用于工业废水与城市生活污水的处理,可用作高效水处理剂,表现在水中与污染物作用的过程中,经过一系列反应,由六价降至三价后,能对水产生净化作用的原因是(结合离子方程式回答):____。 (6)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案: 方案I 取少量a,滴加KSCN溶液至过量,溶液呈红色 方案II 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 i.由方案I中溶液变红可知a中含有__离子,但该离子的产生不能判断一定K2FeO4将Cl-氧化,还可能由___产生(用离子方程式表示)。 ii.方案II可证明K2FeO4氧化了Cl-。 (7)用KOH溶液洗涤的目的是___。 (8)根据K2FeO4的制备实验得出:氧化性Cl2__FeO42-(填“>”或“<”),而方案II实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是___。 (9)资料表明,酸性溶液中的氧化性FeO42->MnO42-,验证实验如下: 将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO42-,若能,请说明理由;若不能,进一步设计实验方案,理由或方案:__。 |
【本文地址】