【学术前沿】专家点评Nature |
您所在的位置:网站首页 › g蛋白的生物学功能是什么 › 【学术前沿】专家点评Nature |
【学术前沿】专家点评Nature
|
点评 | 孙金鹏(山东大学)、 Patrick Sexton/Denise Wootten/Arthur Christopoulos(Monash University)、 Ralf Jockers(INSERM) G蛋白偶联受体(GPCR)是人体内最大的膜受体蛋白家族,其在细胞信号传导中发挥重要功能,同时也与人体疾病密切相关,是40%以上的上市药物的作用靶点【1】。根据结构和序列的差异性,人体中GPCR可分为A、B、C和F四种类型。近年来的结构功能研究分别揭示了A、B1、B2和F类以单体形式发挥功能的GPCR的激活机制【2-5】。研究显示单体GPCR偶联G蛋白采用相似的模式,即受体的激活使跨膜结构域TM6的外移,进而形成较大的口袋用于结合Gα亚基的C末端,从而激活G蛋白下游信号通路。然而长期以来,以二聚体形式发挥功能的C类GPCR偶联G蛋白的分子机制一直未能揭示,严重阻碍了人们对C类GPCR信号转导机制的理解。 2021年4月28日,华中科技大学生命科学与技术学院、分子生物物理教育部重点实验室刘剑峰教授团队联合浙江大学医学院、良渚实验室张岩研究员团队在Nature杂志在线发表了题为“Structural basis of GABAB receptor-Gi protein coupling”的研究论文。本研究突破性地鉴定了异源二聚体GABAB受体与G蛋白复合物的高分辨率冷冻电镜结构,首次揭示了二聚体GPCR非对称激活G蛋白的独特模式。  C类GPCR主要包括代谢型γ-氨基丁酸受体(GABAB)、代谢型谷氨酸受体(mGlu)、钙敏感受体(CaSR)和味觉受体1(Taste 1)等【6】。C类受体与众多神经和精神疾病相关,包括癫痫、疼痛、焦虑、抑郁、精神分裂症、药物成瘾、Rett综合征和癫痫性脑病等。GABAB受体是第一个被发现和证明的GPCR异源二聚体,是C类GPCR二聚体的典型代表【7,8】。GABAB受体广泛表达在中枢神经系统中,参与学习、记忆和突触信号传递等重要的生理进程【9】。GABAB受体由GB1和GB2两个亚基组成,每个亚基分别由胞外结构域(VFT),七次跨膜域(TMD)和胞内域构成【10】。GABAB受体激活采取典型的非对称性调节机制,即GB1的VFT负责配体识别,而GB2的TMD偶联Gi/o蛋白调控下游信号。 刘剑峰/张岩合作团队在2020年国际首次鉴定全长GABAB受体非激活态与激活态的精细三维空间结构(详见BioArt报道:张岩/刘剑峰合作解析代谢型γ-氨基丁酸受体激活机制的结构基础),阐明了GABAB受体激活时的构象转变过程,鉴定了正向变构调节剂的结合口袋,极大地促进了GABAB受体的激活机制研究和靶向药物开发。同时,该工作还首次解析了低分辨的GABAB-Gi复合物结构,发现由于潜在的空间位阻,二聚化的GABAB受体仅能偶联一个G蛋白【11】。然而其非对称激活和偶联G蛋白的信号转导的分子机制还未被揭示。 该研究团队在前期工作的基础上再次进行课题攻关,先后突破复合物组装、均一冷冻样品制备、动态构象数据处理等挑战,最终完成高分辨GABAB受体-Gi蛋白复合物的电镜结构鉴定(图1a)。结构分析发现与单体GPCR不同,GABAB受体偶联G蛋白时,两个亚基跨膜域的TM6均没有发生外移,但是GB2亚基的TM3和TM5却发现较小幅度的外扩,使三个胞内环形成一个较浅的口袋结合G蛋白。与其他单体GPCR和G蛋白结合的结构相比,G蛋白α5螺旋插入GABAB受体的深度低了~10Å,并且主要与胞内环互作。这些结果结合大量的功能试验验证,以及之前其他C类GPCR功能研究,推测C类GPCR二聚体都采用了这种不同于A、B1、B2和F类GPCP的激活的独特的G蛋白偶联模式(图1b-d)。 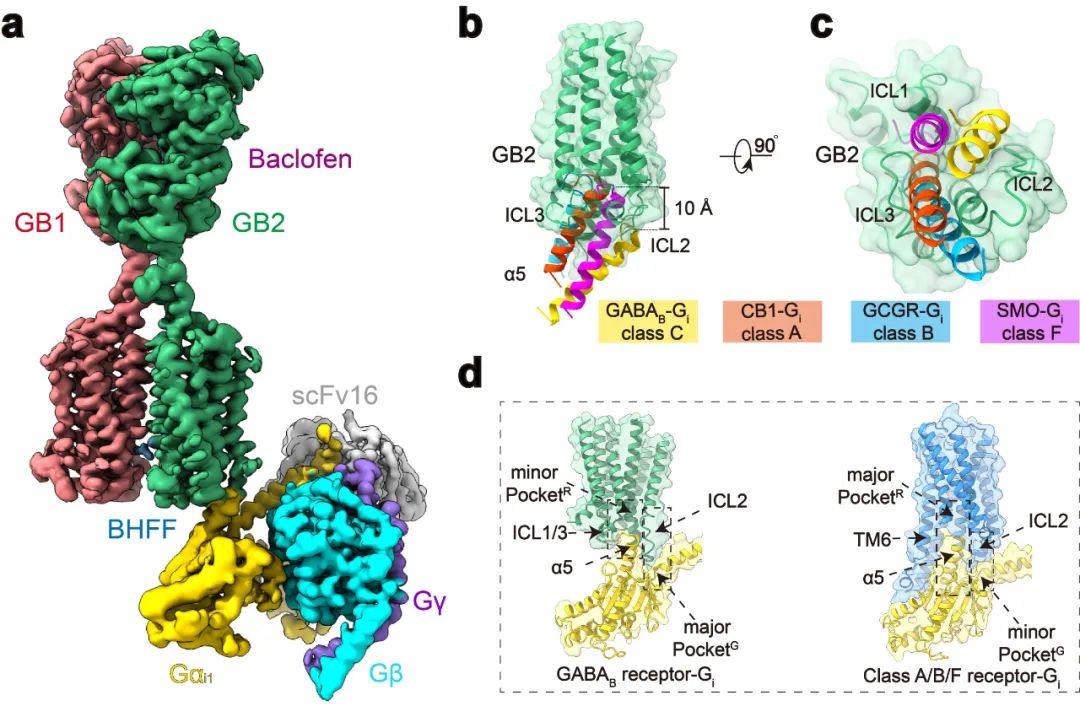 图1:GABAB偶联G蛋白复合物的新颖结构 此外,研究发现了GABAB偶联G蛋白后的精细构象变化,包括GB1和GB2之间的旋转,以及GB2亚基TMD的细节变化。通过结构分析,研究人员发现结合激动剂的GABAB受体偶联G蛋白后,其GB2-TMD相较于GB1-TMD产生进一步的逆时针旋转,使得GB1和GB2的跨膜域界面进一步靠近,稳定激活状态。研究人员专注于GB2-TMD的内部精细的构象变化,分析发现GB2 TM3/TM5胞内端的构象变化是起始于TM3上F586侧链苯环的大角度旋转。功能实验分析发现,将F586突变成小侧链丙氨酸后,受体偶联G蛋白的能力显著下降。此外,在GB2-TMD的底部,多个带电荷的氨基酸形成的盐桥进一步稳定了受体的激活态,从而揭示了GB2亚基结合G蛋白的结构基础(图2)。GB2亚基这些独特的构象的变化,最终决定了GABAB偶联G蛋白的非对称性激活模式。 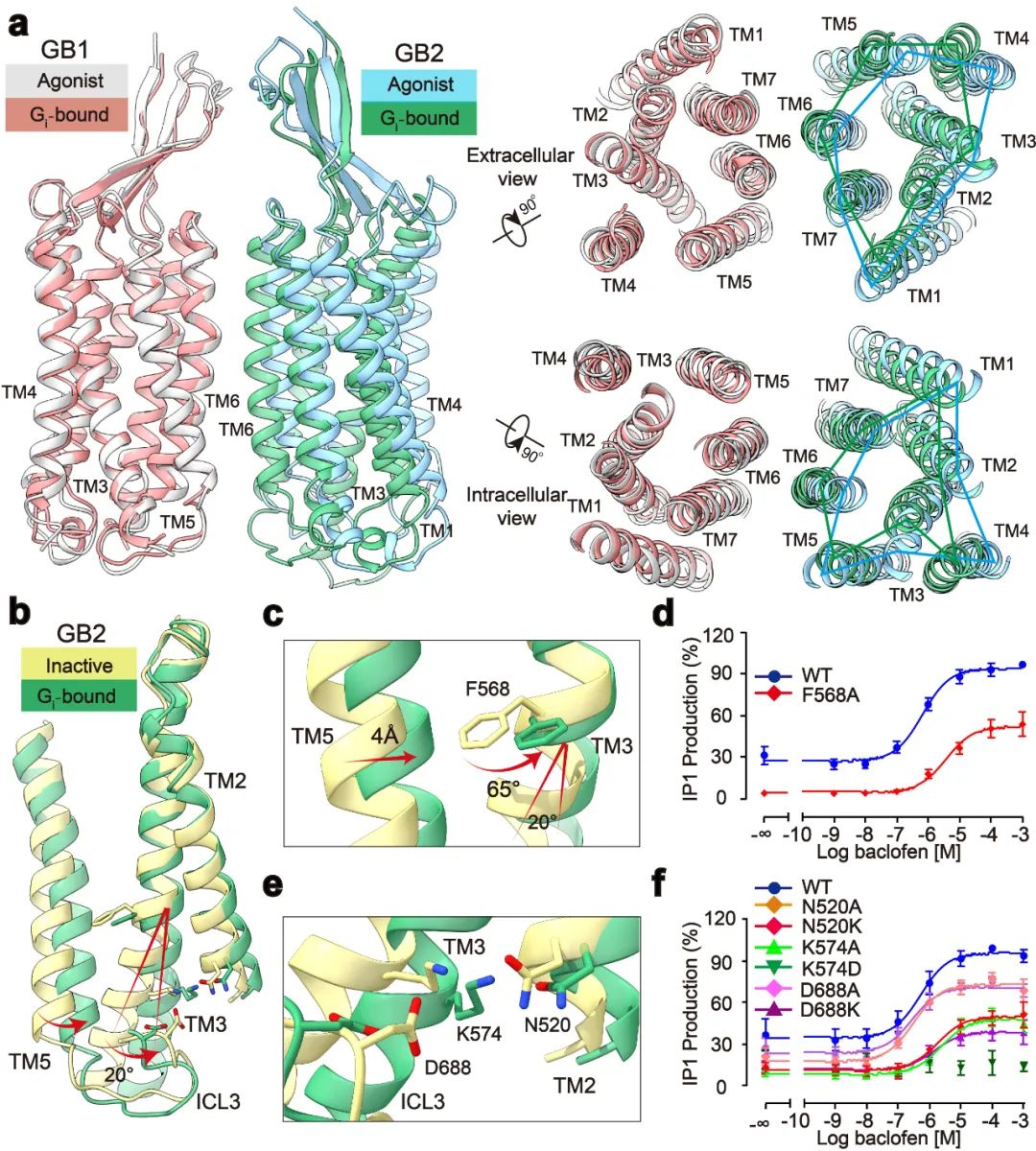 图2:GABAB受体采取非对称性变化的激活机制 GABAB受体主要通过3个胞内环(ICL)偶联Gi蛋白:其中较长的ICL2主要与G蛋白上α5,αN,β2-β3的结合,占据了约80%的互作界面;而较短的ICL1、ICL3主要与G蛋白的α5末端几个氨基酸相互作用,稳定了G蛋白的结合(图3a,b)。此外研究发现GABAB受体选择性识别Gi/o亚型G蛋白是由于Gi/o的H5.23位点是小侧链的半胱氨酸,而Gs、Gq等类型G蛋白的相应位置大侧链的酪氨酸与GABAB受体具有潜在的空间位阻(图3c)。功能实验分析发现,当把H5.23位点的半胱氨酸突变成大侧链的色氨酸后,其偶联G蛋白的能力显著降低,而当突变成小侧链的丙氨酸后,其结合G蛋白的能力没有变化(图3d,e)。 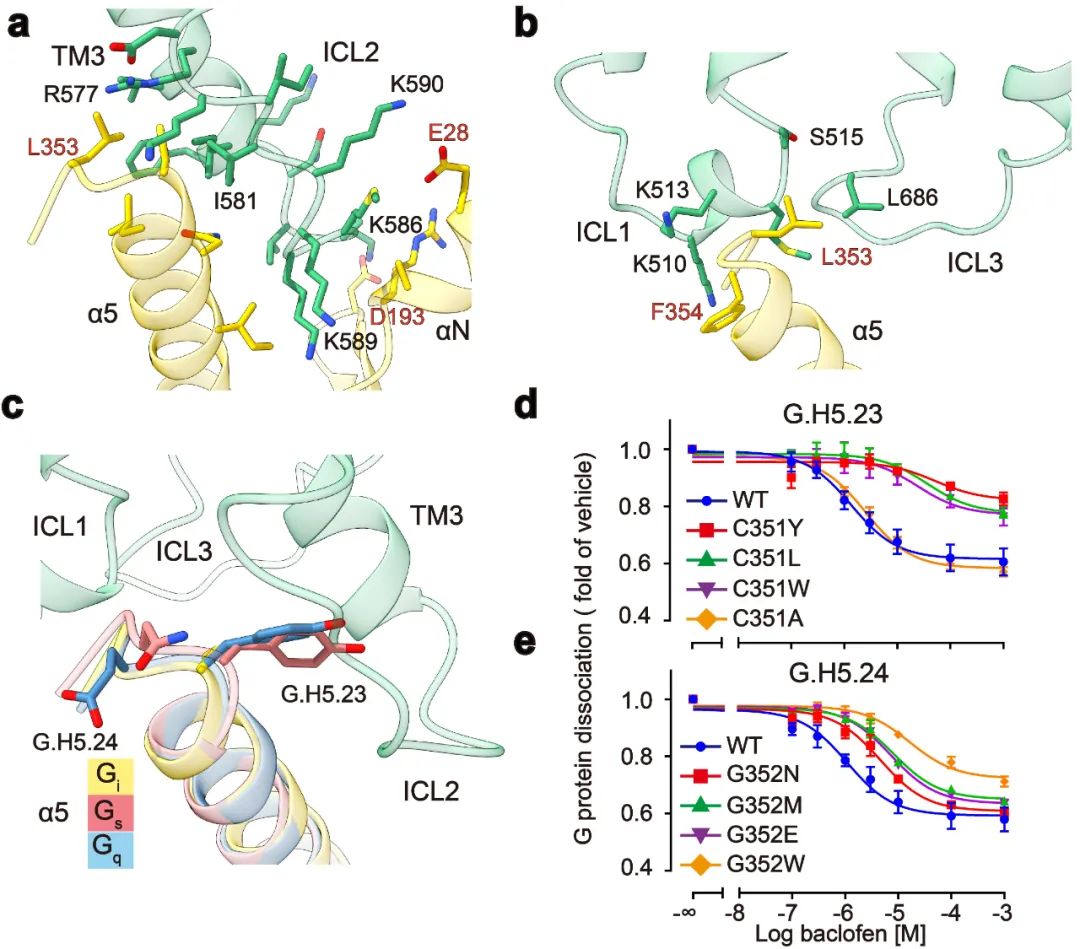 图3:GABAB受体选择性偶联Gi蛋白的分子机制 该项工作完整地阐述了C类异源二聚体GABAB受体的非对称激活机制:在非激活状态下,GABAB受体两个亚基的VFT区都处于开放状态,TMD区采用TM3-TM5/TM3-TM5互作界面;激动剂结合GB1-VFT正位口袋后,诱导GB1-VFT闭合,从而使得GB2-VFT旋转,进一步由颈区传导至TMD的重排,形成新的TM6/TM6作用界面;PAM以及G蛋白的结合,进一步诱导了GB2的TMD的旋转,形成更稳定的TM6/TM6互作界面;此外GB2亚基F568等残基精细的构象变化,导致其TM3/TM5的胞内端外移,三个胞内环形成较浅的口袋选择性偶联Gi/o蛋白,最终激活下游信号通路(图4)。 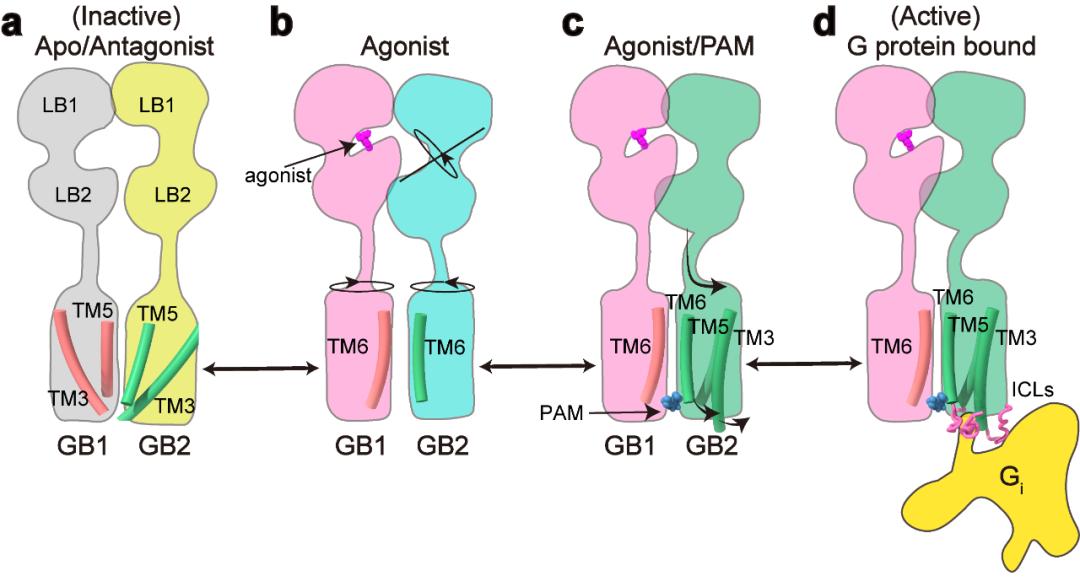 图4:GABAB受体激活的信号转导模型 该研究是浙江大学—华中科技大学细胞信号转导联合实验室在C类GPCR信号转导机制研究中的又一重大突破。该工作也进一步验证了刘剑峰课题组之前发现的C类GPCR二聚体,如代谢型谷氨酸受体(Nat Chem Biol.,2015; PNAS.,2011; J Biol Chem., 2006),GABAB受体(Cell Res.,2020; NatCommun.,2019;EMBO J.,2008)和钙敏感受体(PNAS.,2020)中不同亚基的各个功能域变构调节的激活模式。华中科技大学与浙江大学医学院联合培养博士生申仓松、浙江大学医学院附属邵逸夫医院毛春友研究员、华中科技大学教师许婵娟和博士生晋楠为本研究第一作者。华中科技大学生命科学与技术学院刘剑峰教授,浙江大学医学院张岩研究员和法国功能基因研究所PIN JP教授为共同通讯作者。浙江大学医学院蛋白质平台、冷冻电镜中心为本次研究的样品制备和数据收集提供了支持。该工作也得到了浙江中医药大学陈忠教授,浙江大学侯廷军教授和法国功能基因研究所Rondard P教授的协助。 专家点评 孙金鹏(山东大学) G蛋白偶联受体(GPCR)是目前已知的人类基因组中最大的膜受体家族,分为5个家族。最近中国科学家刘剑峰教授和张岩教授连续在Class C家族的结构生物学中取得重大突破,是非常另人欣喜振奋的事情。在新发表的这篇Nature文章中,刘剑峰教授和张岩教授延续了他们前期的重要工作,聚焦于代谢型γ-氨基丁酸B型受体(GABABR),一种C类GPCR。相对于其他家族的GPCR受体,C类GPCR具有更复杂的空间结构,而且存在着自发性的专一性的二聚化。在人体内,该家族受体参与非常重要的生理进程,如学习和记忆的产生、突触信号的传递等,是非常重要的药物作用靶点。华中科技大学生命学院刘剑峰教授是国际上C型GPCR受体研究的顶尖科学家,此前已经在C类GPCR的结构变化和信号传导机制上开展了一系列的全面研究,尤其关注结构复杂的GPCR二聚体和多聚体的结构动态构象变化,其十余年的工作用生物物理方法和生化手段系统揭示了C型GPCR激活过程的构象重排,包括但不限于(EMBO J 2008, PNAS 2011, Nat Chem Biol 2015, elife, 2017,Nat Commun.,2019)上面发表的系列文章等,从功能和结构上全面阐释了C类GPCR二聚体激活的独特模式。 本文解析了异源二聚体GABAB受体与G蛋白复合物的高分辨率冷冻电镜结构,首次阐明二聚体GPCR非对称激活G蛋白的独特模式。该研究独创性地发现,不同于传统单体GPCR偶联G蛋白时采用的跨膜结构域TM6的外移, GABAB受体结合Gα蛋白的口袋主要由GB2亚基的TM3和TM5较小幅度的外扩形成,形成了独特的G蛋白偶联机制。该研究还突破性地阐述了C类异源二聚体GABAB受体的非对称激活机制,是一项里程碑式的工作。更值得指出的是,这一新结构也说明GPCR激活是一个非常复杂的动态过程。在领域里有一段时间已经认GPCR仅通过TM3-TM6的分离来决定G蛋白选择性。近期解析的结构以及剑峰和张岩的这个新工作都说明这种静态认识较为粗浅。所以相信随着更多GPCR结构被解析,肯定可以发现GPCR与G蛋白结合的动态性和多样性是受体与G蛋白偶联的特性之一。 刘剑峰教授领导的团队从事Class C类CPCR的相关工作近20年,已经取得了系统性的成果,在国际上很有影响。新的这篇杰出工作与现在国内GPCR研究团队之间的团结合作密不可分。张岩教授在国外工作期间便与Robert J. Lefkowitz、Brian K. Kobilka等国际顶尖的GPCR研究团队展开合作,首次突破性地使用冷冻电镜技术解析GPCR信号转导复合物的高分辨率结构,其开创性的研究成果被《自然》杂志评为为结构生物学领域的里程碑工作。剑峰教授和张岩教授前期解析的另一篇Cell Research文章首次报道了人源全长异源二聚体GABAB受体的高分辨率结构和激活机制,为靶向GABAB受体的药物研发奠定了重要基础(Cell Research,2020),处于国际领先水平,是非常漂亮的C型GPCR受体的经典工作。国内目前这种多团队联合开展工作的方式,极大推动了国内GPCR领域的发展,使得中国GPCR领域的研究不断居于国际前沿。希望国内的GPCR研究团队可以继续通力合作,再攀新的高峰。 专家点评 Patrick Sexton、Denise Wootten、Arthur Christopoulos(Monash University ) G蛋白偶联受体(G protein-coupled receptors, GPCR)是最丰富的膜蛋白超家族。随着冷冻电镜技术的发展,使人们对GPCR的激活及其与胞内主要转导分子家族(G蛋白三聚体,控制细胞内信号转导)的相互作用有了新的认识。然而,目前的研究主要局限于A类、B类或F类单体形式GPCR家族,它们发挥功能是通过受体激活与结合G蛋白时打开细胞内腔的口袋。然而A类和B类GPCR亚家族成员可能形成瞬态二聚体,但是这些寡聚激活状态结构尚未被观察到。相比之下,结合小分子配体(如钙、谷氨酸或本文所研究的GABA)的C类GPCRs,是组成性的同源或异源二聚体。最近冷冻电镜技术的研究结果对这个家族激活状态和非激活状态下的结构提供了深入的了解。然而,支撑于理解C类GPCR激活G蛋白复合物的高分辨率结构一直难以被解析。 在目前的研究中,申和他的同事已经突破了这一主要技术障碍,成功获得了激活状态GABAB受体偶联Gi1蛋白的复合物,这为了解C类GPCR激活G蛋白的机制提供了突破性的见解。该研究揭示的主要成果包括确认了GABAB受体激活的不对称机制,与之前的推测吻合,GABAB异源二聚体主要由GB2亚基结合一个G蛋白。G蛋白的α5螺旋包含所有GPCR-G蛋白复合物的关键相互作用域,并在G蛋白结合的选择性中发挥主要作用。单体GPCR结合G蛋白是通过TM6的外扩形成与G蛋白的α5螺旋插入的口袋,然而,与其它单体GPCR结合G蛋白的构象变化不同,GABAB结合G蛋白并没有发生TM6向外运动,因此没有形成与G蛋白的α5螺旋结合的口袋。相反,GABAB偶联G蛋白发生最大的构象变化是在TM3和TM5中,并相应使对CL2和ICL3构象发生改变。此外,G蛋白的α5螺旋结合GB2亚基的外表面,而不是跨膜区内部,主要与ICL2相互作用, ICL3和ICL1也参与了较少的相互作用。有趣的是,将不同GPCR结合的Gi蛋白进行对比,尽管与GPCR相互作用的方式不同,但是激活状态的Gi整体构象都非常相似,唯一的差异是αN螺旋的位置在GABAB中比较独特。或许当前研究中最重要的观察结果是GB1和GB2亚基之间缺乏实质性的构象不对称性。与此一致的是,该研究观察到一小部分G蛋白可以与GB1亚基结合,尽管其相关生理现象尚不清楚。G蛋白在结合模式上具有较大的灵活性,这与GABAB-G蛋白相互作用比其他GPCR-Gi蛋白复合物界面小是一致的。然而,总的来说,受体对G蛋白的2:1化学计量可能受到同一复合物中多个G蛋白之间的空间位阻的影响。 这项研究为我们理解C类GPCR激活G蛋白提供了一个重大进展,而且随着越来越多的GPCR-G蛋白复合物结构被解析,这有助于人们扩大受体对G蛋白相互作用不同模式的理解。这些研究表明,关于以前GPCR和G蛋白构象的假设,特别是关于Gs蛋白结合的模型并不完全成立。该工作表明,G蛋白也可以通过新的模式与GPCRs结合发挥功能。总之,越来越清楚的是,对G蛋白结合、活化的选择性和动力学的理解需要不断发展,以阐明高分辨率结构测定的结果。 以下为点评原文: G protein-coupled receptors are the most abundant superfamily of membrane proteins. Breakthroughs in cryo-electron microscopy have enabled novel structural insight into the activation of GPCRs and interaction with their major family of intracellular transducers, the heterotrimeric G proteins that enables control of intracellular signalling. However, to date, this understanding has been primarily limited to monomeric forms of GPCRs from class A class B or class F GPCR subfamilies that engage with G proteins through opening of an intracellular cavity upon receptor activation and G protein binding. While members of the class A and class B GPCR subfamilies may form transient dimers, these oligomeric states have not been observed in active structures solved to date. In contrast, class C GPCRs that bind small ligands such as calcium, glutamate or in the case of the current study, GABA, are obligate homo- or heterodimers. Recent cryo-EM studies have provided insight into inactive and active state structures of this subfamily, however, structures of activated class C receptors in complex with transducer G proteins have been refractory to structure determination at resolutions that could support understanding of G protein activation. In the current study, Shen and colleagues have overcome this major technical hurdle to determine an activated GABAB receptor complex with Gi1 protein. This provides substantial new insight into the mechanism of class C GPCR activation of G proteins. Key features revealed by the study include confirmation of the asymmetric mechanism of G protein activation with only a single G protein bound to the complex, principally bound to the B2 subunit as predicted. However, in contrast to the conformation changes seen in other receptor families that enable G protein binding, there is no outward movement of TM6 and consequently no equivalent cavity created for binding of the α5 helix of the G protein that comprises a key interaction domain for all GPCR-G protein complexes and plays a major role in selectivity of G protein binding. Instead, the largest conformational changes are in TM3 and TM5 with propagated alterations to the conformations of ICL2 and ICL3. Moreover, rather than binding to an internal cavity within the transmembrane bundle the a5 helix bound to the external face of the B2 subunit, interacting principally with ICL2, and only limited additional interaction with ICL3 and ICL1. Intriguingly, alignment of Gi proteins bound to GPCRs revealed that the overall conformation of Gi in this state was very similar regardless of the site of GPCR interaction, with the largest difference observed for the position of the aN helix that was most distinct for the GABAB receptor. Perhaps the most important observation in the current study was the lack of substantial conformational asymmetry between the B1 and B2 subunits. Consistent with this, a small subset of particles was observed where the G protein was bound to the B1 subunit, although the physiological relevance of this is less clear. The G protein also displayed substantial conformational flexibility in the mode of engagement, which is also consistent with the more limited interaction interface relative to other GPCR-Gi protein complexes. However, overall, it is likely that the 2:1 stoichiometry of receptor to G protein is influenced by steric hindrance that would occur between multiple G proteins in the same complex. This work provides a major advance in our understanding of G protein activation by class C GPCRs and contributes to our expanding understanding of the diverse modes of G protein interaction that have been revealed as more and more GPCR-G protein complexes are solved. Such studies have shown that previous assumptions on both GPCR and G protein conformations, particularly for Gs binding, do not hold true. The current work establishes that G proteins can also functionally engage with GPCRs through an extrahelical mode of interaction. It is increasingly clear that understanding of the selectivity and dynamics of G protein binding and activation will need to continually evolve to accommodate the revelations from high-resolution structure determination. 专家点评 Ralf Jockers(INSERM,法国国家科学研究中心GPCR研究群体负责人) 申等人在最新一期的《自然》杂志上的一篇报道的关于代谢型GABAB受体功能的结构基础的工作是令人振奋的新发现。GABAB受体是G蛋白偶联受体超家族的C类成员,也是中枢神经系统中主要的抑制性神经递质γ-氨基丁酸(GABA)的代谢型受体。 申等人的发现在多方面都具有独特性。最引人注目的可能是GABAB受体与其信号转导物Gi三聚体蛋白的偶联模式。这与所有其它GPCR都不同,作用界面在受体胞内区域形成一个浅腔,而不是在受体核心内部形成一个较深的口袋。为什么GABAB受体如此独特?最有可能是由于其二聚体性质,因为它是第一个强制性异源二聚体,可提供多种水平的变构开关,从而导致非对称激活模式。 GABAB受体的独特性是否可以成为其他二聚GPCR的模板,仍有待进一步研究。不管结果如何,申等人的启发性工作将可以触发有关GPCR的新研究方向,并帮助我们了解了这些重要药物靶标的功能。 以下为点评原文: Shen et al. report in the latest issue of “Nature”, exciting new findings on the structural basis of the metabotropic GABAB receptor function, a class C member of the G protein-coupled receptor superfamily that responds to γ-amino butyric acid (GABA), a major inhibitory neurotransmitter in the central nervous system. The findings of Shen et al. are unique in several aspects. Maybe the most striking observation is the coupling mode of the GABAB receptor to its signal transducer, the heterotrimeric Gi protein, which is different from all the other GPCRs and involves a shallow cavity at the intracellular receptor surface instead of a deep pocket inside the receptor core. Why is the GABAB receptor so unique? Most likely because of its dimeric nature as the first obligatory heterodimer which offers multiple levels of allosteric switches resulting in an asymmetric activation mode. Whether the GABAB receptor is really unique or whether it is a template for other dimeric GPCRs remains to be seen in future studies. Whatever the outcome, the inspiring work of Shen et al. for sure will trigger new research directions on GPCRs and help us to understand the function of these important drug targets. 原文链接: https://doi.org/10.1038/s41586-021-03507-1 原文链接: https://doi.org/10.1038/s41586-021-03507-1 向上滑动阅览参考文献 1.Hauser, A. S., Attwood, M. M.,Rask-Andersen, M., Schiöth, H. B. & Gloriam, D. E. Trends in GPCR drugdiscovery: new agents, targets and indications. Nature reviews. Drug discovery 16,829-842, doi:10.1038/nrd.2017.178 (2017). 2.Rasmussen,S. G. et al. Crystal structure of theβ2 adrenergic receptor-Gs protein complex. Nature477, 549-555,doi:10.1038/nature10361 (2011). 3.Zhang,Y. et al. Cryo-EM structure of theactivated GLP-1 receptor in complex with a G protein. Nature 546, 248-253, doi:10.1038/nature22394(2017). 4.Ping,Y. Q. et al. Structures of theglucocorticoid-bound adhesion receptor GPR97-G(o) complex. Nature 589, 620-626,doi:10.1038/s41586-020-03083-w (2021). 5.Qi,X. et al. Cryo-EM structure ofoxysterol-bound human Smoothened coupled to a heterotrimeric G(i). Nature 571, 279-283, doi:10.1038/s41586-019-1286-0 (2019). 6.Pin,J. P. & Bettler, B. Organization and functions of mGlu and GABA(B) receptorcomplexes. Nature 540, 60-68, doi:10.1038/nature20566(2016). 7.Kaupmann,K. et al. GABA(B)-receptor subtypesassemble into functional heteromeric complexes. Nature 396, 683-687,doi:10.1038/25360 (1998). 8.White,J. H. et al. Heterodimerization isrequired for the formation of a functional GABA(B) receptor. Nature 396, 679-682, doi:10.1038/25354 (1998). 9.Vlachou,S. & Markou, A. GABAB receptors in reward processes. Advances in pharmacology (San Diego, Calif.) 58, 315-371, doi:10.1016/s1054-3589(10)58013-x (2010). 10.Bettler,B., Kaupmann, K., Mosbacher, J. & Gassmann, M. Molecular structure andphysiological functions of GABA(B) receptors. Physiological reviews 84,835-867, doi:10.1152/physrev.00036.2003 (2004). 11.Mao,C. et al. Cryo-EM structures ofinactive and active GABA(B) receptor. Cellresearch 30, 564-573,doi:10.1038/s41422-020-0350-5 (2020). 来源:BioArt 原标题:《【学术前沿】专家点评Nature | 刘剑峰/张岩合作揭示GPCR二聚体偶联G蛋白的新模式》 阅读原文 |
【本文地址】
今日新闻 |
推荐新闻 |