合成生物学会给发酵工业带来深刻变革,甚至带来新一轮产业革命|专访天科大教授于爱群 |
您所在的位置:网站首页 › ggpps › 合成生物学会给发酵工业带来深刻变革,甚至带来新一轮产业革命|专访天科大教授于爱群 |
合成生物学会给发酵工业带来深刻变革,甚至带来新一轮产业革命|专访天科大教授于爱群
|
为萜类化合物的一种,是由二分子异戊二烯聚合而成的烯烃类化合物,及其含氧的和饱和程度不等的衍生物。 单萜化合物分为直链型、单环型、双环型以及三环型,广泛分布于高等植物的腺体、油室和树脂道等分泌组织中。单萜含氧衍生物(如醇类、醛类、酮类)具有较强的香气和生物活性,是食品、饮料、医药、化妆品工业的重要原料。 一般来说,传统获取单萜化合物的方法有两种:从天然植物中进行提取、分离和化学合成方法。 但植物生长周期缓慢、资源稀缺,而且植物体内单萜化合物的含量较低,提取和分离工艺要求较高,难以大量获得,所以难以满足日益增长的消费和工业需求;化学合成的方法也存在着严重依赖化石燃料、能源消耗大、合成反应效率低,以及产生大量有机废物容易造成环境污染等缺点。 因此,开发用来生产单萜化合物的可再生微生物资源(来补充甚至代替原有稀少珍贵的植物资源),以及单萜类化合物的低成本高效率、可持续和生态友好的替代生产路线的需求亟待解决。 近年来,随着合成生物学的发展,代谢工程等相关技术取得了一系列突破性进展,通过对微生物细胞进行特定改造并利用细胞工厂异源合成单萜化合物,将有望成为替代植物提取和化学合成的一种更好的策略。 这种借助微生物细胞工厂进行生物合成的方法具有成本投入少、环境污染小、量产规模可控等诸多优点,是建设节约型社会、实现可持续发展的绿色生产方式。不论从生态环保、投产比,亦或是产业规模来看,这种生物合成单萜化合物的方法均具有很大优势。
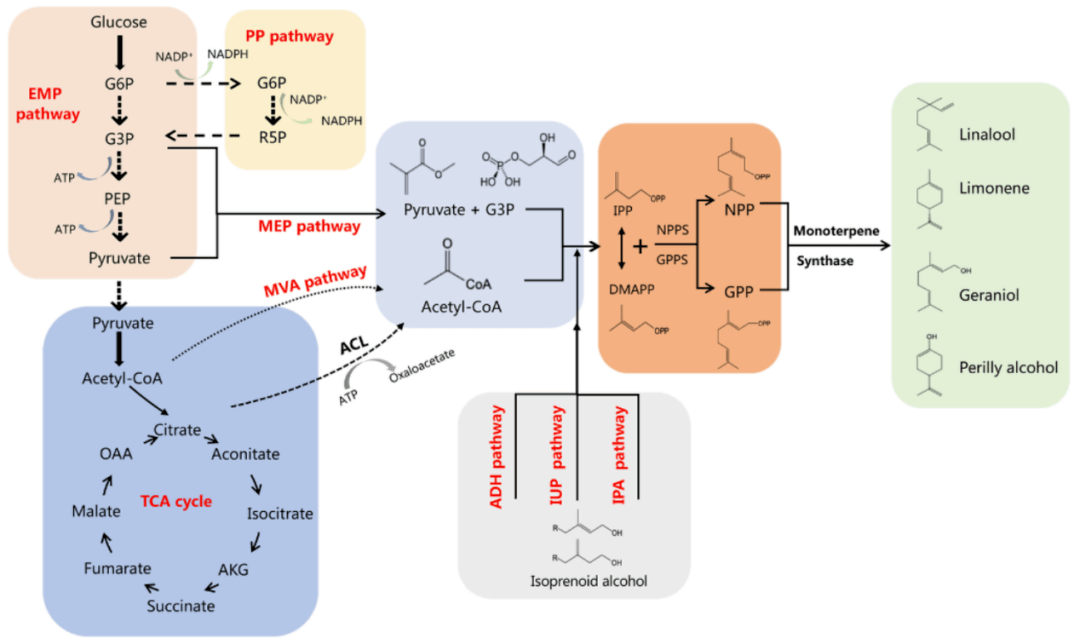
图|单萜化合物的一般生物合成途径。如图所示,在微生物底盘细胞中,单萜化合物的生物合成途径可分为三个模块:① 由自然界中两种代谢路径 —— 甲基赤藓醇磷酸(MEP)途径和甲羟戊酸(MVA)途径,合成单萜化合物的共同前体物 —— 异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP);② 在关键酶香叶基二磷酸合酶(GPPS)的催化下,1 分子 IPP 和 1 分子 DMAPP 合成直接前体香叶基焦磷酸(GPP);③ GPP 作为直接前体被各种单萜合成酶(MTS)转化为单萜化合物。[1] 解脂耶氏酵母 —— 高效的合成利器 所谓 “工欲善其事必先利其器”,选对 “器具” 很关键。如上文所述,采用合成生物学的方法生产单萜化合物很有潜力,具体采用哪种微生物细胞进行合成呢?这里经常使用的是一种名为解脂耶氏酵母的细胞。 解脂耶氏酵母( Yarrowia lipolytica ): 于 1942 年首次被分离得到,为非常规酵母中具代表性的一种,同时也是一种公认安全的微生物。 解脂耶氏酵母有广泛的底物谱,能利用有机酸(如柠檬酸、异柠檬酸等)、烷烃类廉价物质等作为底物来生产单萜 / 萜类化合物、生物燃料等多种高附加值产物。 自上世纪 40 年代被成功分离以来,解脂耶氏酵母便受到广大研究者的重视。因其能够安全地用于食品和药物生产、具有较好的脂类合成能力、碳源谱广泛等优点,解脂耶氏酵母常被用作宿主菌来生产各种有用的化合物。目前,解脂耶氏酵母仍然是非常规酵母中使用最为广泛的底盘细胞之一。 对此,于爱群表示,解脂耶氏酵母是异源合成单萜化合物理想的微生物底盘细胞,近年来利用代谢工程及合成生物学技术在解脂耶氏酵母底盘细胞中重构与优化单萜化合物的合成途径来实现目标代谢产物的高效合成,已经成为一项新的研究热点。
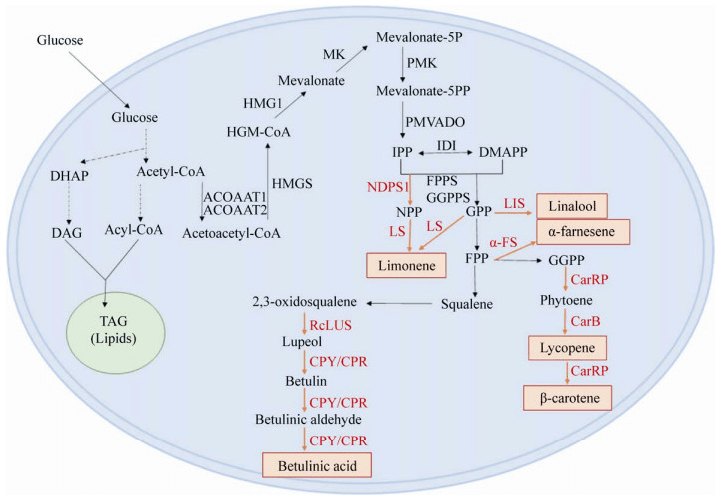
图|解脂耶氏酵母异源合成单萜及其他萜类化合物的代谢途径[2]。如图所示,解脂耶氏酵母自身具有甲羟戊酸(MVA)途径,可将胞内的乙酰辅酶 A 转化生成异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)。IPP 和 DMAPP 又在法尼基焦磷酸合酶(FPPS)/ 香叶基香叶基焦磷酸合酶(GGPPS)作用下缩合成了香叶基焦磷酸(GPP)、法尼基焦磷酸(FPP)和香叶基香叶基焦磷酸(GGPP)。解脂耶氏酵母细胞内源产生的 GPP、FPP 和 GGPP 便是各种萜类化合物生物合成的重要前体物质。[2] 与常规酵母(如酿酒酵母)相比,解脂耶氏酵母具有一系列优势,可总结为以下五点: ① 自身具有将多种廉价生物质原料快速转化为各种高附加值化学品如柠檬酸、琥珀酸的代谢能力,生产基于脂质的油性化学品的能力也较强; ② 对油脂类物质具有较强的降解能力,因此可用于对废油污染的生物修复; ③ 具有更高效分泌蛋白质和有机酸(如 α- 酮戊二酸和琥珀酸)的能力; ④ 对生长条件的要求更低,在各种碳源、pH 和盐度条件下均可生长; ⑤ 不受葡萄糖效应的影响,因此不会进行有氧酒精发酵。[2] 与大肠杆菌相比,解脂耶氏酵母具有完整的内膜系统和与植物相类似的蛋白质翻译后修饰系统,更适合植物源蛋白质的表达。此外,解脂耶氏酵母属于典型的产油酵母,细胞内脂肪酸(Fatty Acid)、脂酰辅酶 A(Fatty Acyl-CoA)以及乙酰辅酶 A(Acetyl-CoA)的积累量较高,因此,在生产单萜化合物方面具有明显优势。 当下,随着解脂耶氏酵母全基因组序列的公布以及基因表达载体、遗传转化方法、合成生物学元件和基因编辑技术的快速发展,解脂耶氏酵母已经成为目前代谢工程及合成生物学研究中备受关注且极具潜力的底盘细胞之一。
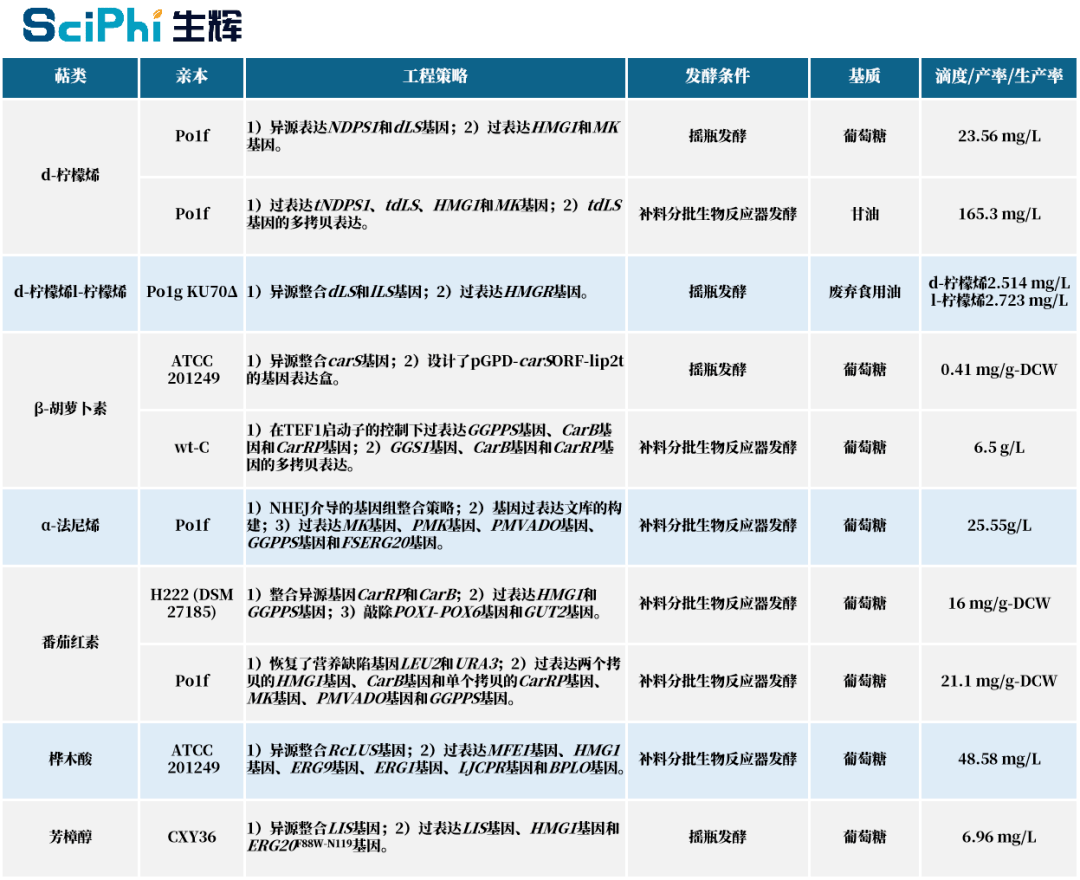
图|在解脂耶氏酵母中异源生产单萜及萜类化合物示例[2]。如图所示,近年来,研究人员借助代谢工程以及相关合成生物学技术,实现了多种单萜及萜类化合物合成途径在解脂耶氏酵母底盘细胞中的重构与优化。例如,外源引入的橙花基焦磷酸合酶(NDPS1)可催化异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)转化生成橙花基焦磷酸(NPP),NPP 作为植物源柠檬烯合酶(LS)的底物进一步转化为单萜化合物 —— 柠檬烯。[2](生辉整理) 然而,解脂耶氏酵母也并非十全十美。对此,于爱群指出,由于对解脂耶氏酵母的研究及应用起步较晚,因此目前尚未完全掌握该底盘细胞内的基因表达调控等分子机制,而且遗传操作系统也有待进一步完善。另外,该酵母固有的一些特性也在一定程度上限制了单萜化合物的产量,距离大规模工业化生产还有很长的路要走。 接下来,需要不断地对其中的核心机制和关键技术进行创新性的探索和研究。未来需要重点突破的四个方面如下: ① 解脂耶氏酵母本身不含有可自主复制的游离质粒,因此在对其进行基因编辑时需要首先构建人工合成质粒作为过渡载体,较为费时费力; ② 解脂耶氏酵母胞内的非同源重组效率极高,从而导致基因定点敲除和敲入都非常困难。虽然 CRISPR-Cas9 介导的基因整合技术能将酵母同源重组的成功率提高到 50%-70%,但该技术也仍未完全解决其更倾向于进行非同源重组的问题。 ③ 解脂耶氏酵母是严格需氧的非发酵酵母,只有在氧气充足时才能实现最佳的生长状态,这可能是大规模工业发酵生产单萜化合物潜在的制约因素。 ④ 当前提高解脂耶氏酵母合成单萜化合物产量的主要方式仍局限于通过增强途径关键酶基因的表达量来增加前体物质的供应量,未来需要开发出更多适用于解脂耶氏酵母的创新工具和技术。[2] 代谢工程 —— 先进的加工技艺 就像烧菜一样,有了 “食材” 和 “炊具”,想要做出美味的菜肴,接下来的重点便是 “烹饪”。目前,通过生物合成途径生产单萜化合物常用的技术手段是 “代谢工程”。 代谢工程 (Metabolic engineering): 又称途径工程,是利用多基因重组技术有目的的对细胞代谢途径进行修饰改造以改变细胞特性,并与细胞基因调控、代谢调控及生化工程相结合,最终实现构建新的代谢途径生产特定目标产物的方法。 在最新发表的综述论文中,于爱群对目前利用微生物代谢工程技术生产单萜类化合物的进展进行了全面梳理,全面深入地总结和剖析了上下游各个过程中所用各种策略所存在的优点和局限性。不同于以往,此次是从最上游到最下游,即在 DNA、RNA、蛋白质、产物、细胞和发酵等不同水平上对已用策略进行了分类分析。 图|单萜化合物生产的代谢工程策略[1] 如上图所示,目前,微生物细胞工厂已经在 DNA 水平、RNA 水平、蛋白质水平、代谢物水平、细胞水平、发酵水平上进行了系统工程改造,通过强大的代谢工程工具高效合成高附加值的单萜化合物。这些代谢工程工具主要包括:途径基因工程、启动子工程、辅助因子工程、蛋白质工程、前体工程、细胞器工程、细胞毒性工程、动态控制工程、以及基于方法和技术的发酵工程。[1] 就现阶段而言,通过代谢工程技术生产各类单萜化合物的研究主要集中于解脂耶氏酵母、酿酒酵母和大肠杆菌等几种微生物底盘细胞。
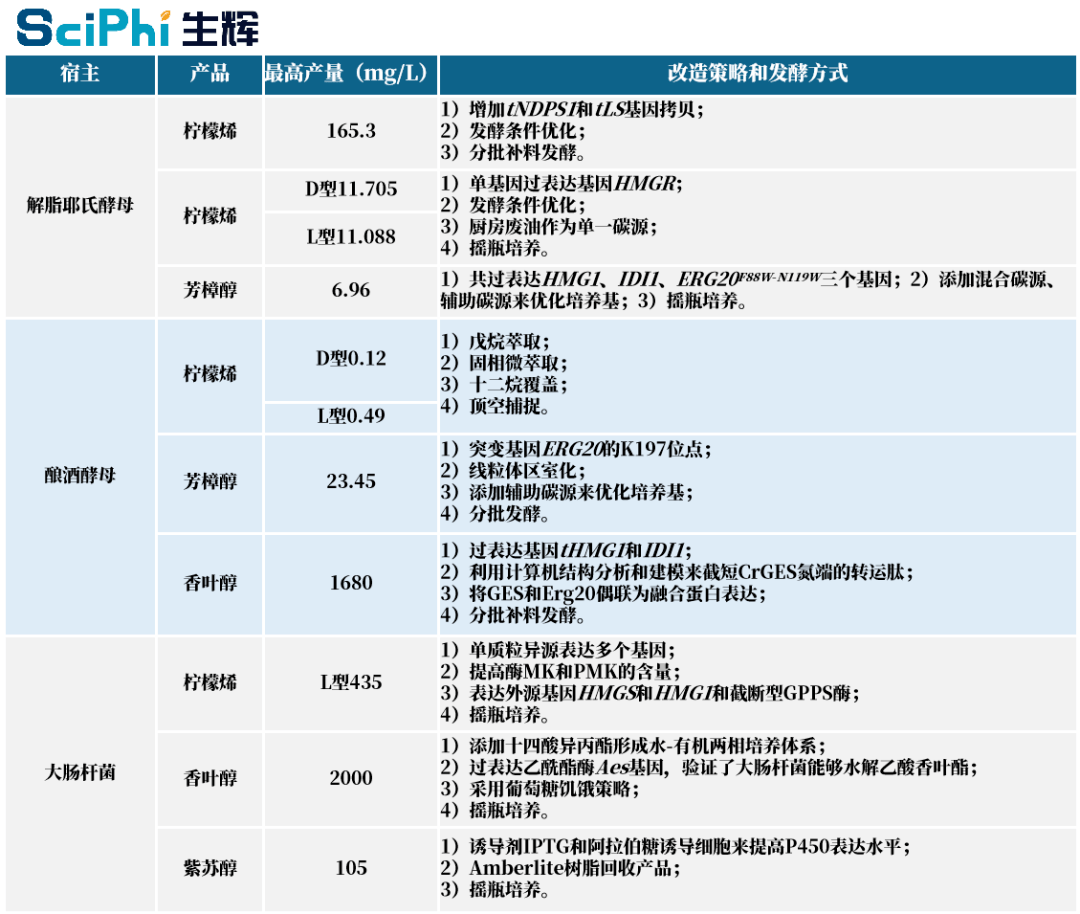
图|通过代谢工程改造微生物细胞生产单萜化合物的产量及策略[3](生辉整理) 利用代谢工程构建的细胞工厂为单萜化合物的绿色生产提供了全新的路线。如上图所示,通过代谢工程对特定微生物细胞的代谢途径进行改造,优化或改变微生物细胞原有的代谢和表达调控网络,现阶段已经成功实现了包括柠檬烯、芳樟醇、香叶醇、紫苏醇等在内的多种单萜化合物的微生物异源合成。[3] 代谢工程中的具体调控方式主要是在转录水平、翻译水平以及蛋白质水平上的调控等。目前的主流思路是通过强化目标产物合成途径中代谢通量来对微生物底盘细胞进行改造,进而实现目标产物产量的提高。 另外,于爱群也指出了当前利用代谢工程改造微生物细胞生产各类单萜化合物所面临的一些挑战,主要归结为以下两点: 其一,采用的微生物底盘细胞的不同,对目标产物的终产量有直接影响,而目前的研究还主要局限在解脂耶氏酵母、酿酒酵母和大肠杆菌等为数不多的底盘细胞中,有待进一步拓展; 其二,依现有技术水平,相关产物在这几种微生物底盘细胞中的产量基本都是毫克级,现阶段还很难满足产业化生产的实际要求。 于爱群表示,目前大多数研究者是从某一个点切入对单萜合成路径进行适配和优化来提高产物产量,而缺少了对多种代谢工程策略的协作使用,因而难以实现系统性的全局优化,此外,研究者们还往往忽略掉单萜合成之后的存储、外排及捕获过程。 为了构建出能够高效合成单萜化合物的细胞工厂并最终实现绿色制造,需要深入探究影响不同微生物底盘细胞高效生产特定目标产物的关键机制及核心问题,还需要进一步明确不同微生物底盘中合成单萜化合物的关键控制节点和与之相对应的控制策略。 对于接下来的研究重点,于爱群列举了应该着力攻关的四个方向: ① 底盘细胞。底盘细胞是各种生化反应进行的场所,未来需要发掘新的、更有工业应用前景的非模式微生物底盘细胞,并找到不同产物与底盘细胞之间的最大兼容性。另外,利用合成生物学技术构建微生物基因组精简优化的底盘细胞也有望成为提高单萜化合物产量的重要策略。 ② 培养基。培养基的成分是决定底盘细胞合成目标物能力高低的重要因素,为了提高目标物产量,未来需要进一步优化培养基成分,以及筛选产物合成途径中相关限速酶激活剂。 ③ 代谢工程策略。只有明确了代谢过程中的关键限制因素,才能有的放矢,实现目标产物产量、产率的大幅提高。因此未来需要利用更理性全面的策略和更先进的技术方法,深入探究影响不同微生物底盘高效生产特定目标产物的限速步骤、关键机制及核心问题。 ④ 代谢产物耐受性。代谢产物的不断积累可能会对微生物底盘细胞造成毒害。比如单萜化合物会引起微生物细胞壁、细胞膜和细胞器膜等结构的破坏,降低某些酶的活性,阻碍细胞生理活动的正常进行,最终导致微生物死亡。未来可以利用诱变育种或适应性进化等技术筛选出耐受性更强的菌株作为底盘细胞。此外,还可以采用萃取、树脂吸收或膜过滤等分离技术,及时地把单萜产物从培养环境中分离出来,实现 “边产生边分离”。 除了上述四点之外,还可以利用由多种微生物底盘细胞组成的混合发酵系统,以及无细胞表达系统等策略来突破现有的一些限制性因素,从而提高代谢工程设计和改造的效率,这将有助于提高利用微生物细胞工厂合成单萜化合物的生产水平。[3] “总之,必须做到上下游系统性的全局优化,才能大幅提高产物产量,实现生产成本的下降。当然,这种系统性的全局优化不是一蹴而就的,需要先找到各个过程中的关键限制点,然后再抓住关键点各个击破。换句话说就是需要 “由面及点,点面结合”,现在我们正在采取的策略就是这样的。” 于爱群补充道。 总结与展望 合成生物学是一门综合了生物学、物理学、计算机学和工程学等众多学科知识于一体的新兴前沿交叉学科,虽然只是生命科学领域中一个新的分支,但合成生物学已经被认为是 21 世纪最重要的生物技术平台。 合成生物学从概念的提出到具体应用不过短短十余年的时间,合成生物学理论和技术的迅猛发展对生命科学基础研究和工业生物技术产生了深远影响,如今已经在微生物细胞工厂的构建方面获得了不小成就,其通过生物合成各种高附加值产品的绿色生产方式展现出了巨大的应用前景和赋能潜力。 最近几年,人工智能开始爆发,对此,于爱群认为:将合成生物学、人工智能,还包括计算生物学、生物信息学等新兴的先进技术与传统的代谢工程进行交叉合作,是今后生物制造领域发展的大势所趋,有望带来产业革命,对于单萜化合物的生物合成也不例外。 谈及技术产业转化,于爱群表示,目前已与新加坡国立大学的 Jee Loon Foo、新加坡理工学院的 Adison Wong、厦门大学的袁吉锋、中山大学的巫瑞波等团队建立了密切的合作关系,正在共同推动几种高附加值产品的产业化。 关于合成生物学对传统发酵工业的作用,于爱群指出:目前的生物发酵过程还存在效率低、机制不明确等问题,未来如何将先进的合成生物学技术与方法合理地运用到生物发酵过程中,并进行完美融合,起到最大的正向作用,将是未来研究的方向。 于爱群总结归纳了接下来需要努力的几个方面: 第一,需要有丰富的理论知识积累。包括生物化学、发酵工程、微生物学、基因工程等方面的基础知识都要掌握; 第二,需要不断学习、与时俱进。合成生物学的发展很快,每天都有大量文章、理论、技术、信息的更新; 第三,设计实验是一回事,更重要的是多做实验。生物属于实验科学,绝大部分结果都是需要实验才能取得的,所以那种合成生物学技术和方法有没有用,不是想出来的,必须要进行实验验证。 采访接近尾声,于爱群概括道:“合成生物学具有定向、快速、高效、准确、可控、高通量、智能化、自动化、高效化等许多优点,这些都是传统的生物发酵工业所比较缺少的东西。所以,合成生物学能够成为促进构建高效生物发酵工业的新引擎与新动力。我相信,合成生物学的发展会给生物发酵工业带来深刻变革,甚至是带来新一轮的产业革命。” 参考文献: [1] Kun Zhu, Jing Kong, Baixiang Zhao, Lanxin Rong, Shiqi Liu, Zhihui Lu, Cuiying Zhang, Dongguang Xiao, Krithi Pushpanathan, Jee Loon Foo, Adison Wong, Aiqun Yu. Metabolic engineering of microbes for monoterpenoid production[J]. Biotechnology Advances, 2021, 53:107837. [2] Jing Kong, Kun Zhu, Shiqi Liu, Lanxin Rong, Dongguang Xiao, Aiqun Yu. Advances in metabolic engineering of Yarrowia lipolytica to synthesize plant-derived terpenoids[J]. Microbiology China, 2021, 48(4): 1302-1313. [3] Kun Zhu, Jing Kong, Lanxin Rong,Shiqi Liu, Dongguang Xiao, Aiqun Yu. Research progress in microbial metabolic engineering for producing monoterpene aroma products[J]. Science and Technology of Food Industry, 2021, 42(7): 390−398. [4] Heyun Zhao,Ying Huang,Jiangke Yang,Li Xu,Yunjun Yan. Review of Yarrowia lipolytica expression system[J]. Chinese Journal of Bioprocess Engineering, 2008,6(3):10-16. [5] Hui Wang, Qingjie Xue, Yuanyuan Yang, Xiuzhen Li, Yunqing Li. Application of Yarrowia lipolytica in food industry[J]. Food and Fermentation Industries, 2018,44(8):291-297. [6] Yu Zhao, Shiqi Liu, Zhihui Lu, Baixiang Zhao, Shuhui Wang, Cuiying Zhang, Dongguang Xiao, Jee Loon Foo, Aiqun Yu. Hybrid promoter engineering strategies in Yarrowia lipolytica: isoamyl alcohol production as a test study. Biotechnology for Biofuels, 2021, 14: 149. [7] Jian Li, Kun Zhu, Lin Miao, Lanxin Rong, Yu Zhao, Shenglong Li, Lijuan Ma, Jianxun Li, Cuiying Zhang, Dongguang Xiao, Jee Loon Foo, Aiqun Yu. Simultaneous improvement of limonene production and tolerance in Yarrowia lipolytica through tolerance engineering and evolutionary engineering. ACS Synthetic Biology, 2021, 10(4): 884-896. [8] Yakun Zhao, Kun Zhu, Jian Li, Yu Zhao, Shenglong Li, Cuiying Zhang, Dongguang Xiao, Aiqun Yu. High-efficiency production of bisabolene from waste cooking oil by metabolically engineered Yarrowia lipolytica. Microbial Biotechnology, 2021, 0(0): 1-17. [9] Jian Li, Jing Kong, Shenglong Li, Yu Zhao, Yakun Zhao, Dongguang Xiao, Aiqun Yu. Advances in adaptive laboratory evolutionary engineering to microbial breeding. Chinese Journal of Biotechnology, 2021, 37(1): 130-141. [10] Xian-En Zhang. Synthetic biology in China: Review and prospects. Scientia Sinica Vitae, 2019, 49(12): 1543-1572. -End- 生辉SynBio,专注于 合成生物学科研及产业化的全链条内容和数据品牌 ↓↓↓ ——你可能错过的 —— 古老「细菌杀手」结合现代生物工具,工/农业应用已经试水,医疗研究蓄势待发 合成生物学初创推出零食品牌,微生物固氮产业发展面临哪些机遇和挑战? 二氧化碳合成食用油?国内外研究屡获进展,但仍面临大规模生产挑战 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |