Michael加成反应的控制 |
您所在的位置:网站首页 › emma和michael › Michael加成反应的控制 |
Michael加成反应的控制
|
算是一个看完策控的每一章以后的笔记,部分章节内容不局限于策控,主要用途就是以后不想翻策控了看这个能达到差不多的效果。原书Part A部分因为没有存图所以暂时搁置,先从Part B开始。主要参考:有机合成——策略与控制(第二版)有的地方同时参考(\approx抄)了老王的PPT,在此对笔者本科阶段的有机化学课老师/课题组导师老王表示由衷的感激!希望其他老师也能像老王一样,做出流芳千古的精品PPT。搬运自笔者的Notion,在每一章节的最后照例都会存在一个summary部分,除特别说明外,余者的summary部分均由Notion自带的AI进行写作完成,在这里笔者也表达一下对科技发展如此神速的感叹吧。引言1,4 or 1,2加成? Michael加成是一个亲核试剂对亲电烯烃(通常是不饱和羰基化合物)的最简单加成,生成1,4-加成产物3,而不是直接与羰基发生亲核加成得到1,亲核试剂可以是各种杂原子or碳亲核试剂,相关应用已经被广泛综述,其基本规则为: 1,2-加成为动力学控制的过程,是由经典相互作用主导的;共轭加成是热力学过程,是受前线轨道作用控制的;活泼的羰基化合物倾向于1,2-加成,而不活泼的倾向1,4-加成,大概的顺序是醛>烷基酮>芳基酮>酯>腈,酰卤很难发生1,4-加成;活泼、碱性强、硬的亲核试剂易发生1,2-加成;不活泼、碱性弱的软亲核试剂易发生1,4-加成;位阻影响,若羰基附近有大基团,则会把加成推向共轭; 硫和磷ylide 硫和磷ylide硫和磷ylide是以上规则的很好例子,简单的硫ylide会与醛or酮反应生成环氧,但是如果亲电试剂是一个共轭醛酮,就有可能生成环氧,或是进攻双键得到环丙烷化的产物。当使用最不稳定、最硬的ylide时,会生成环氧化合物,例如从二甲硫醚衍生而来的硫ylide;而有稳定阴离子能力的亚砜ylide则更软一些,生成环丙基酮;  一个很好的例子是Corey对天然产物eucarvone 16 的合成,用简单的ylide可以很好的得到1,2-加成的环氧,而用亚砜ylide则会共轭加成到最近的烯烃上。在一个连续共轭的体系中,离羰基最近的烯烃通常是最亲电的;  一个很好的硫ylide参与反应的例子画在下图,硫ylide发生干净的分子内共轭加成,因为生成的是五元环中间体,而不是1,2-加成得到的七元环,之后氧负回到羰基,同时打开五元环得到3-6-6并环;  对于有些反应而言,1,2-加成更为重要,例如用还原不饱和醛酮的方法制备烯丙醇就需要一个硬的还原剂,一般选用氢化铝锂;而Wittig反应同样需要1,2-加成,否则就无法开磷氧四元环了。实际上,硬的不稳定的ylide通常发生的是1,2-加成,而如果ylide被稳定则Michael加成就变成可逆过程。在前面讨论的有机锂or格式试剂也会发生直接的1,2-加成; 用一价铜实现Michael加成如果我们想要格式试剂发生1,4-加成,最好的实现办法就是利用一价铜。关于有机铜试剂和不饱和醛酮发生共轭加成的机理到目前为止还有较多争议,但是我们只介绍最简单的一种:有机铜试剂依靠与烯烃形成\eta^2-络合物从而实现对不饱和烯酮的加成,配体从金属转移到双键,形成\eta^3-烯丙基络合物,进一步质子化可以得到Michael加成产物26;  有机铜(I)化合物对Michael加成的立体选择性: 有机铜(I)化合物对Michael加成的立体选择性:用计算量的铜试剂,如RCu,不论带or不带二甲硫醚、三丁基膦等配体,或是烷基铜锂试剂都可以得到极好的效果,甲基铜锂试剂可以很好的共轭加成到难以加成的不饱和烯酮30上,而铜催化的格式试剂反应则主要生成烯丙醇31;对于1,4-加成的产物32的syn-立体化学则是热力学控制的结果,在酸性条件下淬灭反应时,质子化会形成更稳定的cis-并环;  其他情况下,反应会更倾向于生成anti-的立体化学。例如对34的合成就用了对烯烃33的Michael加成,这里利用铜催化的格式试剂得到完美的区域和立体选择性以及近乎定量的产率,立体化学同样来自后处理时的质子化过程,但是这次是在一个比较僵硬的四元环上,此时让两个大基团处于anti-位置更有利一些;  开链化合物通常也能得到好的区域选择性,简单的不饱和酮如39可以和很多种的有机铜试剂发生反应,以高达95%的产率得到1,4-加成产物40;  当不饱和酮的\beta-位带有打的取代基时,共轭加成无论是与1,2-加成还是aldol反应相竞争,都通常得到较差的结果。42和大部分醛在发生期望的Michael加成时,通常只得到1,2-加成的产物44,即使用了甲基锂也是如此,但是如果加入TMSCl到体系中,就可以解决这一问题;  另一个说明TMSCl重要性的例子就是肉桂醛与甲基铜锂反应主要得到醇47,但是如果在甲基铜锂之前就加入TMSCl,就可以98%的产率得到1,4-加成产物46; 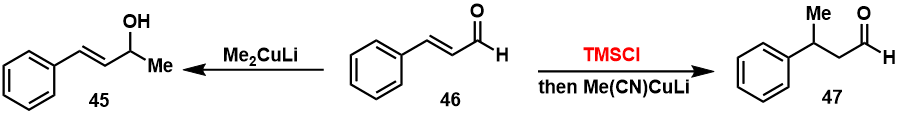 通过硅烷捕获烯醇离子中间体: 通过硅烷捕获烯醇离子中间体:铜锂试剂与TMSCl只能缓慢的反应,所以可以在正式开始Michael加成之前加入氯硅烷,增加1,4-加成的比例,并捕获生成的烯醇化物得到烯醇硅醚。利用这个方法,前文棘手的\beta-大位阻不饱和酮42可以以较高产率得到43,烯醇硅醚用酸orTBAF都可以很好的切掉;  对于醛的加成,铜锂试剂通常比单纯的铜试剂要更好一些,与丁基铜锂反应,丙烯醛本身就可以得到88%的1,4-加成产物50,甚至 \beta -位阻较大的醛51都不能阻止苯基铜锂的1,4-加成;  串联的Michael加成反应 串联的Michael加成反应在对这个策略进行叙述之前,我们先来处理铜锂试剂一个令人不愉快的问题:两个烷基只有一个从铜上转移到了不饱和酮上,另一个在后处理的过程中丢掉了。如果这是一个简单的甲基苯基,这没什么问题,如果铜上连的是自己辛辛苦苦合成的,那浪费一半就难以接受了。铜更倾向于保留复杂的基团,也就是带有更多\pi-电子的基团,对于烷基和炔基有着非常好的选择性:烷基迁移而炔基保留,所以像62这样的铜试剂给出烷基,而炔铜就可以回收。1-戊炔常用在这里,因为它是最小的液态端炔;  三组分合成的断键方法就是除去\alpha 和\beta-位的trans-取代基,所以酮65可以断开为66、乙烯基铜试剂和亲电的溴乙酸酯。合成时碘化亚铜催化的格式试剂加成生成的烯醇镁盐串联上烷基化反应,可以很好的得到trans-65;  官能化的亲核试剂通常需要保护,就像在合成二环烯酮67时,需要一个d^3试剂对69加成,从70衍生的铜试剂与二甲硫醚可以起到这个作用,而去保护和环化可以都在酸性条件下实现。这个合成也说明串联的Michael-aldol反应,对于分子内的aldol反应很实用;  刺桐属生物碱 dihydroerythramine 72 有一个非常棘手的合成问题:三个环连在同一个碳上。断开中间的酰胺键是最好的办法,但是剩下的四级碳原子74也不好合成; 一个好的想法就是将那个四级碳两端的两个C-C键断开,这里用到了硝基来稳定阴离子76,而另一个试剂则用了一边是Michael受体、一边是环氧的亲电试剂77;  最终,一个钯催化的烯丙基乙酸酯的反应用来形成第一个C-C键,未分离的中间体79被用来构筑第二个C-C键,画出80的构象就可以很好的理解为什么会出现非对映异构体的选择性;  但是在合成人参油的主要成分\beta-panasinene 81的过程中仍然使用了铜。Wittig断键后是明显的[2+2]光化学环加成反应,83的\beta-位的两个基团都可以切断,但是切断大一些的84更有意义;  铜催化的Michael加成,紧接着对甲醛的aldol缩合,得到羟醛产物86的非对映异构体1:1混合物,再进一步消除得到83,再经过高效的光化学环加成反应,单一选择性的酮82,这可能是分子内反应的缘故; 然后就发生了一个糟糕的意外:酮82太拥挤了,以至于不能和亚甲基Wittig试剂发生反应。但是Johnson正好利用了这一点,用不对称试剂87,一步完成了拆分和亚甲基化,以42%的产率得到88,进而得到(-)-panasinene 81; 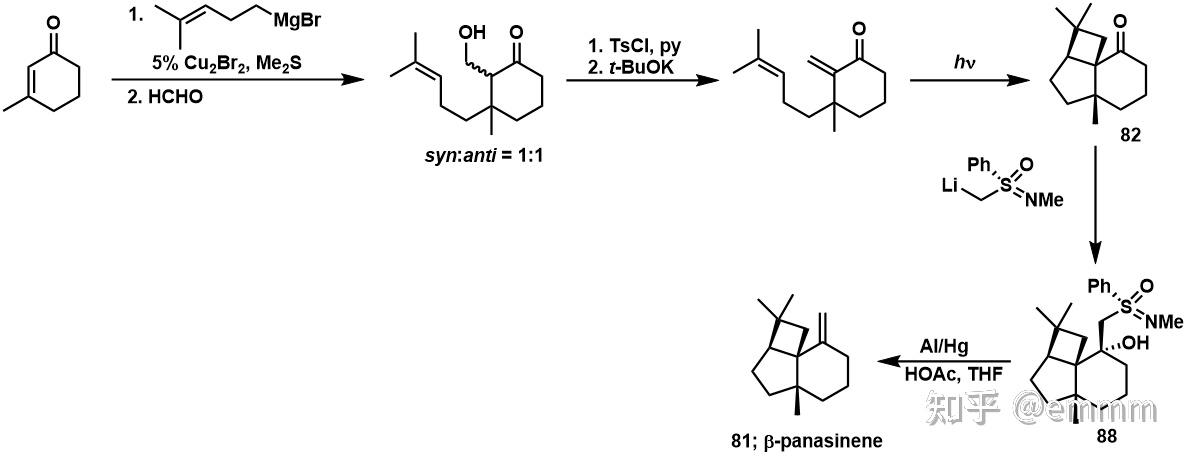 另外一个利用cascade-Michael反应的例子是在合成天然产物Longiborneol时,仅仅利用LiHMDS拔氢之后,发生连续的分子内环化得到目标产物当中的并环体系;  最后我们看一个杂原子作为亲核试剂发生Michael加成的例子:Craig. J. Forsyth等人在合成Azaspiracid-1时,将目标分子拆分成几个片段,可以看到片段和目标分子当中都有较多的缩酮结构,因此他们计划利用double intramolecular hetero-Michael addition的策略完成这些片段的构筑,这里仅举一例;  仅仅利用对甲苯磺酸,在甲苯溶液当中对底物进行酸化,就可以通过串联的Michael加成反应得到其中一个片段,即不断的分子内环化,从而构筑这种连续缩酮的结构;  Summary: 本文介绍了在化学合成中形成C-C单键的方法。其中,主要讨论了Michael加成反应,该反应可以产生高产率的1,4-加成产物。但是,当不饱和酮的 \beta 位阻碍较大时,反应可能不会按预期进行。在这种情况下,可以添加TMSCl来解决这个问题。 本文还介绍了其他方法,包括Wittig断键、光化学环加成反应等。同时,也介绍了一些具体的化合物的合成方法,如Azaspiracid-1和Longiborneol。 此外,本文强调在某些情况下需要采用特殊策略来克服合成过程中的挑战。例如,在 \beta -panasinene 81的合成中使用铜导致了意外的结果。然而,研究人员利用这一点,采用了独特的不对称试剂来完成该过程,产率达到了42%的产物88,从而导致(-)-panasinene 81的合成。 总的来说,本文提供了各种合成C-C单键的方法的综合概述,包括它们的优点和局限性,以及它们在合成各种化合物中的具体应用示例。 |
【本文地址】