指南与共识 |
您所在的位置:网站首页 › crrtppt › 指南与共识 |
指南与共识
|
点击上方“中国实用外科杂志” 可以订阅哦! 通信作者:赵玉沛院士
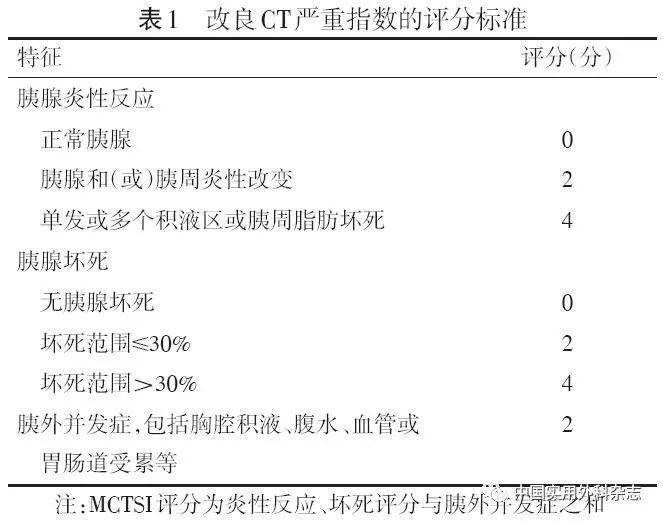
李非教授 【引用本文】中华医学会外科学分会胰腺外科学组. 中国急性胰腺炎诊治指南(2021)[J]. 中国实用外科杂志,2021,41(7):735-742. 中国急性胰腺炎诊治指南(2021) 中华医学会外科学分会胰腺外科学组 中国实用外科杂志,2021,41(7):735-742 通信作者:赵玉沛,E-mail:[email protected] 急性胰腺炎指因胰酶异常激活对胰腺自身及周围器官产生消化作用而引起的、以胰腺局部炎性反应为主要特征,甚至可导致器官功能障碍的急腹症。2014年,经中华医学会外科学分会胰腺外科学组反复讨论、修改,发布了《急性胰腺炎诊治指南(2014)》[1]。该指南的发布对推动急性胰腺炎诊疗规范化,提高病人救治水平发挥了重要作用。7年来,急性胰腺炎在诊治理念、方式、策略等方面发生了显著变化,为体现学科进展,中华医学会外科学分会胰腺外科学组对《急性胰腺炎诊治指南(2014)》进行了修订,以期为我国急性胰腺炎临床诊疗实践提供证据,并促进其与国际接轨。 本指南在参考以往指南及专家共识的基础上,采用以循证为依据、问题为导向的表述方式,经专家充分讨论,形成29条推荐意见,包含诊断、治疗及随访三部分。本指南使用GRADE证据分级评价系统评估临床证据质量(高、中、低),并采用推荐强度(强烈推荐和一般性推荐)表示指南制定专家对推荐意见的认可程度。 1 急性胰腺炎的诊断1.1 流行病学与病因学 目前,我国尚缺乏完整的急性胰腺炎流行病学资料。在世界范围内,急性胰腺炎是常见的需住院治疗的消化系统急症,其发病率存在一定地区差异,为(4.9~73.4)/10万。近年来,急性胰腺炎的发病率呈上升趋势,临床需高度重视[2]。 急性胰腺炎病因众多,不同病因引起的急性胰腺炎的病人年龄、性别分布及疾病严重程度各不相同。在我国,胆石症仍是急性胰腺炎的主要病因,其次为高甘油三酯血症及过度饮酒。高甘油三酯血症性及酒精性急性胰腺炎更常发生于年轻男性病人,老年病人以胆源性居多[3]。其他较少见原因包括药物、内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)术后、高钙血症、感染、遗传、自身免疫疾病和创伤等[2]。对病因的早期控制有助于缓解病情,改善预后,并预防急性胰腺炎复发。 1.2 临床表现 急性胰腺炎的典型症状为急性发作的持续性上腹部剧烈疼痛,常向背部放射,伴有腹胀、恶心、呕吐,且呕吐后疼痛不缓解,部分病人可出现心动过速、低血压、少尿等休克表现,严重脱水和老年病人可出现精神状态改变。临床体征轻者仅表现为腹部轻压痛,重者可出现腹膜刺激征,偶见腰肋部皮下淤斑征(Grey-Turner 征)和脐周皮下淤斑征(Cullen 征)。急性胰腺炎可并发一个或多个器官功能障碍,以呼吸功能、肾功能损害常见。实验室检查可见血清淀粉酶及脂肪酶升高,脂肪酶升高对急性胰腺炎诊断的特异度优于淀粉酶。血清淀粉酶及脂肪酶升高程度与疾病的严重程度无关。腹部CT是诊断急性胰腺炎的重要影像学检查方法。急性胰腺炎早期典型的影像学表现为胰腺水肿、胰周渗出、胰腺和(或)胰周组织坏死等。 1.3 急性胰腺炎的诊断标准 急性胰腺炎的诊断标准包括以下3项:(1)上腹部持续性疼痛。(2)血清淀粉酶和(或)脂肪酶浓度至少高于正常上限值3倍。(3)腹部影像学检查结果显示符合急性胰腺炎影像学改变。上述3项标准中符合2项即可诊断为急性胰腺炎[2]。 推荐1:临床上符合症状、实验室检查及影像学检查3项特征中的2项可做出急性胰腺炎的诊断。(证据等级:高;推荐强度:强) 1.4 急性胰腺炎的影像学检查 典型的CT表现是诊断急性胰腺炎的重要依据,但发病初始的影像学特征不能反映疾病的严重程度。除非确诊需要,CT检查应在发病72 h后进行。CT增强扫描可准确反映是否存在胰腺坏死及其范围。改良CT严重指数(MCTSI)有助于评估急性胰腺炎的严重程度(表1)。
MRI可用于碘造影剂过敏、肾功能不全、年轻或怀孕病人,其检查胰腺水肿的敏感度优于CT,亦可用于判断局部是否存在并发症,但对诊断积聚液体中气泡的敏感度较低[4]。 对可疑胆源性急性胰腺炎的病人,应在入院时或发病48 h内行超声检查,以明确是否存在胆道系统结石。磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)或内镜超声(endoscopic ultrasound,EUS)检查有助于发现隐匿性胆道系统结石[5]。 推荐2:除非确诊需要,否则急性胰腺炎发病初期不推荐进行增强CT检查。(证据等级:中;推荐强度:强) 推荐3:对于可疑胆源性急性胰腺炎的病人,入院时或发病初期应常规进行超声检查明确是否存在胆道系统结石。(证据等级:中;推荐强度:强) 1.5 急性胰腺炎的严重程度分级 临床常用的急性胰腺炎严重程度分级包括修订版Atlanta分级(revised Atlanta classification,RAC)及基于决定因素的分级(determinant-based classification,DBC),目前前者应用居多(表2)。
RAC分级:(1)轻症急性胰腺炎(mild acute pancreatitis,MAP),占急性胰腺炎的80%~85%,不伴有器官功能障碍及局部或全身并发症,通常在1~2 周内恢复,病死率极低。(2)中重症急性胰腺炎(moderately severe acute pancreatitis,MSAP),伴有一过性(≤48 h)的器官功能障碍和(或)局部并发症,早期病死率低,如坏死组织合并感染,则病死率增高。(3)重症急性胰腺炎(severe acute pancreatitis,SAP),占急性胰腺炎的5%~10%,伴有持续(>48 h)的器官功能障碍,病死率高。器官功能障碍的诊断标准基于改良Marshall 评分系统,任何器官评分≥2分可定义存在器官功能障碍(表3)。
DBC分级基于器官功能障碍和感染2项影响预后的因素进行分类。(1)轻型急性胰腺炎:无胰腺(胰周)坏死及器官功能障碍。(2)中型急性胰腺炎:无菌性胰腺(胰周)坏死和(或)一过性(≤48 h)器官功能障碍。(3)重型急性胰腺炎:感染性胰腺(胰周)坏死或持续性(>48 h)器官功能障碍。(4)危重型急性胰腺炎(critical acute pancreatitis,CAP):持续性器官功能障碍伴感染性胰腺(胰周)坏死。DBC分级中,器官功能障碍依据SOFA评分系统进行诊断。 目前研究结果表明,RAC分级和DBC分级在预测急性胰腺炎病人的病死率、重症监护室(ICU)入住率及ICU住院时间等方面差异无统计学意义[6]。DBC分级需明确是否存在胰腺和(或)胰周感染,不适用于病程早期应用。CAP病人伴有持续器官功能障碍和胰腺(胰周)坏死感染,虽不常见,但病死率高,临床应给予高度重视[6-7]。 本指南中的SAP指RAC分级下的SAP。 推荐4:RAC分级和DBC分级均可用于急性胰腺炎严重程度的分级,两者在预测病死率、ICU入住率及ICU住院时间等方面无明显差异。(证据等级:中;推荐强度:强) 推荐5:CAP病人伴有持续器官功能障碍和胰腺(胰周)坏死感染,病死率高,须予以高度重视。(证据等级:中;推荐强度:强) 推荐6:目前尚无准确的SAP预测系统,应严密监护病人的器官功能,警惕SAP的发生。(证据等级:中;推荐强度:强) 1.7 急性胰腺炎的病程分期 急性胰腺炎的病程可分为早期和后期,两个阶段相互重叠,分别对应急性胰腺炎病程中的两个死亡高峰。早期指发病至发病后2周,其特点为出现全身炎性反应综合征(systemic inflammatory response syndrome,SIRS)及器官功能障碍。虽然急性胰腺炎早期阶段可出现局部并发症,但此时的局部并发症不是疾病严重程度的主要决定因素。后期指发病2周后,其特点为有可能持续存在的SIRS、器官功能障碍和局部并发症。在病程的后期,持续存在的SIRS和器官功能障碍是病情严重程度的重要决定因素。此外,局部并发症特别是感染性并发症亦会影响病人预后。 推荐7:急性胰腺炎的病程可分为早期(发病2周及以内)和后期(发病2周后),分别对应病程中的两个死亡高峰,两个阶段的病情可能有重叠。(证据等级:中;推荐强度:一般) 1.8 急性胰腺炎的并发症 急性胰腺炎可引起全身或局部并发症。全身并发症主要有SIRS、脓毒症、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)、腹腔高压及腹腔间隔室综合征(abdominal compartment syndrome,ACS)。局部并发症主要与胰腺和胰周液体积聚、组织坏死有关,包括早期(发病4周及以内)的急性胰周液体积聚、急性坏死物积聚(acute necrotic collection,ANC),以及后期(发病4周后)的胰腺假性囊肿(pancreatic pseudocyst,PP)、包裹性坏死(walled-off necrosis,WON)[8](表4)。以上局部并发症又分为无菌性和感染性两种类型。其他并发症还包括消化道出血、腹腔出血、胆道梗阻、肠梗阻、肠瘘等。
1.1 流行病学与病因学 目前,我国尚缺乏完整的急性胰腺炎流行病学资料。在世界范围内,急性胰腺炎是常见的需住院治疗的消化系统急症,其发病率存在一定地区差异,为(4.9~73.4)/10万。近年来,急性胰腺炎的发病率呈上升趋势,临床需高度重视[2]。 急性胰腺炎病因众多,不同病因引起的急性胰腺炎的病人年龄、性别分布及疾病严重程度各不相同。在我国,胆石症仍是急性胰腺炎的主要病因,其次为高甘油三酯血症及过度饮酒。高甘油三酯血症性及酒精性急性胰腺炎更常发生于年轻男性病人,老年病人以胆源性居多[3]。其他较少见原因包括药物、内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)术后、高钙血症、感染、遗传、自身免疫疾病和创伤等[2]。对病因的早期控制有助于缓解病情,改善预后,并预防急性胰腺炎复发。 1.2 临床表现 急性胰腺炎的典型症状为急性发作的持续性上腹部剧烈疼痛,常向背部放射,伴有腹胀、恶心、呕吐,且呕吐后疼痛不缓解,部分病人可出现心动过速、低血压、少尿等休克表现,严重脱水和老年病人可出现精神状态改变。临床体征轻者仅表现为腹部轻压痛,重者可出现腹膜刺激征,偶见腰肋部皮下淤斑征(Grey-Turner 征)和脐周皮下淤斑征(Cullen 征)。急性胰腺炎可并发一个或多个器官功能障碍,以呼吸功能、肾功能损害常见。实验室检查可见血清淀粉酶及脂肪酶升高,脂肪酶升高对急性胰腺炎诊断的特异度优于淀粉酶。血清淀粉酶及脂肪酶升高程度与疾病的严重程度无关。腹部CT是诊断急性胰腺炎的重要影像学检查方法。急性胰腺炎早期典型的影像学表现为胰腺水肿、胰周渗出、胰腺和(或)胰周组织坏死等。 1.3 急性胰腺炎的诊断标准 急性胰腺炎的诊断标准包括以下3项:(1)上腹部持续性疼痛。(2)血清淀粉酶和(或)脂肪酶浓度至少高于正常上限值3倍。(3)腹部影像学检查结果显示符合急性胰腺炎影像学改变。上述3项标准中符合2项即可诊断为急性胰腺炎[2]。 推荐1:临床上符合症状、实验室检查及影像学检查3项特征中的2项可做出急性胰腺炎的诊断。(证据等级:高;推荐强度:强) 1.4 急性胰腺炎的影像学检查 典型的CT表现是诊断急性胰腺炎的重要依据,但发病初始的影像学特征不能反映疾病的严重程度。除非确诊需要,CT检查应在发病72 h后进行。CT增强扫描可准确反映是否存在胰腺坏死及其范围。改良CT严重指数(MCTSI)有助于评估急性胰腺炎的严重程度(表1)。
MRI可用于碘造影剂过敏、肾功能不全、年轻或怀孕病人,其检查胰腺水肿的敏感度优于CT,亦可用于判断局部是否存在并发症,但对诊断积聚液体中气泡的敏感度较低[4]。 对可疑胆源性急性胰腺炎的病人,应在入院时或发病48 h内行超声检查,以明确是否存在胆道系统结石。磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)或内镜超声(endoscopic ultrasound,EUS)检查有助于发现隐匿性胆道系统结石[5]。 推荐2:除非确诊需要,否则急性胰腺炎发病初期不推荐进行增强CT检查。(证据等级:中;推荐强度:强) 推荐3:对于可疑胆源性急性胰腺炎的病人,入院时或发病初期应常规进行超声检查明确是否存在胆道系统结石。(证据等级:中;推荐强度:强) 1.5 急性胰腺炎的严重程度分级 临床常用的急性胰腺炎严重程度分级包括修订版Atlanta分级(revised Atlanta classification,RAC)及基于决定因素的分级(determinant-based classification,DBC),目前前者应用居多(表2)。
RAC分级:(1)轻症急性胰腺炎(mild acute pancreatitis,MAP),占急性胰腺炎的80%~85%,不伴有器官功能障碍及局部或全身并发症,通常在1~2 周内恢复,病死率极低。(2)中重症急性胰腺炎(moderately severe acute pancreatitis,MSAP),伴有一过性(≤48 h)的器官功能障碍和(或)局部并发症,早期病死率低,如坏死组织合并感染,则病死率增高。(3)重症急性胰腺炎(severe acute pancreatitis,SAP),占急性胰腺炎的5%~10%,伴有持续(>48 h)的器官功能障碍,病死率高。器官功能障碍的诊断标准基于改良Marshall 评分系统,任何器官评分≥2分可定义存在器官功能障碍(表3)。
DBC分级基于器官功能障碍和感染2项影响预后的因素进行分类。(1)轻型急性胰腺炎:无胰腺(胰周)坏死及器官功能障碍。(2)中型急性胰腺炎:无菌性胰腺(胰周)坏死和(或)一过性(≤48 h)器官功能障碍。(3)重型急性胰腺炎:感染性胰腺(胰周)坏死或持续性(>48 h)器官功能障碍。(4)危重型急性胰腺炎(critical acute pancreatitis,CAP):持续性器官功能障碍伴感染性胰腺(胰周)坏死。DBC分级中,器官功能障碍依据SOFA评分系统进行诊断。 目前研究结果表明,RAC分级和DBC分级在预测急性胰腺炎病人的病死率、重症监护室(ICU)入住率及ICU住院时间等方面差异无统计学意义[6]。DBC分级需明确是否存在胰腺和(或)胰周感染,不适用于病程早期应用。CAP病人伴有持续器官功能障碍和胰腺(胰周)坏死感染,虽不常见,但病死率高,临床应给予高度重视[6-7]。 本指南中的SAP指RAC分级下的SAP。 推荐4:RAC分级和DBC分级均可用于急性胰腺炎严重程度的分级,两者在预测病死率、ICU入住率及ICU住院时间等方面无明显差异。(证据等级:中;推荐强度:强) 推荐5:CAP病人伴有持续器官功能障碍和胰腺(胰周)坏死感染,病死率高,须予以高度重视。(证据等级:中;推荐强度:强) 推荐6:目前尚无准确的SAP预测系统,应严密监护病人的器官功能,警惕SAP的发生。(证据等级:中;推荐强度:强) 1.7 急性胰腺炎的病程分期 急性胰腺炎的病程可分为早期和后期,两个阶段相互重叠,分别对应急性胰腺炎病程中的两个死亡高峰。早期指发病至发病后2周,其特点为出现全身炎性反应综合征(systemic inflammatory response syndrome,SIRS)及器官功能障碍。虽然急性胰腺炎早期阶段可出现局部并发症,但此时的局部并发症不是疾病严重程度的主要决定因素。后期指发病2周后,其特点为有可能持续存在的SIRS、器官功能障碍和局部并发症。在病程的后期,持续存在的SIRS和器官功能障碍是病情严重程度的重要决定因素。此外,局部并发症特别是感染性并发症亦会影响病人预后。 推荐7:急性胰腺炎的病程可分为早期(发病2周及以内)和后期(发病2周后),分别对应病程中的两个死亡高峰,两个阶段的病情可能有重叠。(证据等级:中;推荐强度:一般) 1.8 急性胰腺炎的并发症 急性胰腺炎可引起全身或局部并发症。全身并发症主要有SIRS、脓毒症、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)、腹腔高压及腹腔间隔室综合征(abdominal compartment syndrome,ACS)。局部并发症主要与胰腺和胰周液体积聚、组织坏死有关,包括早期(发病4周及以内)的急性胰周液体积聚、急性坏死物积聚(acute necrotic collection,ANC),以及后期(发病4周后)的胰腺假性囊肿(pancreatic pseudocyst,PP)、包裹性坏死(walled-off necrosis,WON)[8](表4)。以上局部并发症又分为无菌性和感染性两种类型。其他并发症还包括消化道出血、腹腔出血、胆道梗阻、肠梗阻、肠瘘等。
急性胰腺炎特别是伴多种并发症的SAP的治疗,是涉及外科、消化内科、急诊科、重症医学科、感染科、介入科、营养科、康复科等多个学科的复杂问题,应采用多学科综合治疗协作组(MDT)模式。 2.1 早期治疗 急性胰腺炎的早期治疗主要包括液体治疗、镇痛与营养支持,以及针对病因和早期并发症的治疗。 2.1.1 急性胰腺炎病人的液体治疗 早期液体治疗可改善组织灌注,需在诊断急性胰腺炎后即刻进行。对于SAP,可采用目标导向的治疗模式,应反复评估血流动力学状态以指导液体滴注[9]。乳酸林格液、生理盐水等晶体液可作为液体治疗的首选[10]。开始时,推荐以5~10 mL/(kg·h)的速度进行液体治疗,过程中应警惕液体负荷过重导致的组织水肿及器官功能障碍[11]。目前,液体治疗成功的指标尚未统一,可参考早期目标导向治疗的复苏目标,包括尿量>0.5 mL/(kg·h)、平均动脉压>65 mmHg(1 mmHg=0.133 kPa)、中心静脉压 8~12 mmHg、中心静脉血氧饱和度≥70%。另外,动脉血乳酸、血清尿素氮水平及血细胞比容的下降亦提示复苏有效[10]。对持续存在低血压的急性胰腺炎病人,可在液体复苏过程中或之后给予去甲肾上腺素提升血压。 推荐8:确诊急性胰腺炎的病人应使用晶体液,以5~10 mL/(kg·h)的速度即刻进行液体治疗。(证据等级:中;推荐强度:强) 2.1.2 急诊ERCP治疗指征与时机 胆道系统结石是急性胰腺炎的常见病因。多年来,急诊ERCP治疗是否有助于缓解胆源性急性胰腺炎的病情存在争议。目前,不推荐对预测为轻症的急性胰腺炎病人行急诊ERCP治疗 [12]。APEC研究结果证实,急诊ERCP亦无助于缓解预测为SAP病人的病情[13]。目前认为,急诊ERCP仅适用于胆源性胰腺炎合并胆管炎病人,且应在病人入院24 h内完成。对于存在持续性胆管梗阻的病人亦可考虑ERCP治疗,手术时机可放宽至入院后72 h内[14]。 推荐9:急诊ERCP无助于缓解胆源性急性胰腺炎的病情,仅适用于急性胰腺炎合并胆管炎及持续胆道梗阻的病人。(证据等级:高;推荐强度:强) 2.1.3 急性胰腺炎病人的镇痛治疗 疼痛是急性胰腺炎的主要症状,缓解疼痛是临床重要的治疗目标。明显疼痛的急性胰腺炎病人应在入院24 h内接受镇痛治疗。阿片类药物和非甾体抗炎药等均曾用于急性胰腺炎病人的镇痛治疗,但各种镇痛药物用于治疗急性胰腺炎有效性和安全性的证据有限,目前鲜见针对急性胰腺炎镇痛治疗的共识和指南。有研究者发现,对于非气管插管病人,盐酸二氢吗啡酮的镇痛效果优于吗啡和芬太尼[15]。对于需要长期大剂量阿片类药物治疗的SAP和CAP病人,可考虑使用硬膜外镇痛。另有研究者发现,ICU内接受硬膜外镇痛治疗的急性胰腺炎病人的30 d内病死率更低[16]。目前推荐对急性胰腺炎病人按照围手术期急性疼痛方式(全身给药与局部给药联合,病人自控镇痛与多模式镇痛联合)进行镇痛治疗。 推荐10:镇痛是急性胰腺炎的重要辅助治疗措施,可能改善病人预后,应根据病情合理选择镇痛药物与方式。(证据等级:中;推荐强度:一般) 2.1.4 急性胰腺炎病人的营养支持治疗 有研究结果显示,相较于肠外营养,肠内营养对于不同严重程度的急性胰腺炎病人是安全、可耐受的,可降低感染性并发症、多器官功能障碍发生率和病死率[17]。病人对鼻胃管和鼻空肠管的耐受性,以及操作后并发症发生率和病死率差异无统计学意义。Meta分析结果显示,鼻胃管有较好的安全性和可行性。相较于鼻空肠管,鼻胃管的放置更便捷,但当病人存在胃排空延迟或幽门梗阻时,应使用鼻空肠管[18]。 多项Meta分析结果支持急性胰腺炎发病24 h或48 h内启动肠内营养[9]。研究结果表明,48 h内启动肠内营养比延后启动更有效,表现在感染及器官功能障碍发生率和病死率更低等方面。一项纳入205例急性胰腺炎的多中心随机对照试验比较了24 h和72 h内启动肠内营养的有效性及安全性,发现二者住院期间感染发生率及病死率差异无统计学意义,说明早期启动肠内营养是安全的[19]。针对急性胰腺炎病人饮食成分的研究有限,已证实低脂、软食是安全的,氨基酸型相较于短肽型或整蛋白型营养制剂无显著临床获益[20]。 推荐11:在胃肠功能耐受的情况下,应尽早开展经口或肠内营养。(证据等级:高;推荐强度:强) 推荐12:对于不能经口进食的急性胰腺炎病人,肠内营养优于肠外营养。(证据等级:高;推荐强度:强) 2.1.5 高脂血症性急性胰腺炎的早期治疗 与其他原因引起的急性胰腺炎相比,高脂血症性急性胰腺炎的临床表现更严重。急性胰腺炎合并静脉乳糜状血或血甘油三酯>11.3 mmol/L可明确诊断为高脂血症性急性胰腺炎。除急性胰腺炎的常规治疗外,针对高脂血症性急性胰腺炎的早期治疗应包括禁食水≥24 h后的饮食调节,使用降血脂药物及其他辅助降脂手段[小剂量低分子肝素、胰岛素、血脂吸附和(或)血浆置换]控制血脂[21]。早期控制甘油三酯水平是否影响急性胰腺炎并发症发生率与病死率仍有争议[17]。目前,推荐尽快将甘油三酯水平降至11.3 mmol/L可诊断高脂血症性急性胰腺炎,需采用综合治疗手段以快速降低甘油三酯水平。(证据等级:中;推荐强度:强) 2.1.6 ACS的早期处理 SAP病人可合并ACS,当腹内压>20 mmHg时,常伴有新发器官功能障碍,是急性胰腺炎病人死亡的重要原因之一。ACS 的治疗原则是:及时采用有效的措施降低腹内压,包括增加腹壁顺应性,如使用镇痛药、镇静药、肌松药等;清除胃肠内容物,如采用胃肠减压、灌肠、使用促胃肠动力药等方式;避免过量液体滴注,并引流腹腔或腹膜后积液等,如经皮穿刺引流[23]。不建议在急性胰腺炎早期将ACS作为开腹手术的指征[24]。 推荐14:ACS是急性胰腺炎病人早期死亡的重要原因,需采用包括增加腹壁顺应性、清除胃肠内容物、引流腹腔及腹膜后积液等综合措施降低腹内压,不建议早期行开腹手术。(证据等级:中;推荐强度:强) 2.1.7 急性胰腺炎病人的预防性抗菌药物使用 急性胰腺炎的治疗中,预防性使用抗菌药物一直存在争议[25]。研究结果显示,预防性使用抗菌药物不能降低胰周或胰腺感染的发生率,反而可能增加多重耐药菌及真菌感染风险[26]。因此,对于无感染证据的急性胰腺炎,不推荐预防性使用抗菌药物。对于可疑或确诊的胰腺(胰周)或胰外感染(如胆道系统、肺部、泌尿系统、导管相关感染等)的病人,可经验性使用抗菌药物,并尽快进行体液培养,根据细菌培养和药物敏感试验结果调整抗菌药物。 推荐15:不推荐常规使用抗菌药物预防胰腺或胰周感染。(证据等级:高;推荐强度:强) 2.1.8 急性胰腺炎的药物治疗 现阶段仍缺乏针对急性胰腺炎的特异性药物。有关蛋白酶抑制剂及胰酶抑制剂,如生长抑素及其类似物在急性胰腺炎中的治疗价值尚缺乏高质量的临床证据[27]。中药(大黄、芒硝及复方制剂,如清胰汤、大承气汤等)有助于促进病人胃肠道功能恢复,减轻腹痛、腹胀症状,可选择使用。 2.2 后期治疗 急性胰腺炎的后期治疗主要针对其各种局部并发症。在此阶段,病人仍可能存在器官功能障碍。持续的器官功能障碍是病人预后不佳的独立危险因素,显著增加外科处理风险。急性胰腺炎的后期并发症主要包括PP、WON、出血、消化道瘘等。对于无症状的PP及WON,无需采取处理措施,而WON合并感染是外科处理的主要对象。 2.2.1 感染性胰腺坏死(infected pancreatic necrosis,IPN)的诊断 IPN包括早期的ANC合并感染和后期的WON合并感染。及时准确的诊断是后续治疗的重要依据,发热、腹痛等症状对IPN诊断有较强的提示作用。部分感染严重的病人可出现全身情况恶化,出现肾功能不全、呼吸功能不全、凝血功能异常,甚至循环不稳定等。动态监测白细胞计数、C反应蛋白、IL-6、降钙素原等实验室指标有助于IPN的诊断及疗效判断。有研究认为,降钙素原可对IPN病人总体预后进行早期和可靠的评估[28]。影像学检查对判断感染范围、评估严重程度及选择后续治疗措施有至关重要的作用,其中CT检查结果示“气泡征”是IPN诊断的直接证据。不推荐常规行细针穿刺抽吸检查以明确是否存在感染。 推荐16:急性胰腺炎病人出现发热、腹痛、全身状况恶化等感染症状时应考虑IPN可能。(证据等级:中;推荐强度:强) 推荐17:建议对怀疑IPN的病人行包括降钙素原在内的炎症指标检测及CT检查以辅助诊断。不建议对怀疑IPN的病人常规行细针穿刺抽吸检查。(证据等级:高;推荐强度:强) 2.2.2 IPN的治疗 IPN是急性胰腺炎后的严重并发症,约30%的坏死性胰腺炎病人出现继发感染,病死率达30%。IPN的主要治疗手段包括应用抗菌药物、经皮穿刺引流(percutaneous catheter drainage,PCD)或内镜下穿刺引流、外科视频辅助清创或内镜下清创及开腹手术。应用抗菌药物是治疗IPN的重要手段,对考虑IPN的病人应经验性使用抗菌药物,并尽快进行体液细菌培养,根据药物敏感性试验结果调整抗菌药物,以减少耐药菌的产生。PCD或内镜下穿刺引流对部分病人有效,可使其免于进一步的手术治疗。目前,视频辅助清创与内镜下清创等微创手术逐渐成为IPN手术的主流方式。开腹手术可作为微创治疗失败后的补充手段。 推荐18:IPN是急性胰腺炎的严重并发症,常需手术治疗。抗菌药物及穿刺引流可使部分病人免于手术。微创清创逐渐成为IPN手术的主流方式,开腹手术可作为微创治疗失败后的补充手段。(证据等级:中;推荐强度:强) 2.2.3 IPN的手术策略 目前认为IPN的首选干预策略为“Step-up”方式[29],即首先进行穿刺引流,对引流效果不佳的病人依次进行视频辅助清创和开腹手术[30]。随着内镜技术的进步,内镜下“Step-up”手术的使用逐渐增多[31]。穿刺引流的优势在于以较小的创伤迅速改善病人的全身情况,为后续治疗创造条件。但部分IPN病人经过积极支持治疗后,器官功能正常,全身状态良好,无需通过PCD改善病人的全身情况;另外,部分病人缺乏安全穿刺入路或预计PCD效果不佳,亦可不局限于“Step-up”策略,直接进行手术治疗[32]。 推荐19:IPN病人的治疗以“Step-up”策略为主。(证据等级:高;推荐强度:强) 推荐20:对于部分经严格选择的病例,可直接行手术治疗。(证据等级:低;推荐强度:强) 2.2.4 外科与内镜“Step-up”的选择 近年来,对于外科“Step-up”与内镜“Step-up”的对照研究较多。总体上,两者在病死率与严重并发症发生率方面差异无统计学意义[33]。内镜治疗的优势在于降低胰瘘及切口疝的发生率,但内镜清创操作次数较多,不适用于所有IPN病人,对于两侧结肠后间隙及盆腔腹膜后区域感染的处理,外科“Step-up”更具优势。另外,内镜治疗需专门器械及有经验的术者操作。现阶段,外科“Step-up”仍为多数中心治疗IPN的首选。 推荐21:外科或内镜“Step-up”手术各具优势。现阶段,外科“Step-up”仍为多数中心IPN治疗的首选。(证据等级:高;推荐强度:强) 2.2.5 经皮及内镜下穿刺引流的指征与时机 影像学或内镜引导下穿刺置入引流管是控制胰腺或胰周感染的重要措施。PCD可在超声或CT引导下进行,首选经腹膜后路径穿刺;内镜下引流通常经胃壁或十二指肠壁进行。在急性胰腺炎病程的早期是否可行引流治疗目前仍存在争议。一般认为,对于高度可疑或确诊的胰腺坏死感染,即使尚未形成完整包裹,若药物治疗效果不佳,PCD仍是控制感染的安全、有效的措施。有研究认为,早期行内镜下引流同样安全[34]。对于合并ACS的急性胰腺炎病人,若存在大量腹腔或腹膜后积液,应考虑穿刺引流以降低腹内压;发病后期,对于因压迫消化道或胆道而引起症状的局部并发症亦可行引流治疗。 推荐22:胰腺或胰周感染是PCD和内镜下穿刺引流的重要指征,可在急性胰腺炎病程早期进行。(证据等级:中;推荐强度:强) 推荐23:对于存在大量腹腔或腹膜后积液合并ACS的急性胰腺炎病人,亦可进行穿刺引流;应早期(<72 h)拔除引流管,以减少继发感染。(证据等级:低;推荐强度:一般) 2.2.6 IPN的手术时机 手术时机是决定IPN病人预后的重要因素。研究结果显示,早期手术病人的病死率可达>50%,而延迟手术可降低病人并发症发生率和病死率[35]。因此,国内外指南均明确指出,IPN手术治疗的干预时机应延迟至发病4周后[1,24]。但目前关于IPN延迟手术的证据均来自开腹手术实践,在微创治疗日益普及的今天,手术时机是否需要调整仍待多中心、前瞻性研究结果证实。 推荐24:目前IPN的手术干预时机为急性胰腺炎发病4周后。(证据等级:中;推荐级别:强) 2.2.7 胰瘘与胰管断裂综合征的处理 胰瘘多由各种原因引起的胰管破裂所致,其治疗原则以通畅引流和抑制胰腺分泌为主,必要时可行内镜和外科手术治疗。20%~40%的坏死性胰腺炎病人可伴有胰管部分或完全的中断,WON病人合并胰腺与胰管断裂综合征(disconnected pancreatic duct syndrome,DPDS)的比例最高[36]。胰管的完整性可通过MRCP进行评估。目前,对于DPDS尚无统一的治疗标准。2018年《欧洲消化内镜学会急性坏死性胰腺炎内镜治疗多学科循证指南》指出,WON经腔内引流术后,建议长期留置双猪尾塑料支架,以减少液体积聚再发风险[37]。当发生部分主胰管破裂时,可考虑用支架对破口进行桥接,主胰管完全破裂可考虑EUS引导下主胰管引流。如内镜手术失败或再次发生液体积聚,可选择手术治疗,方式包括胰腺远端切除术和Roux-en-Y引流[37]。 推荐25:DPDS病人首选内镜下治疗。(证据等级:中;推荐级别:强) 2.2.8 急性胰腺炎后门静脉、脾静脉血栓形成及胰源性门静脉高压的处理 门静脉、脾静脉血栓形成在急性胰腺炎病人中的发生率约为13%,严重者可导致肝功能衰竭、门静脉高压、脾脏和肠管坏死等。血栓形成与胰腺坏死位置和程度有关。研究发现,门静脉、脾静脉血栓形成后,抗凝治疗并未提高血管再通率,反而增加出血的发生率[38]。因此,不建议对急性胰腺炎后门静脉及脾静脉血栓形成病人行抗凝治疗。 胰源性门静脉高压,又称左侧门静脉高压,多由急、慢性胰腺炎导致。多数胰源性门静脉高压无明显临床表现,可随访观察。少数病人表现为上消化道大出血,除对症止血治疗外,积极处理胰腺原发疾病是治疗的关键,对反复出血者,可考虑行脾切除术。对合并严重脾功能亢进的病人,可行脾动脉栓塞或脾切除术。 推荐26:急性胰腺炎后门静脉、脾静脉血栓常见,可表现为左侧门静脉高压症状,无需抗凝治疗。(证据等级:低;推荐级别:一般) 2.2.9 急性胰腺炎并发肠瘘、腹腔出血的处理 急性胰腺炎后发生的肠瘘以结肠瘘常见,多由胰液腐蚀或手术操作等原因引起,治疗方式包括通畅引流及造口转流手术。对于发生腹腔出血的病人,建议先行血管造影检查明确出血部位,如为动脉性出血,则行血管栓塞术治疗;如未明确出血部位或栓塞失败、出血持续者,可行手术治疗[2]。 急性胰腺炎特别是伴多种并发症的SAP的治疗,是涉及外科、消化内科、急诊科、重症医学科、感染科、介入科、营养科、康复科等多个学科的复杂问题,应采用多学科综合治疗协作组(MDT)模式。 2.1 早期治疗 急性胰腺炎的早期治疗主要包括液体治疗、镇痛与营养支持,以及针对病因和早期并发症的治疗。 2.1.1 急性胰腺炎病人的液体治疗 早期液体治疗可改善组织灌注,需在诊断急性胰腺炎后即刻进行。对于SAP,可采用目标导向的治疗模式,应反复评估血流动力学状态以指导液体滴注[9]。乳酸林格液、生理盐水等晶体液可作为液体治疗的首选[10]。开始时,推荐以5~10 mL/(kg·h)的速度进行液体治疗,过程中应警惕液体负荷过重导致的组织水肿及器官功能障碍[11]。目前,液体治疗成功的指标尚未统一,可参考早期目标导向治疗的复苏目标,包括尿量>0.5 mL/(kg·h)、平均动脉压>65 mmHg(1 mmHg=0.133 kPa)、中心静脉压 8~12 mmHg、中心静脉血氧饱和度≥70%。另外,动脉血乳酸、血清尿素氮水平及血细胞比容的下降亦提示复苏有效[10]。对持续存在低血压的急性胰腺炎病人,可在液体复苏过程中或之后给予去甲肾上腺素提升血压。 推荐8:确诊急性胰腺炎的病人应使用晶体液,以5~10 mL/(kg·h)的速度即刻进行液体治疗。(证据等级:中;推荐强度:强) 2.1.2 急诊ERCP治疗指征与时机 胆道系统结石是急性胰腺炎的常见病因。多年来,急诊ERCP治疗是否有助于缓解胆源性急性胰腺炎的病情存在争议。目前,不推荐对预测为轻症的急性胰腺炎病人行急诊ERCP治疗 [12]。APEC研究结果证实,急诊ERCP亦无助于缓解预测为SAP病人的病情[13]。目前认为,急诊ERCP仅适用于胆源性胰腺炎合并胆管炎病人,且应在病人入院24 h内完成。对于存在持续性胆管梗阻的病人亦可考虑ERCP治疗,手术时机可放宽至入院后72 h内[14]。 推荐9:急诊ERCP无助于缓解胆源性急性胰腺炎的病情,仅适用于急性胰腺炎合并胆管炎及持续胆道梗阻的病人。(证据等级:高;推荐强度:强) 2.1.3 急性胰腺炎病人的镇痛治疗 疼痛是急性胰腺炎的主要症状,缓解疼痛是临床重要的治疗目标。明显疼痛的急性胰腺炎病人应在入院24 h内接受镇痛治疗。阿片类药物和非甾体抗炎药等均曾用于急性胰腺炎病人的镇痛治疗,但各种镇痛药物用于治疗急性胰腺炎有效性和安全性的证据有限,目前鲜见针对急性胰腺炎镇痛治疗的共识和指南。有研究者发现,对于非气管插管病人,盐酸二氢吗啡酮的镇痛效果优于吗啡和芬太尼[15]。对于需要长期大剂量阿片类药物治疗的SAP和CAP病人,可考虑使用硬膜外镇痛。另有研究者发现,ICU内接受硬膜外镇痛治疗的急性胰腺炎病人的30 d内病死率更低[16]。目前推荐对急性胰腺炎病人按照围手术期急性疼痛方式(全身给药与局部给药联合,病人自控镇痛与多模式镇痛联合)进行镇痛治疗。 推荐10:镇痛是急性胰腺炎的重要辅助治疗措施,可能改善病人预后,应根据病情合理选择镇痛药物与方式。(证据等级:中;推荐强度:一般) 2.1.4 急性胰腺炎病人的营养支持治疗 有研究结果显示,相较于肠外营养,肠内营养对于不同严重程度的急性胰腺炎病人是安全、可耐受的,可降低感染性并发症、多器官功能障碍发生率和病死率[17]。病人对鼻胃管和鼻空肠管的耐受性,以及操作后并发症发生率和病死率差异无统计学意义。Meta分析结果显示,鼻胃管有较好的安全性和可行性。相较于鼻空肠管,鼻胃管的放置更便捷,但当病人存在胃排空延迟或幽门梗阻时,应使用鼻空肠管[18]。 多项Meta分析结果支持急性胰腺炎发病24 h或48 h内启动肠内营养[9]。研究结果表明,48 h内启动肠内营养比延后启动更有效,表现在感染及器官功能障碍发生率和病死率更低等方面。一项纳入205例急性胰腺炎的多中心随机对照试验比较了24 h和72 h内启动肠内营养的有效性及安全性,发现二者住院期间感染发生率及病死率差异无统计学意义,说明早期启动肠内营养是安全的[19]。针对急性胰腺炎病人饮食成分的研究有限,已证实低脂、软食是安全的,氨基酸型相较于短肽型或整蛋白型营养制剂无显著临床获益[20]。 推荐11:在胃肠功能耐受的情况下,应尽早开展经口或肠内营养。(证据等级:高;推荐强度:强) 推荐12:对于不能经口进食的急性胰腺炎病人,肠内营养优于肠外营养。(证据等级:高;推荐强度:强) 2.1.5 高脂血症性急性胰腺炎的早期治疗 与其他原因引起的急性胰腺炎相比,高脂血症性急性胰腺炎的临床表现更严重。急性胰腺炎合并静脉乳糜状血或血甘油三酯>11.3 mmol/L可明确诊断为高脂血症性急性胰腺炎。除急性胰腺炎的常规治疗外,针对高脂血症性急性胰腺炎的早期治疗应包括禁食水≥24 h后的饮食调节,使用降血脂药物及其他辅助降脂手段[小剂量低分子肝素、胰岛素、血脂吸附和(或)血浆置换]控制血脂[21]。早期控制甘油三酯水平是否影响急性胰腺炎并发症发生率与病死率仍有争议[17]。目前,推荐尽快将甘油三酯水平降至11.3 mmol/L可诊断高脂血症性急性胰腺炎,需采用综合治疗手段以快速降低甘油三酯水平。(证据等级:中;推荐强度:强) 2.1.6 ACS的早期处理 SAP病人可合并ACS,当腹内压>20 mmHg时,常伴有新发器官功能障碍,是急性胰腺炎病人死亡的重要原因之一。ACS 的治疗原则是:及时采用有效的措施降低腹内压,包括增加腹壁顺应性,如使用镇痛药、镇静药、肌松药等;清除胃肠内容物,如采用胃肠减压、灌肠、使用促胃肠动力药等方式;避免过量液体滴注,并引流腹腔或腹膜后积液等,如经皮穿刺引流[23]。不建议在急性胰腺炎早期将ACS作为开腹手术的指征[24]。 推荐14:ACS是急性胰腺炎病人早期死亡的重要原因,需采用包括增加腹壁顺应性、清除胃肠内容物、引流腹腔及腹膜后积液等综合措施降低腹内压,不建议早期行开腹手术。(证据等级:中;推荐强度:强) 2.1.7 急性胰腺炎病人的预防性抗菌药物使用 急性胰腺炎的治疗中,预防性使用抗菌药物一直存在争议[25]。研究结果显示,预防性使用抗菌药物不能降低胰周或胰腺感染的发生率,反而可能增加多重耐药菌及真菌感染风险[26]。因此,对于无感染证据的急性胰腺炎,不推荐预防性使用抗菌药物。对于可疑或确诊的胰腺(胰周)或胰外感染(如胆道系统、肺部、泌尿系统、导管相关感染等)的病人,可经验性使用抗菌药物,并尽快进行体液培养,根据细菌培养和药物敏感试验结果调整抗菌药物。 推荐15:不推荐常规使用抗菌药物预防胰腺或胰周感染。(证据等级:高;推荐强度:强) 2.1.8 急性胰腺炎的药物治疗 现阶段仍缺乏针对急性胰腺炎的特异性药物。有关蛋白酶抑制剂及胰酶抑制剂,如生长抑素及其类似物在急性胰腺炎中的治疗价值尚缺乏高质量的临床证据[27]。中药(大黄、芒硝及复方制剂,如清胰汤、大承气汤等)有助于促进病人胃肠道功能恢复,减轻腹痛、腹胀症状,可选择使用。 2.2 后期治疗 急性胰腺炎的后期治疗主要针对其各种局部并发症。在此阶段,病人仍可能存在器官功能障碍。持续的器官功能障碍是病人预后不佳的独立危险因素,显著增加外科处理风险。急性胰腺炎的后期并发症主要包括PP、WON、出血、消化道瘘等。对于无症状的PP及WON,无需采取处理措施,而WON合并感染是外科处理的主要对象。 2.2.1 感染性胰腺坏死(infected pancreatic necrosis,IPN)的诊断 IPN包括早期的ANC合并感染和后期的WON合并感染。及时准确的诊断是后续治疗的重要依据,发热、腹痛等症状对IPN诊断有较强的提示作用。部分感染严重的病人可出现全身情况恶化,出现肾功能不全、呼吸功能不全、凝血功能异常,甚至循环不稳定等。动态监测白细胞计数、C反应蛋白、IL-6、降钙素原等实验室指标有助于IPN的诊断及疗效判断。有研究认为,降钙素原可对IPN病人总体预后进行早期和可靠的评估[28]。影像学检查对判断感染范围、评估严重程度及选择后续治疗措施有至关重要的作用,其中CT检查结果示“气泡征”是IPN诊断的直接证据。不推荐常规行细针穿刺抽吸检查以明确是否存在感染。 推荐16:急性胰腺炎病人出现发热、腹痛、全身状况恶化等感染症状时应考虑IPN可能。(证据等级:中;推荐强度:强) 推荐17:建议对怀疑IPN的病人行包括降钙素原在内的炎症指标检测及CT检查以辅助诊断。不建议对怀疑IPN的病人常规行细针穿刺抽吸检查。(证据等级:高;推荐强度:强) 2.2.2 IPN的治疗 IPN是急性胰腺炎后的严重并发症,约30%的坏死性胰腺炎病人出现继发感染,病死率达30%。IPN的主要治疗手段包括应用抗菌药物、经皮穿刺引流(percutaneous catheter drainage,PCD)或内镜下穿刺引流、外科视频辅助清创或内镜下清创及开腹手术。应用抗菌药物是治疗IPN的重要手段,对考虑IPN的病人应经验性使用抗菌药物,并尽快进行体液细菌培养,根据药物敏感性试验结果调整抗菌药物,以减少耐药菌的产生。PCD或内镜下穿刺引流对部分病人有效,可使其免于进一步的手术治疗。目前,视频辅助清创与内镜下清创等微创手术逐渐成为IPN手术的主流方式。开腹手术可作为微创治疗失败后的补充手段。 推荐18:IPN是急性胰腺炎的严重并发症,常需手术治疗。抗菌药物及穿刺引流可使部分病人免于手术。微创清创逐渐成为IPN手术的主流方式,开腹手术可作为微创治疗失败后的补充手段。(证据等级:中;推荐强度:强) 2.2.3 IPN的手术策略 目前认为IPN的首选干预策略为“Step-up”方式[29],即首先进行穿刺引流,对引流效果不佳的病人依次进行视频辅助清创和开腹手术[30]。随着内镜技术的进步,内镜下“Step-up”手术的使用逐渐增多[31]。穿刺引流的优势在于以较小的创伤迅速改善病人的全身情况,为后续治疗创造条件。但部分IPN病人经过积极支持治疗后,器官功能正常,全身状态良好,无需通过PCD改善病人的全身情况;另外,部分病人缺乏安全穿刺入路或预计PCD效果不佳,亦可不局限于“Step-up”策略,直接进行手术治疗[32]。 推荐19:IPN病人的治疗以“Step-up”策略为主。(证据等级:高;推荐强度:强) 推荐20:对于部分经严格选择的病例,可直接行手术治疗。(证据等级:低;推荐强度:强) 2.2.4 外科与内镜“Step-up”的选择 近年来,对于外科“Step-up”与内镜“Step-up”的对照研究较多。总体上,两者在病死率与严重并发症发生率方面差异无统计学意义[33]。内镜治疗的优势在于降低胰瘘及切口疝的发生率,但内镜清创操作次数较多,不适用于所有IPN病人,对于两侧结肠后间隙及盆腔腹膜后区域感染的处理,外科“Step-up”更具优势。另外,内镜治疗需专门器械及有经验的术者操作。现阶段,外科“Step-up”仍为多数中心治疗IPN的首选。 推荐21:外科或内镜“Step-up”手术各具优势。现阶段,外科“Step-up”仍为多数中心IPN治疗的首选。(证据等级:高;推荐强度:强) 2.2.5 经皮及内镜下穿刺引流的指征与时机 影像学或内镜引导下穿刺置入引流管是控制胰腺或胰周感染的重要措施。PCD可在超声或CT引导下进行,首选经腹膜后路径穿刺;内镜下引流通常经胃壁或十二指肠壁进行。在急性胰腺炎病程的早期是否可行引流治疗目前仍存在争议。一般认为,对于高度可疑或确诊的胰腺坏死感染,即使尚未形成完整包裹,若药物治疗效果不佳,PCD仍是控制感染的安全、有效的措施。有研究认为,早期行内镜下引流同样安全[34]。对于合并ACS的急性胰腺炎病人,若存在大量腹腔或腹膜后积液,应考虑穿刺引流以降低腹内压;发病后期,对于因压迫消化道或胆道而引起症状的局部并发症亦可行引流治疗。 推荐22:胰腺或胰周感染是PCD和内镜下穿刺引流的重要指征,可在急性胰腺炎病程早期进行。(证据等级:中;推荐强度:强) 推荐23:对于存在大量腹腔或腹膜后积液合并ACS的急性胰腺炎病人,亦可进行穿刺引流;应早期(<72 h)拔除引流管,以减少继发感染。(证据等级:低;推荐强度:一般) 2.2.6 IPN的手术时机 手术时机是决定IPN病人预后的重要因素。研究结果显示,早期手术病人的病死率可达>50%,而延迟手术可降低病人并发症发生率和病死率[35]。因此,国内外指南均明确指出,IPN手术治疗的干预时机应延迟至发病4周后[1,24]。但目前关于IPN延迟手术的证据均来自开腹手术实践,在微创治疗日益普及的今天,手术时机是否需要调整仍待多中心、前瞻性研究结果证实。 推荐24:目前IPN的手术干预时机为急性胰腺炎发病4周后。(证据等级:中;推荐级别:强) 2.2.7 胰瘘与胰管断裂综合征的处理 胰瘘多由各种原因引起的胰管破裂所致,其治疗原则以通畅引流和抑制胰腺分泌为主,必要时可行内镜和外科手术治疗。20%~40%的坏死性胰腺炎病人可伴有胰管部分或完全的中断,WON病人合并胰腺与胰管断裂综合征(disconnected pancreatic duct syndrome,DPDS)的比例最高[36]。胰管的完整性可通过MRCP进行评估。目前,对于DPDS尚无统一的治疗标准。2018年《欧洲消化内镜学会急性坏死性胰腺炎内镜治疗多学科循证指南》指出,WON经腔内引流术后,建议长期留置双猪尾塑料支架,以减少液体积聚再发风险[37]。当发生部分主胰管破裂时,可考虑用支架对破口进行桥接,主胰管完全破裂可考虑EUS引导下主胰管引流。如内镜手术失败或再次发生液体积聚,可选择手术治疗,方式包括胰腺远端切除术和Roux-en-Y引流[37]。 推荐25:DPDS病人首选内镜下治疗。(证据等级:中;推荐级别:强) 2.2.8 急性胰腺炎后门静脉、脾静脉血栓形成及胰源性门静脉高压的处理 门静脉、脾静脉血栓形成在急性胰腺炎病人中的发生率约为13%,严重者可导致肝功能衰竭、门静脉高压、脾脏和肠管坏死等。血栓形成与胰腺坏死位置和程度有关。研究发现,门静脉、脾静脉血栓形成后,抗凝治疗并未提高血管再通率,反而增加出血的发生率[38]。因此,不建议对急性胰腺炎后门静脉及脾静脉血栓形成病人行抗凝治疗。 胰源性门静脉高压,又称左侧门静脉高压,多由急、慢性胰腺炎导致。多数胰源性门静脉高压无明显临床表现,可随访观察。少数病人表现为上消化道大出血,除对症止血治疗外,积极处理胰腺原发疾病是治疗的关键,对反复出血者,可考虑行脾切除术。对合并严重脾功能亢进的病人,可行脾动脉栓塞或脾切除术。 推荐26:急性胰腺炎后门静脉、脾静脉血栓常见,可表现为左侧门静脉高压症状,无需抗凝治疗。(证据等级:低;推荐级别:一般) 2.2.9 急性胰腺炎并发肠瘘、腹腔出血的处理 急性胰腺炎后发生的肠瘘以结肠瘘常见,多由胰液腐蚀或手术操作等原因引起,治疗方式包括通畅引流及造口转流手术。对于发生腹腔出血的病人,建议先行血管造影检查明确出血部位,如为动脉性出血,则行血管栓塞术治疗;如未明确出血部位或栓塞失败、出血持续者,可行手术治疗[2]。 3 复发预防及随访有研究发现,21%的首发急性胰腺炎病人会发展为复发性急性胰腺炎(recurrent acute pancreatitis,RAP),其特征为急性胰腺炎发作次数≥2次,且两次发病间隔≥3个月[39-40]。病因治疗是预防急性胰腺炎反复发作的主要手段。胆囊切除术有助于预防胆源性胰腺炎反复发作;对高脂血症病人,通过低脂饮食和减重后血脂控制仍不佳者,需要口服降脂药物治疗[41];戒酒是酒精性急性胰腺炎的重要治疗方式,即便是入院后短期戒酒对预防酒精性急性胰腺炎反复发作亦有作用。 推荐27:约20%的急性胰腺炎病人会进展为RAP,针对病因的治疗有助于预防急性胰腺炎复发。(证据等级:中;推荐级别:强) 3.1 胆源性胰腺炎胆囊切除的时机 腹腔镜胆囊切除术是预防胆源性胰腺炎复发的主要手段,原则上应尽早进行。对于MAP伴胆囊结石的病人,在排除胆总管结石的情况下,建议在当次发病出院前完成胆囊切除术,MSAP及SAP病人可在发病后1~3个月实施手术[24,42]。 推荐28:胆源性胰腺炎合并胆囊结石的病人,推荐尽早行胆囊切除术。(证据等级:高;推荐级别:强) 3.2 急性胰腺炎病人的随访 文献报道,急性胰腺炎病人1年内胰腺外分泌功能不全的发生率为61%~85%,部分病人的外分泌功能不全会持续6~18个月[43];约1/3的病人会出现胰腺内分泌功能不全,约40%的病人会在急性胰腺炎后出现糖尿病或糖尿病前驱表现[44-45]。因此,急性胰腺炎病人康复后均需进行规律随访。MAP病人随访至出院后6个月,MSAP及SAP病人至少持续至出院后18个月。每6个月对胰腺功能进行评估,并注意是否出现远期并发症及病因(如胆结石、高脂血症)是否去除。 推荐29:急性胰腺炎病人康复后需进行规律随访以及时发现并治疗急性胰腺炎的远期并发症。(证据等级:弱;推荐级别:一般) 本指南评估了目前获得的证据,并结合国情提出有关急性胰腺炎诊治的指导性原则,以期为临床实践提供依据。需要指出的是,急性胰腺炎特别是SAP的临床过程复杂,个体差异性大,临床医师需根据具体情况采用个体化的诊疗措施,以获得最佳疗效。 有研究发现,21%的首发急性胰腺炎病人会发展为复发性急性胰腺炎(recurrent acute pancreatitis,RAP),其特征为急性胰腺炎发作次数≥2次,且两次发病间隔≥3个月[39-40]。病因治疗是预防急性胰腺炎反复发作的主要手段。胆囊切除术有助于预防胆源性胰腺炎反复发作;对高脂血症病人,通过低脂饮食和减重后血脂控制仍不佳者,需要口服降脂药物治疗[41];戒酒是酒精性急性胰腺炎的重要治疗方式,即便是入院后短期戒酒对预防酒精性急性胰腺炎反复发作亦有作用。 推荐27:约20%的急性胰腺炎病人会进展为RAP,针对病因的治疗有助于预防急性胰腺炎复发。(证据等级:中;推荐级别:强) 3.1 胆源性胰腺炎胆囊切除的时机 腹腔镜胆囊切除术是预防胆源性胰腺炎复发的主要手段,原则上应尽早进行。对于MAP伴胆囊结石的病人,在排除胆总管结石的情况下,建议在当次发病出院前完成胆囊切除术,MSAP及SAP病人可在发病后1~3个月实施手术[24,42]。 推荐28:胆源性胰腺炎合并胆囊结石的病人,推荐尽早行胆囊切除术。(证据等级:高;推荐级别:强) 3.2 急性胰腺炎病人的随访 文献报道,急性胰腺炎病人1年内胰腺外分泌功能不全的发生率为61%~85%,部分病人的外分泌功能不全会持续6~18个月[43];约1/3的病人会出现胰腺内分泌功能不全,约40%的病人会在急性胰腺炎后出现糖尿病或糖尿病前驱表现[44-45]。因此,急性胰腺炎病人康复后均需进行规律随访。MAP病人随访至出院后6个月,MSAP及SAP病人至少持续至出院后18个月。每6个月对胰腺功能进行评估,并注意是否出现远期并发症及病因(如胆结石、高脂血症)是否去除。 推荐29:急性胰腺炎病人康复后需进行规律随访以及时发现并治疗急性胰腺炎的远期并发症。(证据等级:弱;推荐级别:一般) 本指南评估了目前获得的证据,并结合国情提出有关急性胰腺炎诊治的指导性原则,以期为临床实践提供依据。需要指出的是,急性胰腺炎特别是SAP的临床过程复杂,个体差异性大,临床医师需根据具体情况采用个体化的诊疗措施,以获得最佳疗效。 参与本指南审定及讨论的专家(按姓氏汉语拼音排序): 蔡守旺(解放军总医院第一医学中心) 陈汝福(广东省人民医院) 曹 锋(首都医科大学宣武医院) 傅德良(复旦大学附属华山医院) 葛春林(中国医科大学附属第一医院) 郝纯毅(北京大学肿瘤医院) 郝继辉(天津医科大学肿瘤医院) 黄鹤光(福建医科大学附属协和医院) 简志祥(广东省人民医院) 金 钢(海军军医大学附属长海医院) 李 昂(首都医科大学宣武医院) 李 非(首都医科大学宣武医院) 李海民(空军军医大学第一附属医院) 李升平(中山大学附属肿瘤医院) 李维勤(东部战区总医院) 李宜雄(中南大学湘雅医院) 梁廷波(浙江大学医学院附属第一医院) 刘续宝(四川大学华西医院) 楼文晖(复旦大学附属中山医院) 苗 毅(南京医科大学第一附属医院) 牟一平(浙江省人民医院) 彭承宏(上海交通大学医学院附属瑞金医院) 秦仁义(华中科技大学同济医学院附属同济医院) 邵成浩(海军军医大学附属长征医院) 孙 备(哈尔滨医科大学附属第一医院) 谭 广(大连医科大学附属第一医院) 田孝东(北京大学第一医院) 王槐志(中国科学院大学重庆医院) 王 磊(山东大学齐鲁医院) 王 巍(复旦大学附属肿瘤医院) 王伟林(浙江大学医学院附属第二医院) 韦军民(北京医院) 吴河水(华中科技大学同济医学院附属协和医院) 吴文铭(中国医学科学院 北京协和医学院 北京协和医院) 仵 正(西安交通大学第一附属医院) 闫长青(河北医科大学第二医院) 杨尹默(北京大学第一医院) 殷晓煜(中山大学附属第一医院) 虞先濬(复旦大学附属肿瘤医院) 原春辉(北京大学第三医院) 张太平(中国医学科学院 北京协和医学院 北京协和医院) 赵玉沛(中国医学科学院 北京协和医学院 北京协和医院) 执笔专家:李 非,曹 锋 利益冲突 所有作者均声明不存在利益冲突 参考文献 (在框内滑动手指即可浏览) [1] 中华医学会外科学分会胰腺外科学组.急性胰腺炎诊治指南(2014)[J]. 中华外科杂志,2014,53(1):50-53. [2] Boxhoorn L,Voermans RP,Bouwense SA,et al. Acute pancreatitis[J]. Lancet,2020,396(10252):726-734. [3] Zheng Y,Zhou Z,Li H,et al. A multicenter study on etiology of acute pancreatitis in Beijing during 5 years[J]. Pancreas,2015,44(3):409-414. [5] Wan J,Ouyang Y,Yu C,et al. Comparison of EUS with MRCP in idiopathic acute pancreatitis: a systematic review and meta-analysis[J]. Gastrointest Endosc,2018,87(5):1180-1188.e9. [6] Bansal SS,Hodson J,Sutcliffe RS,et al. Performance of the revised Atlanta and determinant-based classifications for severity in acute pancreatitis[J]. Br J Surg,2016,103(4):427-433. [7] Kadiyala V,Suleiman SL,McNabb-Baltar J,et al. The Atlanta classification,revised Atlanta classification,and determinant-based classification of acute pancreatitis: which is best at stratifying outcomes?[J]. Pancreas,2016,45(4):510-515. [8] Hines OJ,Pandol SJ. Management of severe acute pancreatitis[J]. BMJ,2019,367:l6227. [9] Crockett SD,Wani S,Gardner TB,et al. American Gastroenterological Association Institute guideline on initial management of acute pancreatitis[J]. Gastroenterology,2018,154(4):1096-1101. [10] Iqbal U,Anwar H,Scribani M. Ringer's lactate versus normal saline in acute pancreatitis: a systematic review and meta-analysis[J]. J Dig Dis,2018,19(6):335-341 [11] Vege SS,DiMagno MJ,Forsmark CE,et al. Initial medical treatment of acute pancreatitis: American Gastroenterological Association Institute Technical Review[J]. Gastroenterology,2018,154(4):1103-1139. [12] Burstow MJ,Yunus RM,Hossain MB,et al. Meta-analysis of early endoscopic retrograde cholangiopancreatography(ERCP)±endoscopic sphincterotomy(ES) versus conservative management for gallstone pancreatitis(GSP)[J]. Surg Laparosc Endosc Percutan Tech,2015,25(3):185-203. [13] Schepers NJ,Hallensleben N,Besselink MG,et al. Urgent endoscopic retrograde cholangiopancreatography with sphincterotomy versus conservative treatment in predicted severe acute gallstone pancreatitis (APEC): a multicentre randomised controlled trial[J]. Lancet,2020,396(10245):167-176. [14] Fogel EL,Sherman S. ERCP for gallstone pancreatitis[J]. N Engl J Med,2014,370(2):150-157. [15] Stigliano S,Sternby H,de Madaria E,et al. Early management of acute pancreatitis:A review of the best evidence[J]. Dig Liver Dis,2017,49(6):585-594. [16] Jabaudon M,Belhadj-Tahar N,Rimmelé T,et al. Thoracic epidural analgesia and mortality in acute pancreatitis: a multicenter propensity analysis[J]. Crit Care Med,2018,46(3):e198. [17] Arvanitakis M,Ockenga J,Bezmarevic M,et al. ESPEN guideline on clinical nutrition in acute and chronic pancreatitis[J]. Clin Nutr,2020,39(3):612-631. [19] Bakker OJ,van Brunschot S,van Santvoort HC,et al. Early versus on-demand nasoenteric tube feeding in acute pancreatitis[J]. N Engl J Med,2014,371(21):1983-1993. [20] Endo A,Shiraishi A,Fushimi K,et al. Comparative effectiveness of elemental formula in the early enteral nutrition management of acute pancreatitis: a retrospective cohort study[J]. Ann Intensive Care,2018,8(1):69. [21] Adiamah A,Psaltis E,Crook M,et al. A systematic review of the epidemiology,pathophysiology and current management of hyperlipidaemic pancreatitis[J]. Clin Nutr,2018,37(6 Pt A):1810-1822. [22] Christian JB,Arondekar B,Buysman EK,et al. Clinical and economic benefits observed when follow-up triglyceride levels are less than 500 mg/dL in patients with severe hypertriglyceridemia[J]. J Clin Lipidol,2012,6(5):450-461. [23] Gottlieb M,Koyfman A,Long B. Evaluation and management of abdominal compartment syndrome in the emergency department[J]. J Emerg Med,2020,58(1):43-53. [24] Leppäniemi A,Tolonen M,Tarasconi A,et al. 2019 WSES guidelines for the management of severe acute pancreatitis[J]. World J Emerg Surg,2019,14:27. [25] Mourad MM,Evans R,Kalidindi V,et al. Prophylactic antibiotics in acute pancreatitis: endless debate[J]. Ann R Coll Surg Engl,2017,99(2):107-112. [26] Reuken PA,Albig H,Rödel J,et al. Fungal infections in patients with infected pancreatic necrosis and pseudocysts:risk factors and outcome[J]. Pancreas,2018,47(1):92-98. [27] Moggia E,Koti R,Belgaumkar AP,et al. Pharmacological interventions for acute pancreatitis[J]. Cochrane Database Syst Rev,2017,4(4):CD011384. [28] Rau BM,Kemppainen EA,Gumbs AA,et al. Early assessment of pancreatic infections and overall prognosis in severe acute pancreatitis by procalcitonin (PCT): a prospective international multicenter study[J]. Ann Surg,2007,245(5):745-754. [29] Hollemans RA,Bakker OJ,Boermeester MA,et al. Superiority of step-up approach vs open necrosectomy in long-term follow-up of patients with necrotizing pancreatitis[J]. Gastroenterology,2019,156(4):1016-1026. [30] van Santvoort HC,Besselink MG,Bakker OJ,et al. A step-up approach or open necrosectomy for necrotizing pancreatitis[J]. N Engl J Med,2010,362(16):1491-1502. [31] van Brunschot S,Hollemans RA,Bakker OJ,et al. Minimally invasive and endoscopic versus open necrosectomy for necrotising pancreatitis: a pooled analysis of individual data for 1980 patients[J]. Gut,2018,67(4):697-706. [32] Cao F,Duan N,Gao C,et al. One-step verse step-up laparoscopic-assisted necrosectomy for infected pancreatic necrosis[J]. Dig Surg,2020,37(3):211-219. [33] van Brunschot S,van Grinsven J,van Santvoort HC,et al. Endoscopic or surgical step-up approach for infected necrotising pancreatitis: a multicentre randomised trial[J]. Lancet,2018,391(10115):51-58. [34] van Grinsven J,van Santvoort HC,Boermeester MA,et al. Timing of catheter drainage in infected necrotizing pancreatitis[J]. Nat Rev Gastroenterol Hepatol,2016,13(5):306-312. [35] Mowery NT,Bruns BR,MacNew HG,et al. Surgical management of pancreatic necrosis: a practice management guideline from the Eastern Association for the Surgery of Trauma[J]. J Trauma Acute Care Surg,2017,83(2):316-327. [36] Bang JY,Wilcox CM,Navaneethan U,et al. Impact of Disconnected Pancreatic Duct Syndrome on the Endoscopic Management of Pancreatic Fluid Collections[J]. Ann Surg,2018,267(3):561-568. [37] Arvanitakis M,Dumonceau JM,Albert J,et al. Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guidelines[J]. Endoscopy,2018,50(5):524-546. [38] Easler J,Muddana V,Furlan A,et al. Portosplenomesenteric venous thrombosis in patients with acute pancreatitis is associated with pancreatic necrosis and usually has a benign course[J]. Clin Gastroenterol Hepatol,2014,12(5):854-862. [39] Petrov MS,Yadav D. Global epidemiology and holistic prevention of pancreatitis[J]. Nat Rev Gastroenterol Hepatol,2019,16(3):175-184. [40] Guda NM,Muddana V,Whitcomb DC,et al. Recurrent acute pancreatitis: international state-of-the-science conference with recommendations[J]. Pancreas,2018,47(6):653-666. [41] Yang AL,McNabb-Baltar J. Hypertriglyceridemia and acute pancreatitis[J]. Pancreatology,2020,20(5):795-800. [42] Dubina ED,de Virgilio C,Simms ER,et al. Association of early vs delayed cholecystectomy for mild gallstone pancreatitis with perioperative outcomes[J]. JAMA Surg,2018,153(11):1057-1059. [43] Smith RC,Smith SF,Wilson J,et al. Summary and recommendations from the Australasian guidelines for the management of pancreatic exocrine insufficiency[J]. Pancreatology,2016,16(2):164-180. [44] Hollemans RA,Hallensleben N,Mager DJ,et al. Pancreatic exocrine insufficiency following acute pancreatitis: Systematic review and study level meta-analysis[J]. Pancreatology,2018,18(3):253-262. [45] Das SL,Singh PP,Phillips AR,et al. Newly diagnosed diabetes mellitus after acute pancreatitis: a systematic review and meta-analysis[J]. Gut,2014,63(5):818-831. 版权声明 本文为《中国实用外科杂志》原创文章。其他媒体、网站、公众号等如需转载本文,请联系本刊编辑部获得授权,并在文题下醒目位置注明“原文刊发于《中国实用外科杂志》,卷(期):起止页码”。谢谢合作!返回搜狐,查看更多 责任编辑: |
【本文地址】