Nat Commun: SUMO化修饰组学揭示PIAS1新底物蛋白及调控细胞迁移机制 |
您所在的位置:网站首页 › VIM蛋白功能 › Nat Commun: SUMO化修饰组学揭示PIAS1新底物蛋白及调控细胞迁移机制 |
Nat Commun: SUMO化修饰组学揭示PIAS1新底物蛋白及调控细胞迁移机制
|
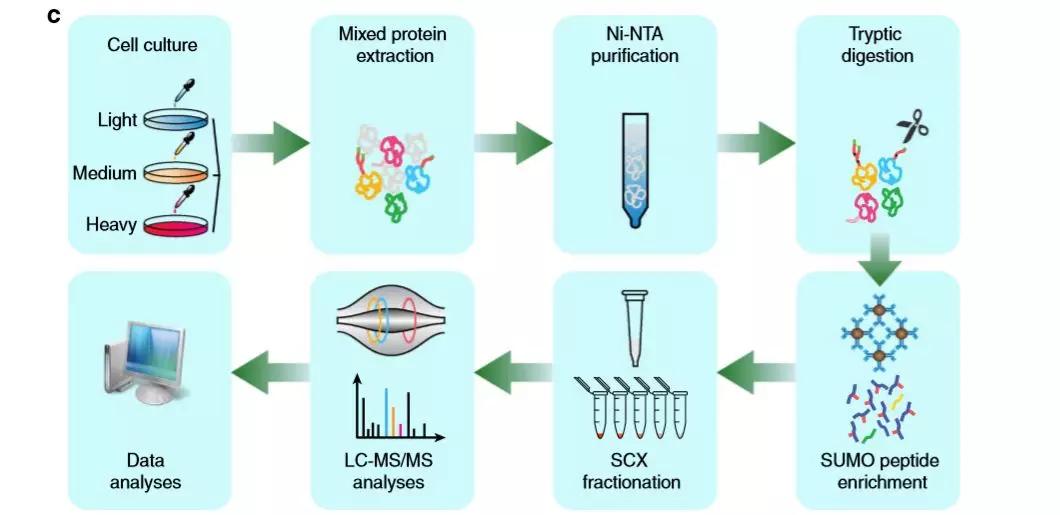
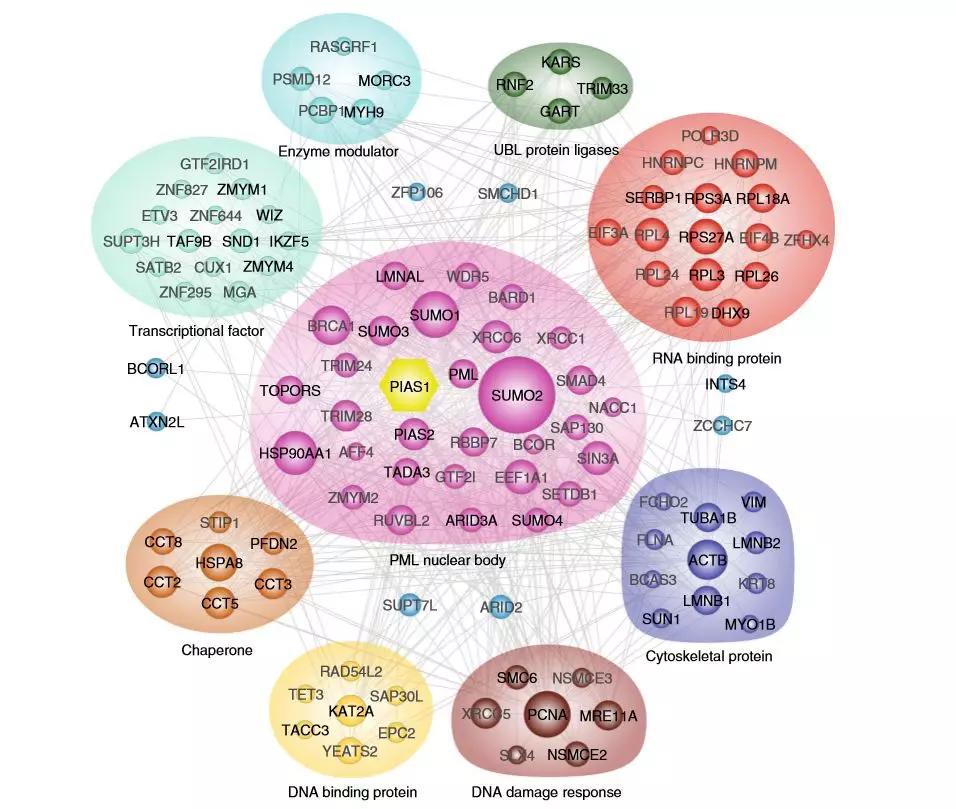
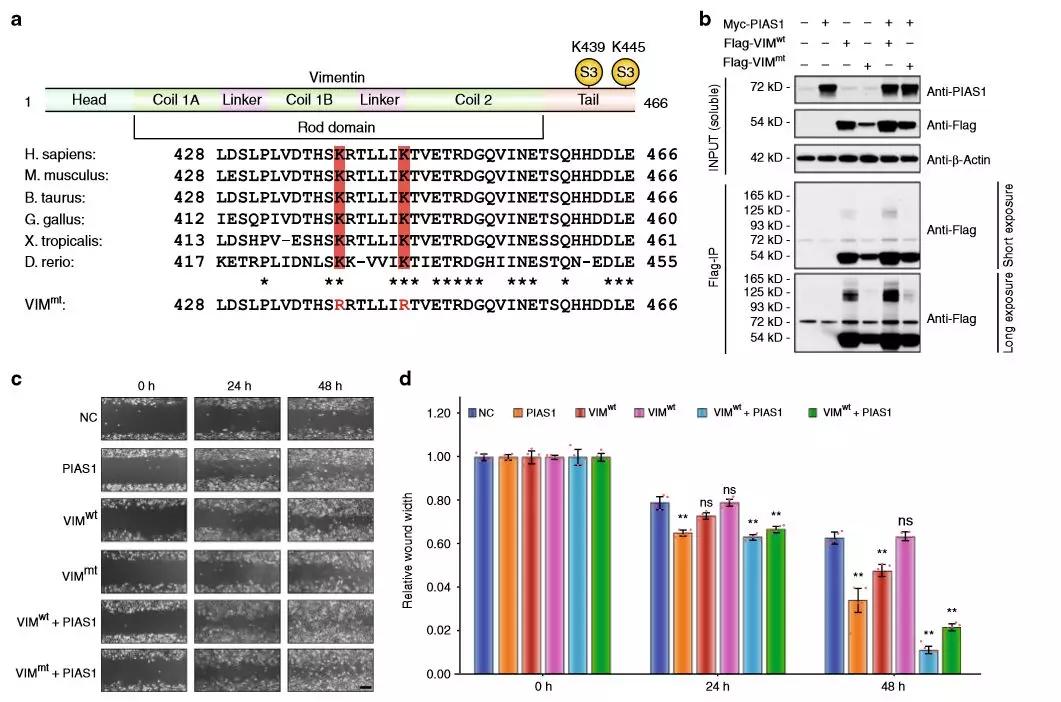
Figure 1. SUMO化定量蛋白质组学研究路线 2、PIAS1底物蛋白与功能分析 作者通过PANTHER和Gene Ontology (GO)功能分析,发现PIAS1调节多个蛋白质的SUMO化修饰,这些蛋白质在细胞中的作用是多种多样的。与整体SUMO化修饰一样,PIAS1介导的SUMO化可能在多个相互独立的生物过程中发挥作用。基于假定PIAS1底物的蛋白相互作用分析(STRING),证实PML核体、转录因子、细胞骨骼蛋白和RNA结合蛋白之间有着密切的相互作用,作者还发现多个假定的PIAS1底物与细胞骨骼组织相关,包括β-actin(ACTB)、α- tubulin(TUBA1B)和vimentin(VIM)。从组学数据来看,PIAS1在Lys-439和Lys-445中调节了III型IF VIM蛋白的SUMO化。 Figure 2. PIAS1底物蛋白互作分析 3、VIM的SUMO化调节其动态分解过程,有利于促进细胞迁移和活力 通过建立K439/445 R双突变体(Flag-VIMmt),研究人员证明PIAS1介导K439和K445的VIM的SUMO化;通过胶内酶解结合 LC-MS/MS技术,发现SUMO化和磷酸化之间可能存在串扰;同时利用伤口愈合测定法进行的生物学实验,综合表明VIM的SUMO化在细胞生长和迁移中发挥了作用,很大可能是通过调节VIF的功能或组成。 Figure 3. VIM的SUMO化是适当细胞迁移过程所需 作者将Flag-VIMwt和Flag-VIMmt转染到HeLa细胞中,并用RIPA裂解液裂化细胞。通过WB实验证实了前期推测,VIM 的 SUMO化确实大大增加了其溶解度。随后作者通过荧光显微镜量化了VIM 结构的比例,统计分析表明,与VIMwt相比, VIMmt促进了ULF(unit-length filament)的形成,波形蛋白中间丝(vimentin intermediate filament,VIF)形成也同时减少;进而作者结合蛋白、免疫荧光和FRAP测定的结构,描述了PIAS1介导VIM动力学控制的分子机制,揭示了PIAS1通过可逆的SUMO化修饰VIM进而刺激ULF的脱磷酸化,并促进ULF重新进入VIF成熟过程,从而调控细胞迁移和运动。 Figure 4. VIM的SUMO化调节其动态分解过程 值得注意的是,细胞骨骼蛋白在已识别的PIAS1底物中占有很大比例。不同于UBC9(E2-conjugating enzyme)底物通常在共有基序上进行SUMO化,在这些细胞骨架蛋白上发现的受体赖氨酸残基是高度保守的,但位于非共有序列基序中。这些观察结果表明,PIAS1可以作为一种适应蛋白,通过促进细胞骨骼蛋白的流动或动力学来改变细胞骨骼蛋白的更新或动态。 作者发现PIAS1在VIM蛋白的K439和K445残基上发生了SUMO化修饰,这种修饰提高了VIM的溶解度,并与磷依赖机制中ULF对VIF的吸收有关。VIM的SUMO化反过来有利于细胞增殖和活力,这可能导致癌细胞攻击性增加。当然,虽然这些发现可以揭示PIAS1介导的VIM SUMO化分子机制及其对癌细胞的侵袭性,但还需要更多的证据来进一步理解PIAS1介导的SUMO化在其他细胞骨骼蛋白上的功能以及这些细胞骨骼蛋白在细胞迁移过程中如何协同。 参考文献 Chongyang Li, et al., 2020, Quantitative SUMO proteomics identififies PIAS1 substrates involved in cell migration and motility. Nature Communications. 本文景杰学术团队原创,欢迎转发到朋友圈。如有转载、投稿、等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。返回搜狐,查看更多 |
【本文地址】