基于网络药理学及体外实验研究金莲花黄酮抑制肺纤维化的机制 |
您所在的位置:网站首页 › 黄酮的药理活性 › 基于网络药理学及体外实验研究金莲花黄酮抑制肺纤维化的机制 |
基于网络药理学及体外实验研究金莲花黄酮抑制肺纤维化的机制
|
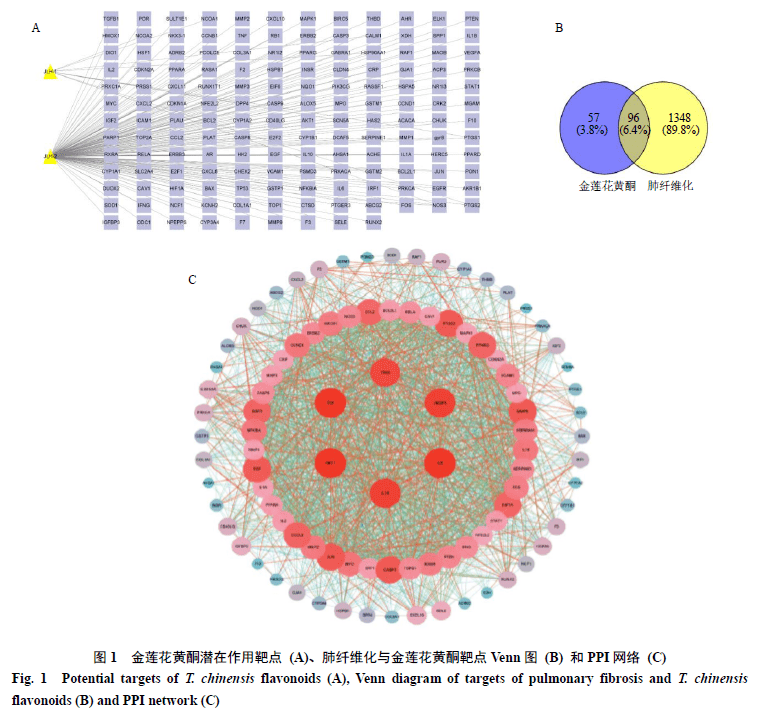
芦丁对照品(批号AF21020854)购自成都埃法生物科技有限公司;乙醇(批号YD20210421)购自天津市永大化学试剂有限公司;邻苯三酚(批号C10377201)、水杨酸(批号C10368917)、FeSO 4(批号C10293075)、H 2O 2(批号C10265196)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)购自上海麦克林生化有限公司;Tris-HCl缓冲液(批号20180807)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号20211111)、丙二醛(malonylialdehyde,MDA)检测试剂盒(批号20211117)、超氧化物阴离子荧光探针试剂盒(批号20220214)、CCK-8试剂(批号20210413)、胰蛋白 酶(批号20210623)、RIPA裂解液(批号20210521)购自北京索莱宝生物科技有限公司;转化生长因子-β1(transforming growth factor-β1,TGF-β1,批号100-21-10)购自Peprotech公司;E-cadherin抗体(批号18q6272,稀释比例1∶1000)、I型胶原蛋白(collagen-1)抗体(批号26u3150,稀释比例1∶1000)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(批号22p5934,稀释比例1∶1000)、波形蛋白Vimentin抗体(批号26t9913,稀释比例1∶1000)、核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)抗体(批号65m9929,稀释比例1∶1000)、Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)抗体(批号85d1712,稀释比例1∶1000)、血红素氧化酶-1(heme oxygenase-1,HO-1)抗体(批号80w1044,稀释比例1∶1000)、醌氧化还原酶-1(quinine oxidoreductase-1,NQO-1)抗体(批号85t0195,稀释比例1∶1000)、信号转导分子2/3(signal transduction molecule 2/3,Smad2/3)抗体(批号85v7735,稀释比例1∶1000)、p-Smad2/3抗体(批号88d5492,稀释比例1∶1000)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体(批号61b4725,稀释比例1∶1000)、蛋白激酶B(protein kinase B,Akt)抗体(批号34d5362,稀释比例1∶1000)、p-Akt抗体(批号20t9742,稀释比例1∶500)、β-actin抗体(批号12w2944,稀释比例1∶3000)、山羊抗兔IgG二抗(批号56j9958,稀释比例1∶5000)、山羊抗鼠IgG二抗(批号19z2345,稀释比例1∶5000)购自Affinity Biosciences公司;核因子-κB(nuclear factor-κB,NF-κB)抗体(批号20220210,稀释比例1∶500)购自武汉基因美生物科技有限公司。 1.4 仪器 Synergy HTX/SILFTA型全波长多功能酶标仪(伯腾仪器有限公司);Forma 3111型细胞培养箱(美国Thermo Fisher Scientific公司);荧光显微镜(日本Olympus公司);SW-CJ-2FD型超净作台(上海苏州安泰空气技术有限公司);Mini PROTEAN型蛋白电泳仪、Mini Trans-Blot蛋白转印系统、ChemiDoc超高灵敏度化学发光成像系统(美国Bio-Rad公司);ALK-R3000-S型数显圆周摇床(赛洛捷克有限公司);全自动高速冷冻离心机(美国Sigma公司);SHZ-88-1型台式水浴恒温震荡器(江苏太仓鹿河生化仪器厂)。 2 方法 2.1 网络药理学研究 2.1.1药物成分及靶点筛选通过TCMSP数据库(http://tcmspw.com)[9],以“金莲花”为关键词,以“口服生物利用度(oral bioavailability,OB)≥30%” “类药性(drug-likeness,DL)≥0.18”为筛选条件,获得活性成分和靶点信息,筛选其中黄酮的成分[10]。利用Uniprot数据库(https://www.uniprot.org/)进行蛋白名称和基因名称的转换[11]。 2.1.2金莲花黄酮“活性成分-靶点”网络的构建将筛选后的金莲花成分进行筛选,提取黄酮成分,分别将2个金莲花黄酮成分标记为玄参黄酮和五羟黄酮,分别将2个黄酮各自对应的靶点进行汇总。随后,使用Cytoscape 3.9.1软件构建金莲花黄酮“活性成分-靶点”网络,进行可视化[12]。 2.1.3肺纤维化疾病靶点获取借助GeneCards和Drugbank数据库,以“pulmonary fibrosis”为关键词,筛选相关基因[13]。将各数据库筛选后的基因对应的靶点进行汇总、整体后与药物靶点合并,筛选重复靶点。 2.1.4蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建及分析运用Venny插件,获取金莲花黄酮的药物靶点和肺纤维化靶点的PPI信息,并获取其共有靶点。将共有靶点导入Cytoscape 3.9.1软件进行可视化分析,并对共有靶点进行相关性分析,得到核心靶点[13]。 2.1.5基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析运用Metascape进行GO功能分析和KEGG信号通路富集分析,GO功能分析包括生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组成(cellular component,CC)。 2.2 金莲花黄酮提取及含量测定 取干燥金莲花粉碎,过筛,称取100 g,加入10倍量的70%乙醇溶液,加热回流提取2 h,滤过后取滤液,减压浓缩,得粗黄酮。按1∶4的料液比加入95%乙醇沉淀,取滤液浓缩,冷冻干燥,得金莲花黄酮提取物[14]。以芦丁为对照品,分光光度法测定金莲花提取液中的总黄酮含量[15],计算提取率。 2.3金莲花黄酮体外抗氧化活性测试 2.3.1超氧阴离子自由基清除能力测定采用邻苯三酚比色法测定金莲花黄酮的超氧阴离子自由基清除能力。向各试管中加入0.1 mol/L的Tris-HCl缓冲液4.5 mL,后分别加入质量浓度为10、20、50、100、250、500、1000 μg/mL的金莲花黄酮溶液各1 mL,加入蒸馏水2.4 mL,摇匀后室温静置3 min后加入10 mmol/L的邻苯三酚溶液0.1 mL终止反应,蒸馏水调零,在325 nm下测定其吸光度(A)值[16],计算超氧阴离子自由基清除率。 超氧阴离子自由基清除率=1-Ai/( A j -A0) A0为水代替黄酮时测得的A值,Ai为不同质量浓度待测样品测得的A值,Aj为水代替邻苯三酚时不同质量浓度待测样品测得的本底A值 2.3.2羟基自由基清除率测定采用FeSO 4- 水杨酸法测定羟基自由基清除率。配制6 mmol/L乙醇-水杨酸溶液、6 mmol/L FeSO 4、8.8 mmol/L H 2O 2,在比色管中依次加入1 mL 6 mmol/L FeSO 4、1 mL蒸馏水或样品溶液(10、20、50、100、250、500、1000 μg/mL),1 mL 6 mmol/L H 2O 2,混匀后室温放置10 min,后加入6 mmol/L乙醇-水杨酸,摇匀,37 ℃水浴加热15 min后取出,蒸馏水为参比溶液调零后,于510 nm处测定其A值[16]。 羟基自由基清除率=1-( A x -Ax0)/ A 0 A0为FeSO 4+蒸馏水+H 2O 2+水杨酸测得的A值,Ax为FeSO 4+样品+H 2O 2+水杨酸测得的A值,Ax0为FeSO 4 +样品+蒸馏水+水杨酸测得的A值 2.3.3DPPH 自由基清除能力测定采用DPPH-乙醇法测定金莲花黄酮的DPPH自由基清除能力[16]。依次向试管中加入不同质量浓度(10、20、50、100、250、500、1000 μg/mL)样品溶液0.500 mL,DPPH溶液3 mL,摇匀后室温静置30 min,用蒸馏水调零,测定其在517 nm处的A值。 DPPH自由基清除率=1-Ai/ A 0 A0为蒸馏水,Ai为样品 2.4 体外细胞实验 2.4.1细胞毒性测试A549 细胞用含10%胎牛血清的F12K培养基,于37 ℃、5% CO 2培养箱中培养,待细胞融合度达到80%~90%时进行传代培养。将A549细胞以2000个/孔接种于96孔板中,设置6个复孔,培养24 h,待其生长密度约为80%时,加入不同质量浓度(100、200、400、600、800 μg/mL)黄酮培养24 h后,加入CCK-8溶液,于恒温箱孵育1 h后用酶标仪测定450 nm处的A值[17]。 2.4.2细胞实验浓度筛选将A549细胞以每孔2000个接种于96孔板中,设置6个复孔,培养24 h,待其生长密度约为80%时,分别加入10 ng/mL TGF-β1及不同质量浓度(100、200、400、600、800 μg/mL)黄酮,培养24 h后加CCK-8溶液,于恒温箱中孵育1 h后用酶标仪测定450 nm处的A值[18]。 2.4.3实验分组A549 细胞以1×10 6个/孔接种于6孔板,培养24 h,设置对照组(含有细胞培养液)、模型组(含有10 ng/mL TGF-β的细胞培养液)和不同质量浓度(200、400、600 μg/mL)金莲花黄酮组(含10 ng/mL TGF-β和不同质量浓度药物的细胞培养液)。 2.4.4上皮间充质转化标志物表达收集细胞,加入RIPA裂解液提取蛋白,冰上裂解30 min后,4 ℃、12 000×g离心10 min,取上清。使用BCA蛋白浓度测定试剂盒测定蛋白浓度后,加入上样缓冲液,100 ℃煮沸10 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭2 h后,分别加入E-cadherin、collagen-1、α-SMA、Vimentin和β-actin抗体,4 ℃孵育过夜;洗涤后加入二抗,室温孵育1 h,加入ECL发光液显影,用Image J软件分析条带灰度值[19-20]。 2.4.5抗氧化因子表达收集细胞,按照试剂盒说明书测定SOD活性及MDA含量,观察各组氧化应激表达水平[20];按照DHE试剂盒说明书,通过流式细胞仪检测各组细胞中活性氧(reactive oxygen species,ROS)水平,评价氧化应激表达水平[21];通过Western blotting检测氧化应激因子Nrf2、Keap1、HO-1、NQO-1蛋白表达。 2.4.6网络药理学潜在靶点检测收集细胞,提取蛋白后,通过Western blotting检测mTOR、Smad2/3、p-Smad2/3、NF-κB蛋白表达。 2.4.7统计学分析数据使用Graphpad Prism 8.0软件处理,采用单因素方差分析进行组间统计。 3 结果 3.1 网络药理学分析 通过网络药理学分析发现金莲花中具有可成药的黄酮主要为玄参黄酮(JLH-1)和五羟黄酮(JLH-2),其潜在作用靶点为143个(图1-A)。通过GeneCards和Drug bank数据库收集肺纤维化潜在作用靶点1444个,药物靶点与疾病靶点进行合集分析,二者共同靶点为96个(图1-B)。PPI网络的构建及分析发现其潜在靶点为蛋白激酶B1(protein kinase B1,AKT1)、肿瘤坏死因子(tumor necrosis factor,TNF)、肿瘤抑制蛋白(tumor protein p53,TP53)、血管内皮细胞生长因子受体A(vascular endothelial growth factor receptor A,VEGFA)、白细胞介素-6(interleukin-6,IL-6)、IL-1B( 图1-C)。
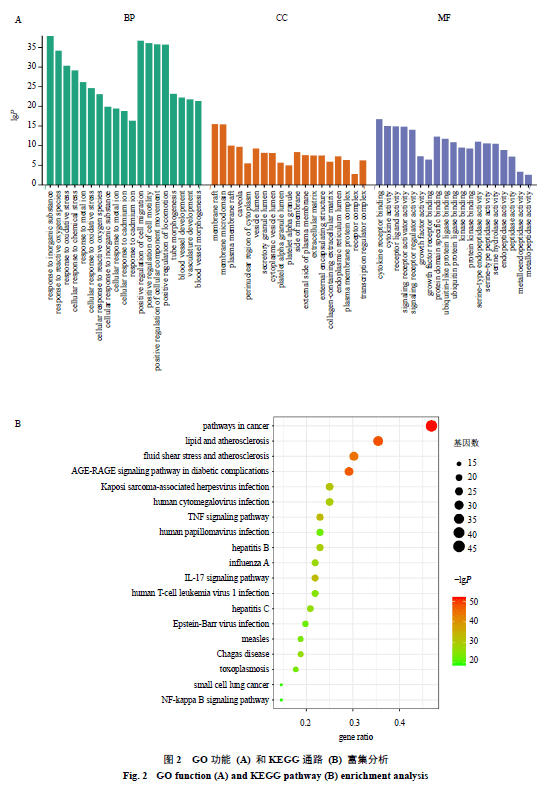
运用Metascape进行BP、MF、CC富集分析,发现潜在作用靶点主要BP集中在无机物应激反应、氧化应激、活性氧等,MF主要集中在细胞因子及其受体(图2-A)。KEGG富集分析发现主要集中在癌症、脂质和动脉粥样硬化(图2-B)。
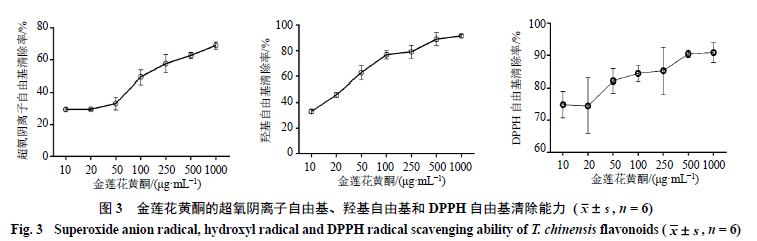
3.2 金莲花黄酮体外抗氧化活性 金莲花通过60%乙醇提取后,混有一定量多糖,后经乙醇沉淀,除去多糖,纯化后冻干,3批次金莲花黄酮提取率分别为68.44%、71.24%、71.33%。体外抗氧化活性测试结果(图3)显示,随着金莲花黄酮质量浓度的升高,其抗氧化能力逐渐增强。当质量浓度超过500 μg/mL时,其超氧阴离子自由基清除率达到60%以上,羟基自由基清除率超过80%,而DPPH自由基清除率超过90%,表现出良好的抗氧化活性。
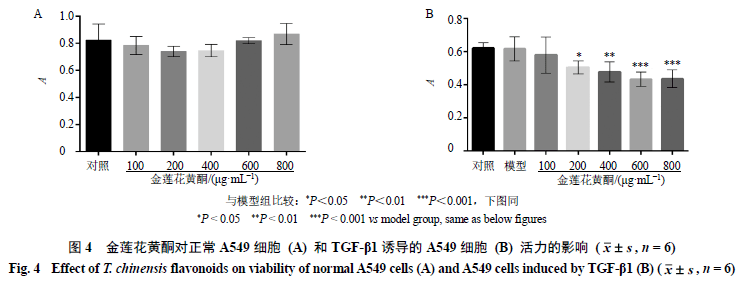
3.3 细胞毒性及药物剂量筛选 将金莲花黄酮作用于A549细胞,通过CCK-8法测试其活力,如图4所示,100~800 μg/mL金莲花黄酮对A549细胞活性无明显影响,说明在此质量浓度范围内并未表现出毒性作用。A549细胞经过TGF-β1诱导后,给予不同质量浓度金莲花黄酮进行干预,发现200~800 μg/mL金莲花黄酮显著抑制A549细胞活性(P<0.05、0.01、0.001),而600、800 μg/mL作用强度相近,选择200、400、600 μg/mL作为金莲花黄酮后续实验剂量。
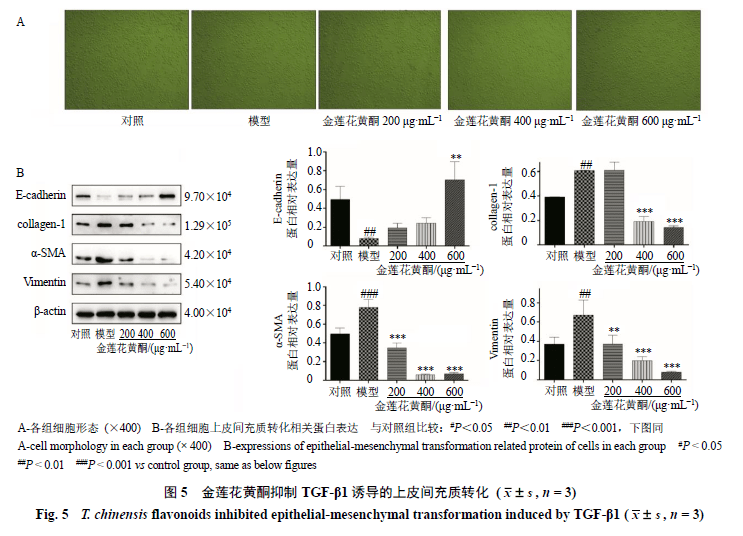
3.4金莲花黄酮抑制TGF-β1诱导的上皮间充质转化 如图5-A所示,TGF-β1诱导后A549细胞发生明显的转分化,与对照组比较,模型组细胞形态呈现纺锤状,而金莲花干预后细胞状态更加偏向于对照组,且出现剂量相关性,600 μg/mL金莲花黄酮作用效果优于200、400 μg/mL组。通过Western blotting检测细胞中上皮间充质转化标志物蛋白表达,如图5-B所示,与对照组比较,模型组E-cadherin蛋白表达水平显著降低(P<0.01),collagen-1、α-SMA、Vimentin蛋白表达水平均显著升高(P<0.01、0.001);与模型组比较,600 μg/mL金莲花黄酮组E-cadherin蛋白表达水平显著升高(P<0.01),400、600 μg/mL金莲花黄酮组collagen-1蛋白表达水平显著降低(P<0.001),金莲花黄酮各剂量组α-SMA、Vimentin蛋白表达水平均显著降低(P<0.01、0.001)。
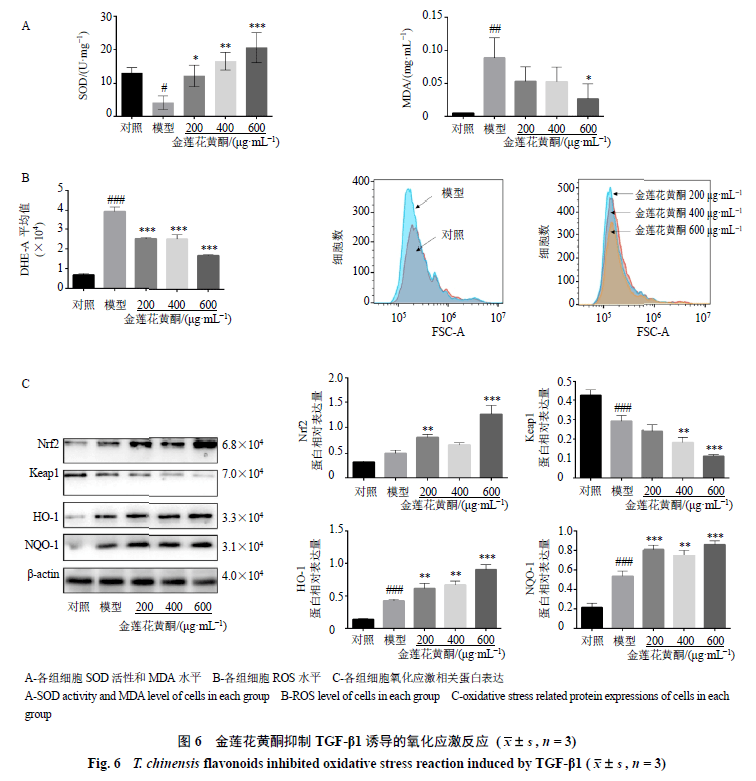
3.5 金莲花黄酮抑制TGF-β1诱导的氧化应激反应 如图6-A所示,与对照组比较,模型组细胞中SOD活性明显降低(P<0.05),MDA水平明显升高(P<0.01);与模型组比较,金莲花黄酮各剂量组SOD活性明显升高(P<0.05、0.01、0.001),600 μg/mL金莲花黄酮组MDA水平明显降低(P<0.05),表明金莲花黄酮可以明显改善TGF-β1诱导的氧化应激。ROS检测结果(图6-B)也证实了这一结果,模型组ROS信号强度明显增强(P<0.001),各给药组ROS信号强度组明显减弱(P<0.001)。Western blotting检测氧化应激相关蛋白表达,如图6-C所示,与对照组比较,模型组Keap1蛋白表达水平显著降低(P<0.001),Nrf2蛋白表达水平升高,受Nrf2调控的HO-1和NQO-1蛋白表达水平均显著升高(P<0.001);与模型组比较,400、600 μg/mL金莲花黄酮组Keap1蛋白表达水平进一步显著降低(P<0.01、0.001),200、600 μg/mL金莲花黄酮组Nrf2蛋白表达水平均进一步显著升高(P<0.01、0.001),各给药组HO-1和NQO-1蛋白表达水平均进一步显著升高(P<0.01、0.001)。
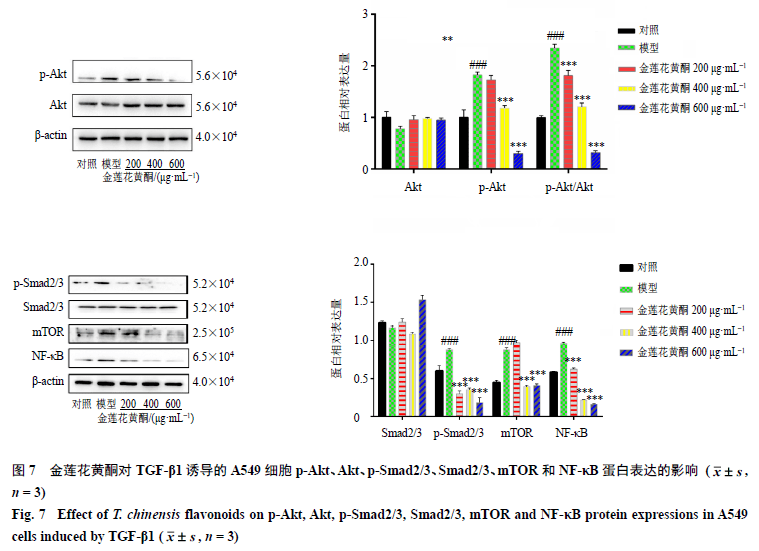
3.6 结合网络药理学检测潜在作用靶点 结合网络药理学靶点预测,随后对Akt及p-Akt进行检测(图7)发现,与对照组比较,模型组p-Akt蛋白表达水平显著升高(P<0.001),说明Akt被激活,金莲花黄酮则可以抑制其激活(P<0.001)。随后在对纤维化经典信号通路进行检测时发现,模型组p-Smad2/3、mTOR及NF-κB同样被激活(P<0.001),金莲花黄酮可以抑制p-Smad2/3、mTOR及NF-κB激活(P<0.001)。
4 讨论 在正常情况下,Nrf2位于胞质中,与其特异性抑制性受体Keap1结合,无活性且Keap1可促进Nrf2的泛素化降解过程,因此Nrf2表达较低[22]。但在氧化应激作用下,Nrf2与Keap1发生解偶联,转移入核,通过与小分子肌腱纤维瘤蛋白异二聚体化,从而启动,调控NQO1、HO-1等抗氧化酶基因的表达[23]。Nrf2/Keap1信号通路对肺纤维化的影响越来越受到关注,研究表明,Nrf2/Keap1信号通路上调HO-1、NQO1等抗氧化物的表达,调控体内氧化应激水平,降低肺纤维化作用进程,减少胶原的合成,保护肺部组织,提高细胞抗性,抑制成纤维细胞转分化为肌成纤维细胞[24-25]。 此外,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt信号通路被证实直接参与II型肺泡上皮细胞的上皮间充质转化发生,促进肺纤维化发展[26]。PI3K/Akt信号通路能使受体酪氨酸激酶活化,从而使细胞质上的PI3K易位至细胞膜,通过调控下游mTOR及ROS等参与肺纤维化[27-28]。此外,PI3K/Akt信号通路激活与NF-κB信号通路密切相关[29]。NF-κB在肺纤维化早期的高表达与PI3K/Akt信号通路激活相关,Akt能通过磷酸化激活NF-κB抑制因子(inhibitor of NF-κB,IκB)激酶,导致IκB与NF-κB分离,激活NF-κB信号通路,诱导目的基因表达,产生炎症反应,加重肺纤维化的进程[30]。 本研究首先借助网络药理学,分析金莲花黄酮与肺纤维化的潜在靶点,通过分析筛选出金莲花黄酮作用肺纤维化的作用靶点,与此同时,KEGG分析显示金莲花黄酮作用肺纤维化最有可能的潜在作用机制为氧化应激,潜在作用靶点为AKT1、TNF、TP53、VEGFA、IL-6、IL-1B。随后,本研究结合体外细胞模型进行验证。实验结果显示,金莲花黄酮在体外具有良好的抗氧化作用,作用细胞有效质量浓度为200、400、600 μg/mL,而且显示出质量浓度相关性,且不存在细胞毒性。金莲花黄酮可以有效抑制TGF-β1诱导后上皮间充质转化标志物的表达。氧化应激检测也证实了金莲花黄酮具有良好的抗氧化作用,金莲花黄酮能够增强SOD活性,降低MDA水平,流式细胞仪检测ROS表达结果发现,当细胞出现上皮间充质转化时,ROS表达明显增强,而金莲花黄酮可以有效降低ROS表达,说明金莲花黄酮可以降低细胞内氧化应激水平。 在对氧化应激经典通路Keap1/Nrf-2信号通路检测时发现,当细胞出现上皮间充质转化时,二者进行解离,Keap1表达逐渐降低,Nrf2逐渐增强,受Nrf2调控的HO-1与NQO-1表达也出现差异性变化,说明金莲花黄酮可以作用Keap1/Nrf2信号通路,发挥抗氧化作用,进而抑制上皮间充质转化,这与网络药理学预测潜在作用机制相对应。随后,在对潜在作用靶点进行检测时发现Akt-1表现出明显的差异性。而PI3K/Akt/mTOR信号通路与肺纤维化的发生与发展息息相关,随后对mTOR的检测结果也证实了推测。 本研究结果证明金莲花黄酮具有良好的抗氧化活性,并且对于TGF-β1诱导的A549细胞上皮间充质转化具有明显的抑制作用,其作用机制及作用靶点通过网络药理学进行验证,检测结果也验证了网络药理学的分析结果。基于这一发现,在后期的实验设计中将重点探索金莲花黄酮在动物体内抑制肺纤维化的药效作用以及其潜在作用机制。本研究不仅为网络药理学在中药防治肺纤维化研究中的必要性提供有力的证据,也为金莲花黄酮开发提供了基础数据,与现代实验手段相结合,丰富了中药在临床上的应用可能性。 利益冲突所有作者均声明不存在利益冲突 参考文献(略) 来 源:王家才,段星星,张 波,辛 杰,陈虞超,郭生虎,李新朋,王 振.基于网络药理学及体外实验研究金莲花黄酮抑制肺纤维化的机制 [J]. 中草药, 2023, 54(7):2144-2154.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |