一种高尿酸血症细胞模型及其构建方法与在降尿酸功效评价方面的应用与流程 |
您所在的位置:网站首页 › 高尿酸血症模型小鼠 › 一种高尿酸血症细胞模型及其构建方法与在降尿酸功效评价方面的应用与流程 |
一种高尿酸血症细胞模型及其构建方法与在降尿酸功效评价方面的应用与流程
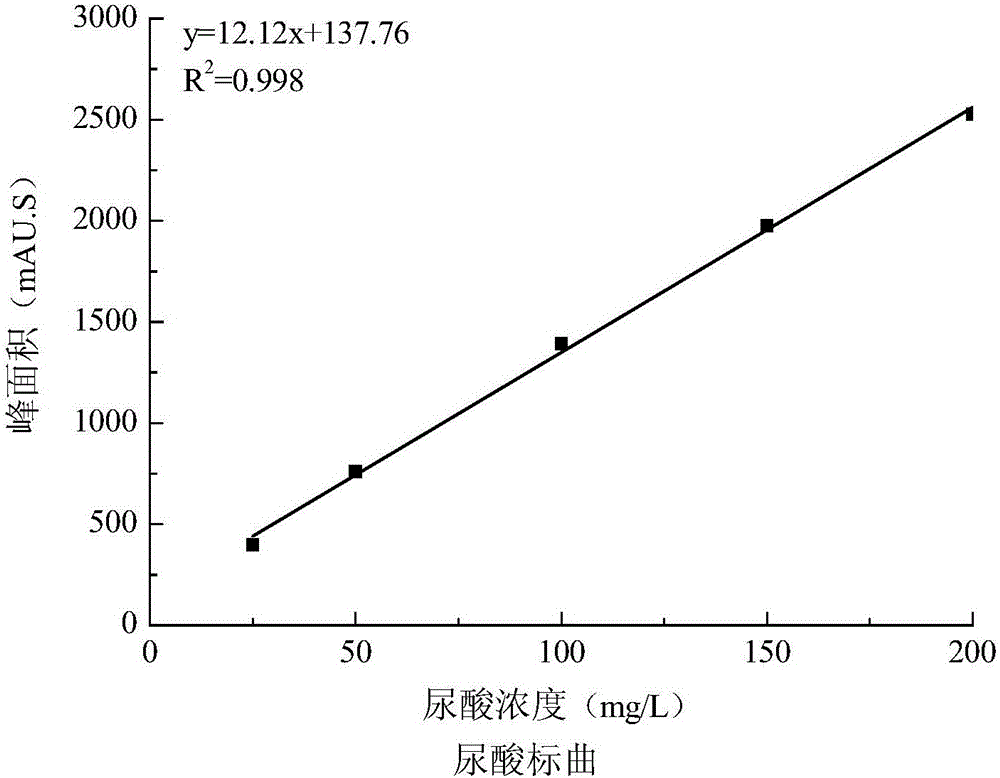 本发明属于细胞模型构造技术领域,具体涉及高尿酸血症细胞模型的构建方法及其在降尿酸功效评价方面的应用。 背景技术: 高尿酸血症是由于嘌呤代谢紊乱和/或尿酸排泄减少所引起的代谢性疾病,以血尿酸升高为主要特征,是痛风、肾结石等病症的重要生化基础。近年来,高尿酸血症和痛风的患病率越来越高,并且高尿酸血症作为诸多代谢紊乱因素之一,常与高血压、糖尿病、肥胖、动脉粥样硬化等疾病的发展密切相关,是威胁人类的重要疾病。 目前治疗高尿酸血症的药物根据作用机制不同可分为:抑制尿酸生成的药物;促进尿酸排泄的药物;促进尿酸分解的药物。常见的有别嘌呤醇、非布索坦、丙磺舒、苯溴马隆等。但这些药物大多副作用明显,对肝功能、肾功能及心肌功能造成一定的损伤,患者易出现不良反应。因此,寻找到副作用小、安全经济的降尿酸药物十分必要和迫切,而确立一种高效筛选药物的高尿酸血症模型显得尤为重要。 目前,降尿酸药物的筛选可通过建立高尿酸血症动物模型进行体内筛选,或直接在体外筛选黄嘌呤氧化酶抑制剂。黄嘌呤氧化酶可以催化次黄嘌呤和黄嘌呤氧化生成尿酸,因此抑制黄嘌呤氧化酶的活性可达到降尿酸的效果。测定黄嘌呤氧化酶活性较为常用的方法是紫外分光光度法,黛立珍和赵庆娅分别在研究中草药、叉枝藻和海带提取物对黄嘌呤氧化酶的抑制中就采用了该方法测酶活。在黄嘌呤氧化酶的催化下,底物黄嘌呤被氧化成尿酸,在此反应中,尿酸的生成量和黄嘌呤氧化酶的活力成正比,因此可通过测定体系中尿酸的生成量来反应酶活的大小。尿酸在290 nm处有特征吸收峰,可采用分光光度法测定单位时间内尿酸量的变化,从而计算出酶活。(戴立珍,武汉工程大学硕士学位论文,2010)(赵庆娅,中国海洋大学硕士学位论文,2013)。李忠琴等采用辣根过氧化物酶分光光度法测定黄嘌呤氧化酶活性,其原理为:黄嘌呤氧化酶在催化黄嘌呤氧化的反应过程中,每氧化1 mol黄嘌呤,将消耗1 mol分子氧和水,产生1 mol尿酸和1mol H2O2。H2O2再经过氧化物酶作用分解,可使4-氨基安替比林(AAP)与苯酚(PA)形成呈红色的亚醌类化合物(chromogen),在可见光范围内测定该显色化合物的吸光度,即可推算出黄嘌呤氧化酶的酶活(分析化学研究简报, 2006, 6:821-824)。李忠琴等也报道了采用平板扩散法测定黄嘌呤氧化酶的活性,主要步骤是在三角瓶中加入Tris-HCl缓冲溶液、琼脂粉和黄嘌呤溶液作为底物,加热溶解后与显色液混合,混匀制成琼脂平板。打孔,用烧烫的接种针熨润孔壁,在酒精灯上烘烤平皿背面,使琼脂与平皿底部贴紧。将制备的酶液样品定量滴加至琼脂平板的孔中,置于37 ºC恒温培养箱中反应,每隔10 min观察孔周围显色圈的大小和颜色深浅变化情况。研究发现通过该方法测得的显色圈的直径与辣根过氧化物酶分光光度法测得的酶活力之间有良好的线性关系,因此可通过测量显色圈的直径估算样品的酶活力(吉林大学学报,2011,49(3):544-547)。此外,也有采用反相高效液相色谱法测定黄嘌呤氧化酶的活性。其方法是将酶初提液与含有黄嘌呤的反应体系在37ºC下反应20 min,反应终止后通过HPLC 测定产物尿酸生成量的变化来分析酶的活性。检测波长为290 nm(分析化学研究简报, 2007, 26(8): 41-44)。 高尿酸血症动物模型的造模方法主要有三种,一是直接摄入尿酸、高嘌呤食物或尿酸前体物质,促进尿酸的生成,形成高尿酸血症模型。陶兆燕等研究吴茱萸碱对高尿酸血症动物模型的影响中将大鼠灌胃次黄嘌呤,再皮下注射氧嗪酸钾盐可致尿酸增高模型(成都中医药大学学报,2014,37(1):32-34)。二是通过给药抑制尿酸排泄,增加血尿酸浓度,形成高尿酸血症,常用的药物为腺嘌呤、烟酸等。王宗涛等在高尿酸血症大鼠模型的实验研究中以含腺嘌呤的饲料诱导大鼠,获得持续性高尿酸血症(中华内分泌代谢杂志,2004,20(5):474-475)。三是抑制尿酸酶的活性,常用的尿酸酶抑制剂为氧氰酸。牛艳芬等在研究芒果苷对氧嗪酸钾所致慢性高尿酸血症大鼠尿酸及肝肾功能的影响中以2.5 g/kg体重的氧嗪酸钾灌胃大鼠,可获得慢性高尿酸血症模型(中国药理学通报,2012,28(11):1578-1581)。目前大多数高尿酸血症模型多以两种或三种造模物质同时作用,获得稳定持久的高尿酸血症模型。 选用人肾小管上皮细胞为造模细胞,以腺苷为造模药物,构建高尿酸血症细胞模型,用于评价药物的降尿酸效果,操作简单,耗时短,可用于药物的大批量筛选。 在本申请提出之前,尚未见有利用细胞建立高尿酸血症模型的报道。 技术实现要素: 本发明的首要目的是针对高尿酸血症动物模型筛选药物实验繁琐,周期长等问题,提出构建一种高尿酸血症细胞模型的方法,用以代替动物模型进行药物的高效筛选。 本发明所提供的一种高尿酸血症细胞模型的构建方法,具体包括如下步骤: (1)选取人肾小管上皮细胞(HK-2细胞)为造模细胞,用培养基进行培养; (2)将处于对数生长期的人肾小管上皮细胞消化,制成细胞悬液,血球计数板计数后,调整细胞密度,接种于孔板中,置于细胞培养箱培养; (3)培养12-36 h后,弃去细胞上清液,清洗,加入腺苷进行孵育; (4)腺苷孵育12-36 h后,加入黄嘌呤氧化酶,继续孵育12-36 h后,获得高尿酸血症细胞模型;取出细胞上清液,高效液相分析细胞上清液中的尿酸含量。 进一步地,步骤(2)中所述消化是指在弃去培养液后的培养基中,加入胰蛋白酶,降解细胞间蛋白后弃去胰蛋白酶;所述制成细胞悬液是指用吸管吹打制成细胞悬液。 进一步地,步骤(2)中所述调整细胞密度为105-106个/mL。 进一步地,步骤(3)中所述清洗是指用聚丁二酸丁二醇酯清洗2-3次。 进一步地,步骤(3)中所述腺苷为诱导物质,腺苷用量为0.25-1 mmol/L,优选为0.75 mmol/L。 进一步地,步骤(4)中加入黄嘌呤氧化酶为每孔加入0.1-0.3 IU黄嘌呤氧化酶,优选为每孔加入0.2 IU黄嘌呤氧化酶。 由上述任一项所述制备方法制得的高尿酸血症细胞模型。 制得的高尿酸血症细胞模型在降尿酸功效评价方面的应用。 与现有技术相比,本发明具有如下优点和技术效果: 本发明首次建立了高尿酸血症细胞模型,该模型可用于高效筛选降尿酸的药物,相对于动物模型周期短,操作简单。 附图说明 图1为六种标准品高效液相色谱图; 图2 为尿酸标准曲线; 图3为实施例1中空白对照组和模型组细胞上清液高效液相图; 图4为不同实施例组尿酸含量图; 图5a为实施例5中高尿酸血症细胞模型组的高效液相图; 图5b为实施例5中阳性对照组中别嘌呤醇组的高效液相图; 图5c为实施例5中阳性对照组中丙磺舒组的高效液相图; 图5d为实施例5中阳性对照组中非布索坦组的高效液相图; 图6为实施例5中高尿酸血症细胞模型组和阳性对照组尿酸含量图。 具体实施方式 实验细胞:人肾小管上皮细胞HK-2,购自无锡菩禾生物医药技术有限公司。 实验试剂:培养基RMPI1640、链霉素和青霉素、胰酶购自美国Gibco公司;胎牛血清购自浙江天杭生物科技有限公司;腺苷购自广州硕恒生物科技有限公司;别嘌呤醇购自国药集团化学试剂有限公司;丙磺舒购自上海源叶生物科技有限公司;非布索坦购自江苏万邦生化医药股份有限公司;黄嘌呤氧化酶购自美国Sigma公司。 造模细胞的培养:人肾小管上皮细胞HK-2用RPMI1640进行培养,并加入10 wt%的胎牛血清,1 wt %双抗(链霉素和青霉素),放入37 °C、5%(V/V)CO2培养箱中静置培养。 图1为六种标准品高效液相图,由图可知尿酸出峰时间为4.8 min左右;图2为尿酸标准曲线,可根据标准曲线方程对细胞上清液中生成的尿酸定量。 实施例1 一种高尿酸血症细胞模型的构建:实验设空白对照组和模型组。 模型组:取对数生长期的HK-2细胞,加入胰酶消化,用吸管吹打制成悬液,通过稀释将细胞浓度调整为105个/mL,接种于12孔板中,置于细胞培养箱中培养12 h,弃去细胞上清液,PBS清洗2次,加入用量为0.25 mmol/L的腺苷孵育12 h后,每孔加入0.1 IU黄嘌呤氧化酶,继续孵育12 h后,得到高尿酸血症细胞模型; 空白对照组:不加腺苷诱导物,其余条件和模型组一样。 取出细胞上清液,HPLC分析细胞上清液,高效液相色谱图和尿酸含量图分别如图3和图4所示。由图3可知空白对照组基本无尿酸生成,模型组生成尿酸。 实施例2 一种高尿酸血症细胞模型的构建: 取对数生长期的HK-2细胞,加入胰酶消化,用吸管吹打制成悬液,通过稀释将细胞浓度调整为3×105个/mL,接种于12孔板中,置于细胞培养箱中培养12 h,弃去细胞上清液,PBS清洗2次,加入用量为0.5 mmol/L的腺苷孵育12 h后,每孔加入0.1 IU黄嘌呤氧化酶,继续孵育12 h后,得到高尿酸血症细胞模型;取出细胞上清液,HPLC分析细胞上清液中尿酸含量,结果如图4所示。 实施例3 一种高尿酸血症细胞模型的构建: 取对数生长期的HK-2细胞,加入胰酶消化,用吸管吹打制成悬液,通过稀释将细胞浓度调整为3×105个/mL,接种于12孔板中,置于细胞培养箱中培养24 h,弃去细胞上清液,PBS清洗3次,加入用量为0.5 mmol/L的腺苷孵育24 h后,每孔加入0.2 IU黄嘌呤氧化酶,继续孵育24 h后,得到高尿酸血症细胞模型;取出细胞上清液,HPLC分析细胞上清液尿酸含量,结果如图4所示。 实施例4 一种高尿酸血症细胞模型的构建: 取对数生长期的HK-2细胞,加入胰酶消化,用吸管吹打制成悬液,通过稀释将细胞浓度调整为106个/mL,接种于12孔板中,置于细胞培养箱中培养24 h,弃去细胞上清液,PBS清洗3次,加入用量为0.75 mmol/L的腺苷孵育36 h后,每孔加入0.2 IU黄嘌呤氧化酶,继续孵育36 h后,得到高尿酸血症细胞模型;取出细胞上清液,HPLC分析细胞上清液尿酸含量,结果如图4所示。 实施例5 一种高尿酸血症细胞模型的构建: 取对数生长期的HK-2细胞,加入胰酶消化,用吸管吹打制成悬液,通过稀释将细胞浓度调整为106个/mL,接种于12孔板中,置于细胞培养箱中培养36 h,弃去细胞上清液,PBS清洗3次,加入用量为1 mmol/L的腺苷孵育36 h后,每孔加入0.3 IU黄嘌呤氧化酶,继续孵育36 h后,得到高尿酸血症细胞模型;取出细胞上清液,HPLC分析细胞上清液尿酸含量,结果如图4所示。 从图4可知,模型组均有尿酸生成。由实施例1和实施例2可知,随着诱导物腺苷浓度和细胞密度的增加,尿酸生成含量显著增加。细胞密度增加,产生的腺苷代谢相关的酶增加,因而一段时间内生成的尿酸含量增加。由实施例2和实施例3可知,随着细胞铺板时间,诱导物孵育时间及加入黄嘌呤氧化酶后孵育时间的延长,尿酸生成量显著增加。由实施例4和实施例5可知,当细胞密度较大,诱导物腺苷达到一定浓度后,继续增加腺苷的浓度,尿酸生成量虽然增多,但无显著性差异。 实施例6 实验设为空白对照组,模型组,阳性对照组。 模型组:取对数生长期的HK-2细胞,加入胰酶消化,用吸管吹打制成悬液,通过稀释将细胞浓度调整为106个/mL,接种于12孔板中,置于细胞培养箱中培养24 h后;弃去上清液,PBS清洗3次,加入用量为0.75 mmol/L的腺苷孵育36 h后,每孔加入0.2 IU黄嘌呤氧化酶,继续培养36 h,得到高尿酸血症细胞模型; 阳性对照组:置于细胞培养箱中培养24 h后,阳性对照组分别加入20 μmol/L别嘌呤醇、20 μmol/L丙磺舒和20 μmol/L非布索坦,其余条件与模型组一样; 空白对照组:不加腺苷诱导物,其余条件和模型组一样。 取出细胞上清液,高效液相分析,结果如图5a、图5b、图5c和图5d所示,尿酸含量如图6所示;空白对照组尿酸含量结果参照图3,基本不产生尿酸。 结果表明,阳性药物组尿酸含量均显著低于模型组,且在相同浓度下非布索坦降尿酸效果最好。由结果可知高尿酸血症细胞模型造模成功,具有降尿酸功效评价的效果,可应用于筛选降尿酸药物。 |
【本文地址】