高中化学钠、铝、铁及化合物思维导图+方程式总结! |
您所在的位置:网站首页 › 高一化学钠的离子方程式 › 高中化学钠、铝、铁及化合物思维导图+方程式总结! |
高中化学钠、铝、铁及化合物思维导图+方程式总结!
|
附:钠及其化合物思维导图
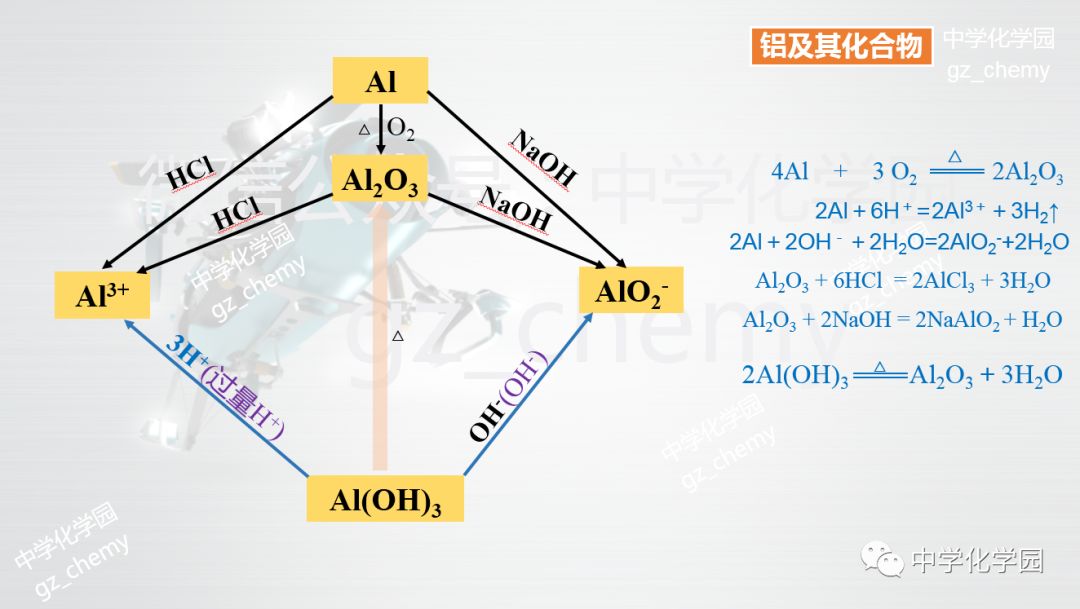
二、铝的化合物 1.Al2O3的性质 Al2O3俗名矾土,氧化铝是一种白色难溶物,其熔点很高,可用来制造耐火材料如坩锅、耐火管、耐高温的实验仪器等。 Al2O3是两性氧化物,既能与强酸反应,又能与强碱反应 Al2O3+ 6HCl====2AlCl3+3H2O (Al2O3+6H+====2Al3++3H2O) Al2O3+ 2NaOH====2NaAlO2+H2O (Al2O3+2OH-====2AlO2-+H2O) 2. 氢氧化铝Al(OH)3 氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。氢氧化铝可用来制备铝盐,作吸附剂等的原料。氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。 (1)Al(OH)3是两性氢氧化物,在常温下它既能与强酸,又能与强碱反应 Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH-=AlO2-+2H2O (2)Al(OH)3受热易分解成Al2O3 2Al(OH)3==加热==Al2O3+3H2O (3)Al(OH)3的制备 实验室用可溶性铝盐和氨水反应来制备Al(OH)3 Al2(SO4)3+6NH3·H2O=2 Al(OH)3↓+3(NH4)2SO4 (Al3++3NH3·H2O=Al(OH)3↓+3NH4+) 因为强碱(如NaOH)易与Al(OH)3反应,所以实验室不用强碱制备Al(OH)3,而用氨水。 附:铝及其化合物思维导图
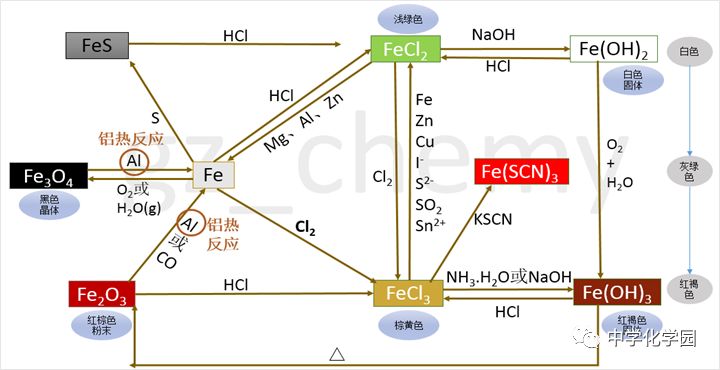
1.铁的氧化物的性质 FeO、Fe2O3都为碱性氧化物,能与强酸反应生成盐和水。 FeO+2HCl=FeCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O 铁的氧化物Fe3O4 Fe3O4+8HCl=FeCl2+2FeCl3+4H2O Fe3O4+8H+=Fe2++2Fe3++4H2O 2.铁的氢氧化物 氢氧化亚铁Fe(OH)2(白色)和氢氧化铁Fe(OH)3(红褐色) (1)制备 ①Fe(OH)2的制备 FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 Fe2++2OH-=Fe(OH)2↓ ②Fe(OH)3的制备 FeCl3+3NaOH=Fe(OH)3↓+3NaCl Fe3++3OH-=Fe(OH)3↓ 氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀) 4Fe (OH)2+O2+2H2O====4Fe(OH)3 (2)性质 ①都能与酸反应生成盐和水 Fe(OH)2+2HCl=FeCl2+2H2O Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+6HCl=2FeCl3+3H2O Fe(OH)3+3H+=2Fe3++3H2O ②Fe(OH)2可以被空气中的氧气氧化成Fe(OH)3 4Fe(OH)2+O2+2H2O=4Fe(OH)3(现象 ③Fe(OH)3受热易分解生成Fe2O3 2Fe(OH)3==加热==Fe2O3+3H2O 3.铁盐(铁为+3价)、亚铁盐(铁为+2价)的性质 (1)铁盐(铁为+3价)具有氧化性,可以被还原剂(如铁、铜等)还原成亚铁盐 2FeCl3+Fe=3FeCl2 (2Fe3++Fe=3Fe2+)(价态归中规律) 2FeCl3+Cu=2FeCl2+CuCl2 (2Fe3++Cu=2Fe2++Cu2+)(制印刷电路板的反应原理) 亚铁盐(铁为+2价)具有还原性,能被氧化剂(如氯气、氧气、硝酸等)氧化成铁盐 2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2Fe3++2Cl-) (2)Fe3+离子的检验 a.溶液呈黄色; b.加入KSCN(硫氰化钾)溶液变红色; c.加入NaOH溶液反应生成红褐色沉淀[Fe(OH)3]。 Fe2+离子的检验 a.溶液呈浅绿色; b.先在溶液中加入KSCN溶液,不变色,再加入氯水,溶液变红色; c.加入NaOH溶液反应先生成白色沉淀,迅速变成灰绿色沉淀,最后变成红褐色沉淀。
|
【本文地址】
今日新闻 |
推荐新闻 |

 返回搜狐,查看更多
返回搜狐,查看更多