杨锦陈博士:脑神经反馈训练的科学性与有效性 |
您所在的位置:网站首页 › 陈湛哈佛大学博士 › 杨锦陈博士:脑神经反馈训练的科学性与有效性 |
杨锦陈博士:脑神经反馈训练的科学性与有效性
|
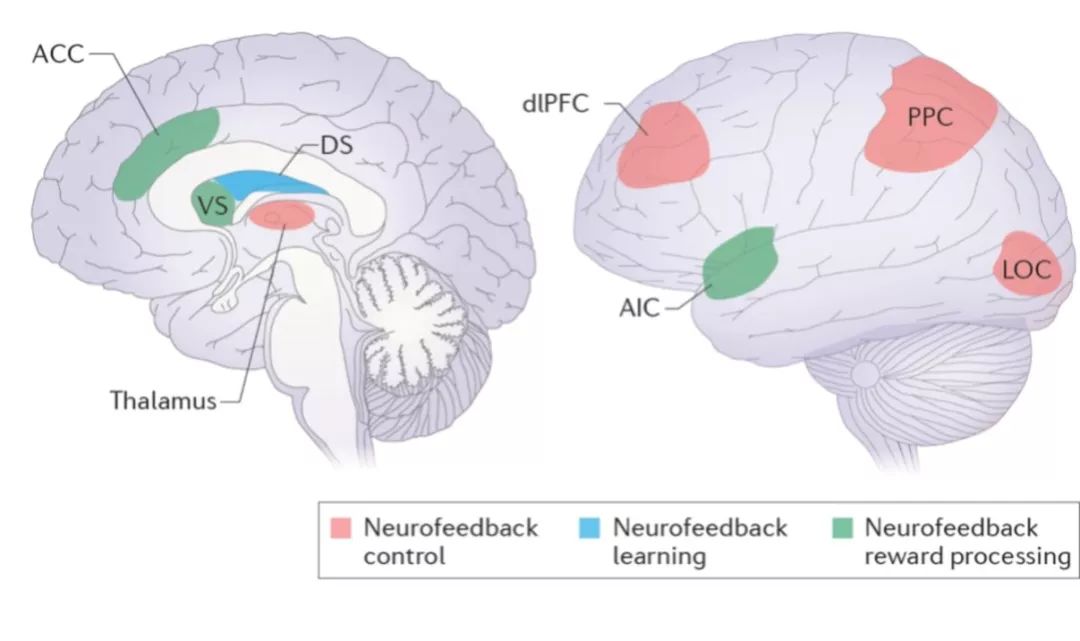
不过,这一项对于伦敦出租车司机的著名研究,是在学习和经验改变了大脑结构之后的一个事后确认。日常生活中,学习的过程 (如教与学,练习与考试) 仍然是纯粹行为层面的。大脑在整个学习过程中依旧是一个黑盒子。学习和经验输入大脑后,我们能看到的输出只是语言和行为,而这其间发生的大脑的各种加工和变化,绝大部分是隐藏在我们的颅骨之内不为人知的。换句话说,学习 (不单单是课堂学习) 这件事,长久以来都不是一个闭环系统,大脑部分的反馈信息是缺位的 (Sitaram et al, 2017)。随着脑成像技术的发展、神经科学基础研究和临床研究的深入,科学家开始尝试将大脑在学习和思考时的相关神经信号提取出来,并实时反馈给大脑,建立起学习与经验的闭环系统,以提升学习效率或纠正学习过程中的错误。这一方向尝试的成果,就是神经反馈训练技术。 神经反馈训练技术,是基于脑科学和行为科学学习理论发展起来的一种安全、非侵入式的改善大脑功能和结构的方法。恰当运用神经反馈训练,可以有效提升大脑功能或者治疗脑疾病引起的脑功能损伤。具有临床意义的脑电波神经反馈训练技术,是加州大学洛杉矶分校的 Sterman 教授在1968提出的。经过半个世纪的发展,神经反馈训练领域进行了大量的基础研究和临床试验,在提升认知能力和任务绩效、治疗注意缺陷与多动综合症 (ADHD,俗称多动症)、自闭症、认知老化等方面都积累了大量证据、取得了许多成果。随着人工智能时代的到来,神经反馈训练的算法变得更加精准强大,硬件技术的发展也使得可穿戴装脑电波设备的信号精度和便利性都得到极大提高,而成本则大幅下降。 使用最为广泛并得到临床应用的神经反馈训练,是基于脑电波的神经反馈训练。脑电波主要是来源于脑神经细胞的突触后电位。脑电波测量的是头皮上电压 (不是电流) 的变化, 是对神经突触活动无创式的在体记录 (Nunez, 2006)。对记录到的脑电波进行频谱分析,就分解成为我们熟悉的脑电波频率波段:delta波 (0-4 Hz赫兹),theta波 (4-7 Hz),alpha波 (8-12 Hz),beta波 (12-30 Hz),和gamma波 (> 30 Hz)。颅外记录的可用脑电波信号,主要是delta到beta波之间。Gamma波受到颅骨过滤模糊、交流电频率和肌电等噪音的影响,一般不用于颅外脑电波数据分析和算法开发。 01. 神经反馈训练简史及科学原理 神经反馈训练的具体做法,是对与特定功能相关的脑神经活动 (比如beta波的波幅) 进行测量,并将测量结果以视觉、听觉、触觉等方式实时反馈给受训练者,通过一定的训练手段 (如奖励机制),帮助受训练者学会对目标脑神经活动进行自主调节和改善。目标脑神经活动的改善,会使得对应的脑功能得到修复或提升。正如举铁是健身增加肌肉的手段,神经反馈训练就是一种健脑的手段。 神经反馈训练技术的基础,是神经科学和行为科学的三个重要发现:德国科学家汉斯伯格在1924年首次记录到的脑电波、俄国诺贝尔获奖者巴甫洛夫在19世纪末提出的经典条件反射理论、以及美国行为主义大师斯金纳1938年提出的操作性条件反射理论。神经反馈训练的过程,是通过对脑电波的自我调节情况 (成功与否) 给予及时的反馈/奖赏,形成学习效应,并通过神经可塑性,改善或加强神经环路的连接与效率,最终在行为和功能上得到改善/提升。 神经反馈训练技术的发明,其实有一定的偶然性。1968年,神经反馈训练的先驱 Sterman 教授为了研究睡眠,在UCLA医学院的实验室里给实验猫的大脑皮层植入了记录电极,然后训练这些猫根据灯光和音乐声来做出判断是否应该按下按钮得到小零食奖励。结果发现,当猫判断出不应该按按钮并静静等待的时候,他们大脑的感觉运动皮层出现了一种很强的脑波,频率在13 Hz左右,Sterman教授把这种波命名为“感觉运动波” (sensorimotor rhythm, SMR)。接下来,他们进行了神经反馈训练领域开创性的一个实验。在这个实验中,猫只有在它的大脑产生很强的SMR波的时候,才能得到食物奖励;如果只是身体保持静止但大脑的SMR波没有达到阈值,就不能得到食物奖励。经过2到4个星期的训练,这些实验猫都学会了通过自我调节SMR脑波来得到食物——它们是通过“得到食物”和“得不到食物”这两种“反馈”,学会了“产生SMR波—得到小零食”这一“技能”链条。这项研究1970年发表于著名的《科学》杂志。随后,Sterman教授接到一个看似与SMR无关的项目:测试火箭燃料甲基肼会不会引发癫痫,结果意外发现经过之前的脑电波神经反馈训练的猫,对于甲基肼导致的癫痫有很强的抵抗力。甲基肼实验开启了神经反馈训练技术的第一个临床应用——癫痫的干预治疗。 这些在实验猫上得到的发现,很快也在实验猴身上得到了重复验证。其他许多研究者的工作,也证明动物和人都能够自我调控单个神经细胞的活动以及脑电波特定频段的变化 (Sitaram, 2017, Nature Review Neuroscience)。例如,2014年《自然 ∙ 神经科学》杂志发表的一项研究发现 (Clancy 2014),大鼠可以通过听觉反馈学会自主调控神经细胞钙离子的活动 (神经细胞之间主要是通过钙、钠、氯等离子的流动来进行信号传递,产生神经冲动和脑电波变化)。这类控制可以达到惊人的精度,比如大鼠可以通过反馈训练学会增加运动皮层中一个特定神经元的放电频率,并且降低这个神经元周围其它神经元的活性 (Koralek 2012, 2013)。偏瘫病人则可以通过反馈训练使用自己大脑初级运动皮层的活动来控制机械臂、电脑鼠标,或者对自己的肌肉进行自主刺激式的康复训练 (Collinger 2013, Hochberg 2006, Bouton 2016)。从细胞分子机理上来看,神经反馈训练的神经可塑性与经典学习过程是相似的。例如,通过抑制大脑基底核神经递质谷氨酸NMDA受体的功能,研究人员成功抹除了小鼠神经反馈训练的成效 (Koralek 2012),而激活NMDA受体是学习过程中神经元协同放电的主要机理之一。需要特别指出的是,神经反馈训练所促进的学习主要是内隐学习,所以外显的认知策略并非是必需的 (Koralek et al, 2012, Nature; Ramot et al, 2016 PNAS)。 更为关键的是,对特定神经活动的训练,会导致与之对应的特定高级认知能力的提升。斯坦福大学研究者 Schafer 和 Moore 2011年在《科学》发表研究,证明恒河猴可以通过听觉视觉结合的神经反馈训练,学会自主改变前额叶神经元的发放频率和局部脑电波LFP,并发现这种改变直接影响的是大脑自上而下的选择性注意功能,可以增强视觉神经元对感受野内目标任务的选择能力。这样的研究从细胞层面证明了神经反馈训练可以针对性地改善特定的高级认知能力,为神经反馈训练在多动症等注意力训练领域的应用提供了直接而且强大的科学依据。 需要特别强调指出的是,这一小节里面提到的研究都是基于侵入式大脑记录方法的动物实验或者病人案例。这一类侵入式/有创 (invasive) 的研究只是用来研究神经反馈和脑机接口技术的科学原理。真正能够应用到我们日常生活和学习中的神经反馈训练,是基于无创/非侵入式 (noninvasive) 的大脑功能记录的手段,比如脑电波EEG、功能核磁共振和近红外光谱成像 (fNIRS) 等。 02. 神经反馈训练在普通人群中的有效性 使用大样本 (N = 523) 的一项研究发现,成年人平均只需要1分钟就能学会对脑电波强度的自我调节 (Kovacevic et al, 2016, Plos One)。神经反馈训练对于改善普通人群的认知能力、情绪调节等方面的有效性得到了各国研究者们多项设计严谨的研究的支持。《科学》杂志发表的一项早期研究 (Beatty et al, 1974) 对一组19个大学生大脑枕叶 (后脑) 的theta波进行反馈训练,然后用模拟雷达探测器测试他们的信号检测能力。结果发现,通过训练降低theta波之后,被试的视觉探测能力上升;增强theta波则降低了视觉探测能力。 上世纪90年代,美国宇航局NASA的研究人员Alan Pope等人开始使用脑电波神经反馈训练来提升宇航员的工作效率。他们在2002年发表的一项研究中,使用了虚假反馈作为安慰剂对照组,发现使用基于alpha波、beta波和theta波的神经反馈训练的训练组,专注力更高、在NASA的作业测试中表现更好、认知负担更低 (Prinzel et al., 2002)。2004年一项英国的研究发现,基于SMR的神经反馈训练可以提高知觉敏锐性,对beta波的反馈训练则提升了注意力和反应速度 (Egner & Gruzelier, 2004)。另一项使用严格的对照组设计的实验中,德国研究者发现SMR训练能够提升反应速度和视觉加工能力 (Doppelmayr & Weber, 2011)。同样使用严格的虚假反馈对照组,一项来自台湾的研究发现,额叶theta波的反馈训练能够改善老年人的注意力和工作记忆,对年轻人群则能提高大脑的执行功能 (Wang & Hsieh, 2013)。 那神经反馈训练能否像经典学习行为一样长期改变人类大脑的结构?答案是肯定的。核磁共振扫描发现,经过一个星期的额叶-顶叶beta波神经反馈训练,大脑灰质体积增加,白质通路的连通性提升 (Ghaziri, 2013)。Megumi等 (2015) 通过神经反馈训练成功建立了顶叶外侧区 (lateral parietal cortex) 和初级运动皮层之间新的功能连接,并发现这种功能连接可以保持至少两个月 (所谓功能连接,是指同一个任务中,不同的脑区之间形成的同步变化协同工作的网络)。一项有安慰剂对照组的前额叶beta波神经反馈训练研究,发现beta波的改变甚至能保持至少3年 (Engelbregt, 2016)。 Emmert 等2016年分析了12项功能核磁共振研究,发现神经反馈训练涉及到的脑区包括岛叶前皮层(AIC)、扣带前回 (ACC)、前额叶背外侧区 (dlPFC)、前额叶腹外侧区、下顶叶 (IPL),基底神经节、以及丘脑 等。其中前额叶对神经反馈训练起着特别重要的作用 (Auer et al, 2018)。神经反馈训练在大脑层面的神经可塑性,一个重要表现就是脑区功能连接的改变。2016年发表于《自然》杂志的一项研究中,普林斯顿大学的一组科学家使用功能核磁共振对被试在一个持续性注意力任务中的表现进行实时监测,当被试注意力下降时,增加任务的难度作为反馈。经过2个小时的训练,实验组在持续性注意力任务中的表现显著优于虚假反馈对照组。该研究中最有效的神经反馈信号来自于额叶-顶叶注意力网络 (deBettencourt et al, 2016)。Ros等 (2013) 用EEG神经反馈训练来降低alpha波,与虚假反馈对照组相比,30分钟的训练增加了真实神经反馈训练组大脑的重要性/突显性网络 (salience network)内的功能连接,降低了大脑默认模式网络DMN内的功能连接,伴随的是被试在做任务时走神开小差的情况显著减少。而在一项使用脑电源定位方法的研究中,与虚假反馈对照组相比,神经反馈训练组成功提升了左脑语言区的激活水平 (Bauer & Pllana, 2014)。
Sitaram et al, 2017 03. 神经反馈训练对多动症和自闭症的有效性 脑电波神经反馈训练的临床应用,发端于癫痫干预,但逐渐在儿童大脑发育疾病领域,特别是注意缺陷与多动障碍综合症 (Attention-Deficit/Hyperactivity Disorder,ADHD,即多动症) 干预中得到了广泛的研究和应用 (Arns et al, 2013, Holtmann et al 2014, Cortese et al 2016)。神经反馈训练之所以被用于治疗多动症,是因为研究发现多动症人群的低频脑电波 (如delta波和theta波) 比正常同龄人显著增强。Theta波和beta波 (与认知加工关系密切) 强度的比例,是科学家发现的第一个对注意力水平敏感的脑电指标。基于二十多年的研究成果,美国儿科医学院在2012年出版的“儿童和青少年心理干预循证指南”中,将脑电波神经反馈训练作为多动症的一线疗法,将其证据支持力度评定为一级 (最强)。2013年,美国食品药品监督管理局FDA进一步批准了一个基于脑电波的诊断工具NEBA,用于辅助多动症的临床诊断。
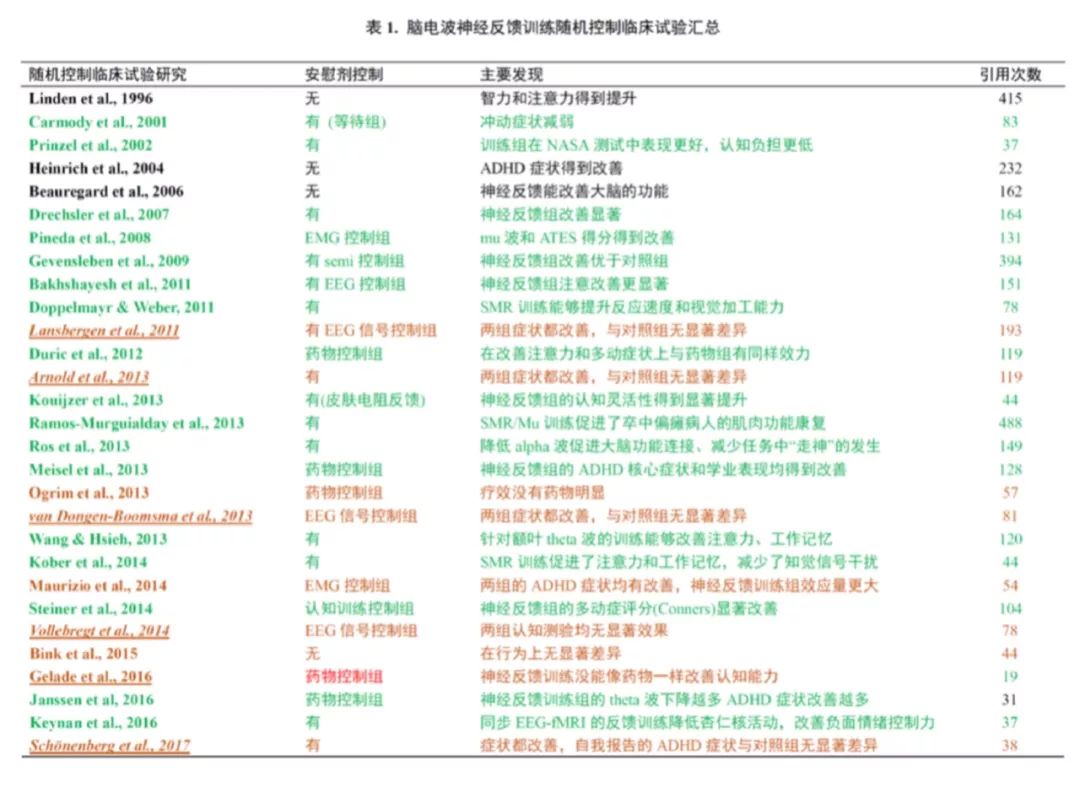
自闭症谱系障碍 (Autism Spectrum Disorder, ASD,即孤独症) 也是一种神经发育障碍,核心症状是社交和交流功能缺陷。部分自闭症患者终生无法独立生活,需要长期的照护,对家庭和社会影响很大。自闭症人群的脑电波也存在异常,主要表现为功能连接异常 (局部区域神经连接偏多,而跨区域远距离的功能连接偏少) 和反映镜像神经元系统的mu 波异常(mu rhythm, 产生于感觉运动皮层,频率8-13 Hz)。Mu波与人的社交功能紧密相关,具体而言,与动作意图理解、模仿能力、同情心、心理理论 (Theory of Mind) 等密切相关。自2008年起,已经有多项临床试验 (包括有随机双盲设计的) 发现基于mu波的自闭症神经反馈训练能改善自闭症症状、促进自闭症儿童的社交功能和注意力。 多动症和自闭症目前都没有药物可以治愈。6岁以上的多动症患者可以通过服用中枢神经刺激药物哌甲酯等来控制症状,但有30%的孩子和比例更高的成年患者服用药物没什么效果。针对自闭症的核心症状即社交和语言问题,目前没有针对性的药物,只有对自伤等次级症状才有一些中枢神经药物可用,但通常副作用比较大。因此,像神经反馈训练这样的非药物治疗手段,一直是医生和科学家在努力开发和改进的一个方向。 神经反馈训练技术针对的对象,是高度复杂的人类智能和脑疾病,有许多变量会影响神经反馈训练的效果。随着研究的深入和应用的拓展,对于这项技术的有效性的争论也不断出现。尽管绝大部分的研究都发现,经过1-3个月的神经反馈训练多动症的症状或者注意力测验的分数都得到了改善和提高,仍有一些研究者通过实验研究或者综述分析已发表的研究,对神经反馈训练的有效性提出了质疑。批评者指出,一些神经反馈训练临床试验没有严格的控制条件做对比,其中最核心的问题在于,不少研究即使有随机对照组,但对照组接受的干预与神经反馈训练的区别通常比较明显,因此受训练者、治疗师和家长都知道实验组和对照组在接受不同的干预。如此一来,实验组取得的干预效果,很可能是由于安慰剂效应 (placebo effect) 导致的。根据美国国立健康研究院NIH补充与整合医学中心NCCIH的定义,安慰剂效应是指当人期待他所接受的医疗干预 (如服药、做手术、打针) 会有帮助时,由这种期待所产生的健康方面的有益的结果。在过去二三十年的研究中,有一些使用了模拟EEG信号或者肌电信号等安慰剂控制组的试验研究没能发现实验组和对照组在训练后有显著区别,所以批评者就将神经反馈训练的效果都归结于安慰剂效应。 然而很多阴性研究 (即没发现神经反馈优于安慰剂的研究),是存在一些实验设计或者数据分析方面的缺陷的。比如2017年在《柳叶刀-精神病学》杂志发表的一篇研究中,德国的一组研究者用theta/beta波的比例、虚假EEG和团体认知行为疗法对每组近40个成年多动症患者 (18-60岁) 进行了为期15个周的干预,结果发现神经反馈训练组的效果与另外两组没有区别。一个实验设计的缺陷是,这项研究里面的虚假EEG对照组只在试验的前半段使用了他人的EEG数据作为反馈,而在后半段就接受了基于被试自己的实时EEG信号的真实反馈,所以这个虚假对照组只有50%的纯度。如果只看试验前半段的结果,神经反馈训练组在所有四项多动症的量表得分上,都是症状最轻的,所以前半程结果其实是支持神经反馈训练的有效性的。就算是前半程和后半程试验混在一起统计,他们的结果显示神经反馈训练也和认知行为疗法的疗效对等, 而认知行为疗法是心理科和精神科广为接受的方法。还需指出的是,该研究的对象是18岁到60岁的成年人,而绝大部分多动症脑电波神经反馈的研究是在儿童和青少年人群中做的。年龄越小,神经可塑性越大,因此年龄差异也必须予以考虑。其它阴性研究中常出现的实验设计方面的问题,包括反馈任务缺乏功能意义、使用的神经反馈方法不一致 (如训练的波段和脑区因人而异)、被试群体的异质性高、认知策略的使用不一致、年龄跨度大 (EEG数据的异质性增加)、以及训练时间不够长 (如试验进行到一半就终止了) 等等。 进一步对目前发表的有随机对照组的临床试验研究进行详细汇总分析 (表. 1),可以看到,在29项有随机对照组的试验中 (其中多动症 20 项,自闭症 2 项,普通人群 6 项,卒中偏瘫病人 1 项),有20项研究结果 (69%, 绿色字体) 支持神经反馈训练的有效性。有更严格的安慰剂对照组的研究中,有17项支持神经反馈训练的有效性。在5 项没有发现神经反馈训练优于对照组的研究中 (红色斜体),有 4 项都发现神经反馈训练后多动症症状得到了改善,但作者将改善的原因归结于安慰剂效应。
即使存在安慰剂效应,也不能说明神经反馈训练就是无效的。首先,如上表所列,大部分的随机对照组研究是支持神经反馈训练的有效性的,基于几项阴性研究结论 (Negative results) 就否定神经反馈训练的有效性,是不严谨不客观的。其次,如哈佛大学医学院教授Ted Kaptchuk指出,安慰剂效应是通过大脑产生的一种能影响大脑的生理和功能的真实机制。安慰剂效应不仅仅是相信治疗会起作用的一种积极思维,而且是由于身体和大脑之间建立了更强的联系,让大脑和身体更好地协同工作 (https://www.health.harvard.edu/mental-health/the-power-of-the-placebo-effect)。一般而言,在传统药物临床试验中,得到安慰剂效应等同于说该药物没有效果。但近年来,随着对安慰剂效应的神经机制研究的深入,安慰剂效应被发现是一种真实的生理心理现象,甚至被当作一种非药物的治疗机理。例如,英属哥伦比亚大学的Fuente-Fernandez等人2001年在《科学》杂志发表的研究,证明了安慰剂效应会导致帕金森病人的纹状体释放大量的多巴胺,而帕金森的主流疗法也是通过药物来增加体内多巴胺的水平。 对于神经发育脑疾病如多动症、自闭症和退行性神经疾病 (如帕金森症),认知干预是重要且有效的手段。认知干预、认知训练或者心理治疗,都需要病人/被试的有意识的参与。所有的认知训练,都需要从受训练者理解和跟随指令及规则开始,不可避免会涉及到受训练者的自我控制感、预期、动机、策略等心理因素。Kaptchuk教授2014年发表在《科学-转化医学》的论文所发现的,偏头痛病人在明知道自己吃的是安慰剂的情况下,光是“吃药”这个“仪式”,仍然能减轻头痛,而且减轻的程度是服用真正药物的50% (Kam-Hansen et al, 2014)。所以可以比方,神经反馈训练中的各种心理因素,就像是偏头痛病人的“吃药”这个“仪式”,如果神经反馈训练能够成功改变目标脑电波指标并带来相应的行为改善,那么安慰剂效应也会叠加上去,导致总和的训练效果更强一些。因此,近来有专家提出,安慰剂效应是神经反馈训练难以分离的一部分,应该在此基础上增强神经反馈的有效性 (Thibault & Raz 2017)。 04. 脑电波神经反馈训练的独特优势 脑电波神经反馈训练是目前唯一在临床上得到广泛应用的神经反馈训练手段,其它的手段都还处于实验研究阶段。和实验性的神经反馈训练技术相比,脑电波有其突出的优势。 首先,脑电波的时间分辨率是所有非侵入式脑记录手段里最高的,达到1毫秒左右,因而是对脑神经电活动的实时记录。而功能核磁共振和近红外光谱成像技术所使用的血液动力学反应,反映的是神经活动的代谢需要,信号速度比较慢,任务开始之后5秒左右血氧变化才能达到峰值。更为重要的是,脑电波信号来源于突触周围的电位变化,是对神经突触活动的直接的记录 (Nunez, 2006),而突触活动的变化是学习与记忆的最根本机制 (Kennedy, 2013),因此适当的脑电波指标应该是对于认知能力改变 (要么是由训练和干预提升,要么是受到疾病的损伤) 最为灵敏的测量 (Cook, 1996; Olichney et al., 2010; Gouw, 2017)。对脑电波和对应脑功能的研究已经有近百年的历史,功能核磁共振和功能近红外成像则都出现了不到30年。 最后,便携式甚至可穿戴式的脑电设备已经商业化,但功能核磁共振和脑磁图MEG,都只能把庞大的仪器放在专门的实验间,无法大量用于教育场景、家庭场景等,让更多人受益。麻省理工大学Karydis等人2015年使用机器学习算法,成功示范了可穿戴脑电设备可用于区分“痛”与“不痛”两种心理状态。加拿大Rotman研究所的科学家们则使用可穿戴脑电设备,在一个沉浸式视听环境中成功进行神经反馈训练,一晚上 (12个小时) 就采集了523人的训练数据。这一类使用可穿戴脑电设备的高质量研究正越来越多。 结 语 综上所述,经过半个世纪的研究和应用,神经反馈训练的效果,正如Witte等人2018年在著名临床脑科学杂志《大脑》(Brain) 发文指出的:“有噪音,但并非安慰剂”。随着人工智能技术的发展,神经反馈训练的算法大大改进,可穿戴设备变得可靠而方便,成本也大幅度下降,基本终结了传统神经反馈训练存在的费时费事费钱的症结 (如需要每小时花200美元到专门的诊所戴上多个涂抹导电膏的有线电极)。作为有大量科学证据支持,无需服用药物、无需接受电磁刺激,更不需要做手术的安全无创的脑神经训练手段,在人工智能浪潮助力的精准医疗时代,一定会得到更大的发展,造福更多的人。具体而言,通过特定脑电波与特定心智功能的更精准匹配,和特定反馈训练任务的精准化设置,神经反馈训练将变得更有效果,成为脑功能康复和提升的重要手段。
作者简介 杨锦陈,BrainCo 脑科学家,认知心理学博士。先后在加州大学戴维斯分校和哈佛大学医学院从事脑疾病的认知神经科学研究近10年,在Annals of Neurology,Neuropsychopharmacology, Cerebral Cortex (第一作者或通讯作者) 等杂志发表学术论文26篇,H-index 12。曾任 Journal of Psychophysiology 副主编。 参考文献 1. Arnold et al.(2013) EEG neurofeedback for ADHD: double-blind sham-controlled randomized pilot feasibility trial.J Atten Disord, 17, 410-419 2. Arns, M. et al.(2014) Evaluation of neurofeedback in ADHD: the long and winding road. Biol. Psychol. 95, 108–115. 3. Auer et al.(2018)Higher-order brain areas associated with real-time functional MRI neurofeedback training of the somato-motor cortex. Neuroscience, 378 (2018), 22-33 4. Bakhshayesh et al. (2011) Neurofeedback in ADHD: a single-blind randomized controlled trial. Eur Child Adolesc Psychiatry 20:481–491 5. Bauer et al.(2014). EEG-based local brain activity feedback training - tomographic neurofeedback. Front. Hum. Neurosci. 8:1005. 6. Beatty et al.(1973) Operant control of occipital theta thythm affects performance in a radar monitoring task. Science 183, 871–873. 7. Beauregard et al. (2006) Functional magnetic resonance imaging investigation of the effects of neurofeedback training on the neural bases of selective attention and response inhibition in children with attention-deficit/hyperactivity disorder. Appl Psychophysiol Biofeedback 31:3–20 8. Bink et al. (2015) Behavioral effects of neurofeedback in adolescents with ADHD: a randomized controlled trial. Eur Child Adolesc Psychiatry, 24, 1035-1048. 9. Bouton et al. (2016) Restoring cortical control of functional movement in a human with quadriplegia. Nature 533, 247–250 10. Carmody et al. (2001) EEG biofeedback training and Attention-Deficit/Hyperactivity Disorder in an elementary school setting. Journal of Neurotherapy, 4, 5-27 11. Clancy et al. (2014) Volitional modulation of optically recorded calcium signals during neuroprosthetic learning. Nat. Neurosci. 17, 807–809 12. Collinger et al.(2013) High-performance neuroprosthetic control by an individual with tetraplegia. Lancet 381, 557–564 13. Cook et al. (1996) Synaptic dysfunction in Alzheimer's disease: clinical assessment using quantitative EEG Behav Brain Res, 78, 15-23 14. Cortese et al. (2016). Neurofeedback for attention-deficit/hyperactivity disorder: meta-analysis of clinical and neuropsyhological outcomes from randomized controlled trials. J. Am. Acad. Child Adolesc. Psychiatry 55, 444–455. 15. Crabtree et al. (2014). Synaptic plasticity, neural circuits and the emerging role of altered short-term information processing in schizophrenia. Front. Synaptic Neurosci. 6:28. 16. deBettencourt et al. (2015). Closed-loop training of attention with real-time brain imaging. Nat. Neurosci. 18, 470–475 17. Doppelmayr et al. (2011). Effects of SMR and theta/beta neurofeedback on reaction times, spatial abilities, and creativity. Journal of Neurotherapy, 15(2), 115–129. 18. Drechsler et al. (2007) Controlled evaluation of a neurofeedback training of slow cortical potentials in children with ADHD. Behav Brain Funct, 3, 35. 19. Duric et al. (2012) Neurofeedback for the treatment of children and adolescents with ADHD: a randomized and controlled clinical trial using parental reports. BMC Psychiatry, 12, 107. 20. Egner et al.(2004).EEG Biofeedback of low beta band components: frequency-specific effects on variables of attention and event-related brain potentials Clinical Neurophysiology; 115: 131–139. 21. Emmert et al. (2015) Meta-analysis of real-time fMRI neurofeedback studies using individual participant data: How is brain regulation mediated? Neuroimage 124, 806–812. 22. Engelbregt et al.(2016) Short and long-term effects of sham-controlled prefrontal EEG-neurofeedback training in healthy subjects. Clin. Neurophysiol. 127, 1931–1937. 23. Friedrich et al. (2015). An effective neurofeedback intervention to improve social interactions in children with autism spectrum disorder. Journal of Autism and Developmental Disorders, 45(12), 4084–4100. 24. Fuente-Fernandez et al. (2001) Expectation and dopamine release: mechanism of the placebo effect in Parkinson's disease. Science 293:1164–66 25. Gelade et al. (2016) An RCT into the effects of neurofeedback on neurocognitive functioning compared to stimulant medication and physical activity in children with ADHD. Eur. Child Adolesc. Psychiatry http://dx.doi.org/10.1007/s00787-016-0902-x 26. Gevensleben et al. (2009) Is neurofeedback an efficacious treatment for ADHD? A randomised controlled clinical trial.J Child Psychol Psychiatry, 50, 780-789 27. Ghaziri et al.(2013) Neurofeedback training induces changes in white and gray matter. Clin. EEG Neurosci. 44, 265–272. 28. Goodman et al(2018). A neurovisceral approach to autism: Targeting self-regulation and core symptoms using neurofeedback and biofeedback. NeuroRegulation 5(1):9–29. 29. Gouw et al. (2017) EEG spectral analysis as a putative early prognostic biomarker in nondemented, amyloid positive subjects. Neurobiol Aging; 57: 133–42 30. Heinrich et al. (2004) Rothen berger Training of slow cortical potentials in attention-deficit/hyperactivity disorder: evidence for positive behavioral and neurophysiological effects. Biol Psychiatry, 55, 772-775. 31. Hochberg et al. (2006) Neuronal ensemble control of prosthetic devices by a human with tetraplegia. Nature 442, 164–171. 32. Holtmann et al. (2014)Neurofeedback for ADHD: a review of current evidence. Child Adolesc Psychiatr Clin North Am, 23, 789-806 33. Janssen et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. J. Child Psychol. Psychiatry57, 633–644 (2016). 34. Kam-Hansen et al. (2014) Altered placebo and drug labeling changes the outcome of episodic migraine attacks. Sci. Transl Med. 6, 218ra5 35. Kaptchuk T (2017). The power of the placebo effect. health.harvard.edu/mental-health/the-power-of-the-placebo-effect 36. Karydis et al(2015). Performance characterization of self-calibrating protocols for wearable EEG applications. In Proceedings of the 8th ACM International Conference on PErvasive Technologies Related to Assistive Environments, Corfu, Greece, 1–3 July 2015; ACM: New York, NY, USA, p. 38. 37. Karydis et al(2015). Self-calibrating protocols enhance wearable EEG diagnostics and consumer applications. Proceedings of the 8th ACM International Conference on Pervasive Technologies Related to Assistive Environments (Article No. 96), Corfu, Greece. 38. Kennedy (2013). Synaptic signaling in learning and memory. Cold Spring Harb. Perspect. Biol. a016824. doi: 10.1101/cshperspect.a016824 39. Keynan et al. ( 2016) Limbic activity modulation guided by functional magnetic resonance imaging‐inspired electroencephalography improves implicit emotion regulation. Biol Psychiatry 80: 490– 496 40. Kober et al. (2014) Wood Shutting down sensorimotor interference unblocks the networks for stimulus processing: an SMR neurofeedback training study Clin. Neurophysiol. 10.1016/j.clinph.2014.03.031 41. Koralek et al. (2012) Corticostriatal plasticity is necessary for learning intentional neuroprosthetic skills. Nature 483, 331–335 42. Koralek et al. (2013) Temporally precise cell-specific coherence develops in corticostriatal networks during learning. Neuron 79, 865–872. 43. Kouijzer et al. (2013) Is EEG-biofeedback an effective treatment in autism spectrum disorders? A randomized controlled trial. Applied Psychophysiology and Biofeedback, 38, 17–28 44. Kovacevic et al. (2015). ‘virtual dream’: collective neurofeedback in an immersive art environment. PLoS ONE 10:e0130129. 45. Lansbergen et al. (2011) ADHD and EEG-neurofeedback: a double-blind randomized placebo-controlled feasibility study. J Neural ansm, 118, 275–284 46. Linden et al. (1996) A controlled study of the effects of EEG biofeedback on cognition and behavior of children with attention deficit disorder and learning disabilities. Biofeedback Self Regul, 21, 35-49. 47. Maguire et al. (2000) Navigation-related structural change in the hippocampi of taxi drivers. Proc. Natl. Acad. Sci. USA, 97, 4398-4403 48. Maurizio et al. (2014) Comparing tomographic EEG neurofeedback and EMG biofeedback in children with attention-deficit/hyperactivity disorder. Biol Psychol, 95, 31-44 49. Meisel et al. (2013) Neurofeedback and standard pharmacological intervention in ADHD: a randomized controlled trial with six-month follow-up. Biol Psychol, 94, 12–21 50. Megumi et al. (2015) Functional MRI neurofeedback training on connectivity between two regions induces long-lasting changes in intrinsic functional network. Front. Hum. Neurosci. 9, 160. 51. Nunez et al. (2006) Oxford University Press, Electric fields of the brain: the neurophysics of EEG (2ndEd.). New York, pp163-166. 52. Oberman et al. (2005). EEG evidence for mirror neuron dysfunction in autism spectrum disorders. Cognitive Brain Research, 24, 190–198. 53. Ogrim et al.(2013) Effects of neurofeedback versus stimulant medication in attention-deficit/hyperactivity disorder: a randomized pilot study. J Child Adolesc Psychopharmacol; 23, 448–57. 54. Olichneyet al.(2011). Cognitive Event-Related Potentials: Biomarkers of Synaptic Dysfunction Across the Stages of Alzheimer’s Disease. Journal of Alzheimers Disease26 (Suppl 3): 215-228. 55. Othmer (2016). History of neurofeedback. IN H. W. Kirk(Ed.), Restoring the brain: Neurofeedback as an integrative approach to health(pp. 23–50). Boca Raton, FL: Apple Academic Press. 56. Pineda et al. (2008) Positive behavioral and electrophysiological changes following neurofeedback training in children with autism. Research in Autism Spectrum Disorders, 2, 557–581. 57. Pineda et al. (2014). Neurofeedback training produces normalization in behavioural and electrophysiological measures of high-functioning autism. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 369, 20130183. 58. Pope et al.(1995). Biocybernetic system evaluates indices of operator engagement in automated task. Biol. Psychol. 40, 187–195 59. Prinzel et al. (2002) Physiological Self-Regulation and Adaptive Automation. The International Journal of Aviation Psychology, 12:2, 179-196 60. Ramos-Murguialdayet al. (2013) Brain–machine interface in chronic stroke rehabilitation: a controlled study. Ann. Neurol. 74, 100–108. 61. Ramot et al.(2016). Covert neurofeedback without awareness shapes cortical network spontaneous connectivity. Proc. Natl Acad. Sci. USA 113, E2413–E2420 62. Ros et al. (2013) Mind over chatter: plastic up-regulation of the fMRI salience network directly after EEG neurofeedback. Neuroimage65, 324–335. 63. Schafer et al. (2011) Selective attention from voluntary control of neurons in prefrontal cortex. Science 332, 1568–1571 64. Schönenberg et al. (2017) Neurofeedback, sham neurofeedback, and cognitive-behavioural group therapy in adults with attention-deficit hyperactivity disorder: a triple-blind, randomised, controlled trial. Lancet Psychiatry, 4, 673-684 65. Steiner et al. (2014) In-school neurofeedback training for ADHD: sustained improvements from a randomized control trial. Pediatrics, 133, 483–492. 66. Sterman et al. (1970). Facilitation of spindle-burst sleep by conditioning of electroencephalographic activity while awake. Science 167:1146–1148. 67. Sterman et al. (1976). Effects of brain surgery and EEG operant conditioning on seizure latency following monomethylhydrazine intoxication in the cat. Exp Neurol 50:757–765. 68. Sterman et al. (1978). Effects of sensorimotor EEG feedback training on seizure susceptibility in the rhesus monkey. Exp Neurol 62(3):735–747. 69. Sitaram et al. (2017) Closed-loop brain training: the science of neurofeedback. Nat. Rev. Neurosci., 18, 86-100 70. Thibault et al. (2017) The psychology of neurofeedback: Clinical intervention even if applied placebo. American Psychologist, 72, 679-688. 71. van Dongen-Boomsma et al. (2013) A randomized placebo-controlled trial of electroencephalographic (EEG) neurofeedback in children with attention-deficit/hyperactivity disorder. J Clin Psychiatry, 74, 821-827. 72. Vollebregt et al. (2014) Does EEG-neurofeedback improve neurocognitive functioning in children with attention-deficit/hyperactivity disorder? A systematic review and a double-blind placebo-controlled study.J Child Psychol Psychiatry, 55, 460-472 73. Wang et al. (2013) Neurofeedback training improves attention and working memory performance. Clinical Neurophysiology, 124, 2406–2420. 74. Witte et al. (2018). Noisy but not placebo: Defining metrics for effects of neurofeedback. Brain, 141, e40. 75. Wyrwicka W, Sterman MB. (1968). Instrumental conditioning of sensorimotor cortex EEG spindles in the waking cat. Physiol Behav 3(5):703–707.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |