常见的金属腐蚀形态及防护措施(一) |
您所在的位置:网站首页 › 防止电偶腐蚀的措施是什么 › 常见的金属腐蚀形态及防护措施(一) |
常见的金属腐蚀形态及防护措施(一)
|
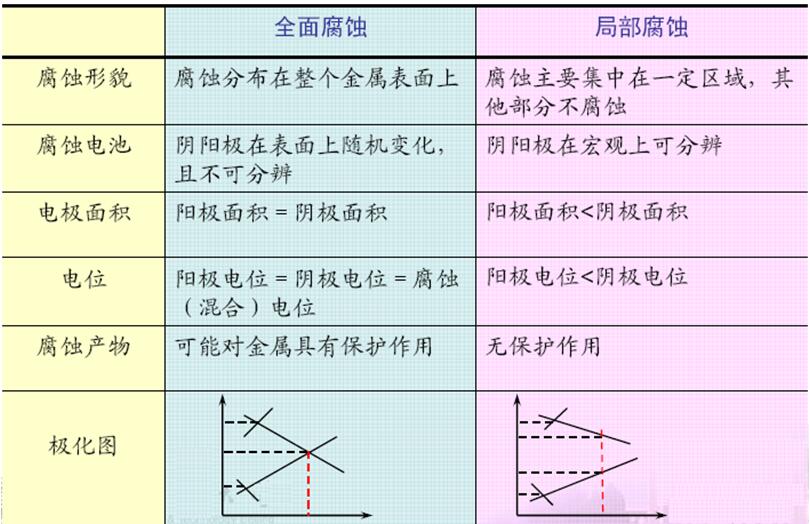
金属常见的腐蚀形态主要有全面腐蚀和局部腐蚀,全面腐蚀在整个金属表面上进行的腐蚀,又称均相腐蚀或均匀腐蚀,金属表面局部腐蚀破坏比其余表面大得多,从而形成坑洼、沟槽、分层等。 全面腐蚀——在整个金属表面上进行的腐蚀,又称均相腐蚀或均匀腐蚀。 局部腐蚀——金属表面局部区域的腐蚀破坏比其余表面大得多,从而形成坑洼、沟槽、分层、穿孔、破裂等破坏形态。 全面腐蚀与局部腐蚀的不同特征 ●全面腐蚀 --阴极和阳极尺寸非常微小且紧密靠拢,很难分辨 ● 局部腐蚀 --阴极和阳极截然分开,易于区分。通常阳极面积很小,阴极面积相对很大。 金属局部腐蚀溶解速度比全面腐蚀溶解速度大得多。 ●局部腐蚀危害性 (1)复杂性 (2)集中性 (3)突发性 ●局部腐蚀主要类型 电偶腐蚀 点蚀(孔蚀)缝隙腐蚀(丝状腐蚀) 晶间腐蚀 选择性腐蚀 应力腐蚀开裂腐蚀疲劳 磨损腐蚀剥蚀 氢损伤 发生局部腐蚀的条件 (1)金属方面或溶液方面存在较大的电化学不均一性,因而形成了可以明确区分的阳极区和阴极区。 (2)阳极区和阴极区的电化学条件差异在腐蚀过程中一直保持下去,不会减弱,甚至还会不断强化,使某些局部区域的阳极溶解速度一直保持高于其余表面。这是局部腐蚀能够持续进行(发展)的条件。
全面腐蚀与局部腐蚀的比较
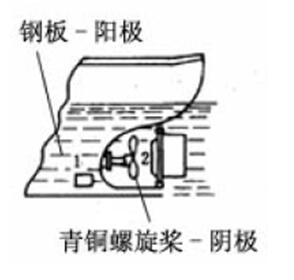
一、电偶腐蚀 当两种不同电位的金属相互接触,并浸入电解液中可以发现,电位较负的金属的腐蚀速度加大,而电位较正的金属腐蚀速度减缓而受到保护,该现象被称为电偶腐蚀
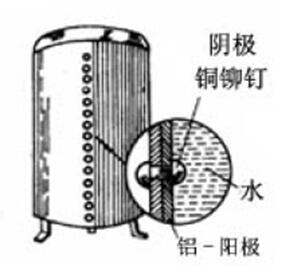
发生电偶腐蚀的几种情况 (1)异金属部件(包括导电的非金属材料,如石墨)组合。 (2)金属镀层。 (3)金属表面的导电性非金属膜。 (4)气流或液流带来的异金属沉积。 异金属部件(包括导电的非金属材料,如石墨) 组合 沿海硫酸厂,二氧化硫冷凝器事故 -列管和花板用石墨制作并和碳钢外壳连接 -SO2走管内,海水走管外 -使用半年后:外壳腐蚀穿孔 -碳钢外壳由于与石墨组成电偶而加速了腐蚀 黄铜零件+纯铜管 -黄铜成为阳极加速腐蚀 黄铜零件+镀锌管 -镀锌层先加速溶解后,碳钢管体才溶解 气流或液流带来的异金属沉积 特殊情况下的电偶腐蚀 -两种不同金属没有直接接触 -循环冷却系统中的铜零件 -腐蚀下来的铜离子通过扩散在碳钢设备表面沉积 -沉积的疏松铜粒子与碳钢之间形成微电偶腐蚀电池,引起碳钢设备严重的局部腐蚀 电偶腐蚀的特点 -在工程技术中,不同金属的组合是不可避免的,几乎所有的机器、设备和金属结构件都是由不同的金属材料部件组合而成,电偶腐蚀非常普遍。 -利用电偶腐蚀的原理可以采用贱金属的牺牲对有用的部件进行牺牲阳极阴极保护。 电偶腐蚀原理 当两种不同电位的金属相互接触,并浸入电解液中可以发现,电位较负的金属的腐蚀速度加大,而电位较正的金属腐蚀速度减缓而受到保护。
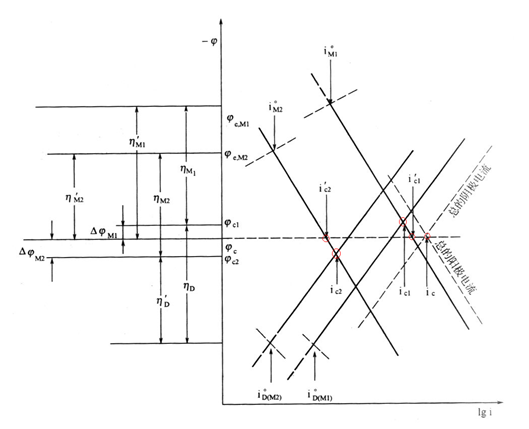
电偶腐蚀的影响因素 (1)腐蚀电位差。 (2)环境因素。 (3)阴阳面积比例。 (1)腐蚀电位差 —表示电偶腐蚀的倾向 两种金属在使用环境中的腐蚀电位相差愈大,阳极金属受到腐蚀破坏的可能性愈大。 电偶序(galvanic series) ——将各种金属材料在某种环境中的腐蚀电位测量出来,并把它们从低到高排列 注意:同一种电偶组合在不同环境条件中不仅腐蚀电位差的数值不一样,甚至可能发生极性反转。 电偶腐蚀腐蚀的推动力:接触金属的电位差 电动序 金属置于含有该金属盐的溶液中在标准条件下测定的热力学平衡电位。 实际腐蚀体系:非纯金属、杂质或合金、钝化膜---电动序并不适用 电偶序:实际金属或合金在特定介质中的实际电位(非平衡)的次序,不同介质中具有不同的电偶序。 一些工业金属和合金在海水中的电偶序
铂 金 石墨 钛 银 Chlorimet 3(62Ni,18Cr,18Mo) Hastelloy C (62Ni,17Cr,15Mo) 18-8Mo不锈钢(钝态) 18-8不锈钢(钝态) 11~30%Cr不锈钢(钝态) Inconel(80Ni,13Cr,7Fe)(钝态) 镍(钝态) 银焊药 Monel(70Ni,32Cu) 铜镍合金(60~90Cu,40~11Ni) 青铜 铜 黄铜
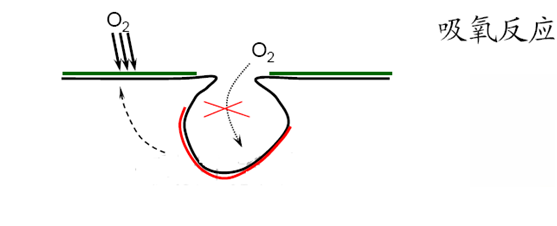
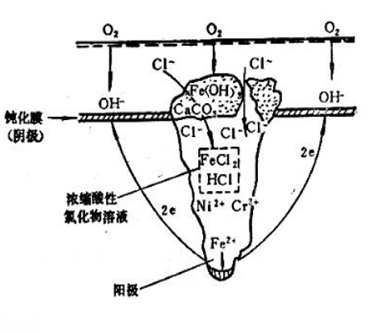
Chlorimet2(66Ni,32Mo,1Fe) Hastelloy B (60Ni,30Mo,6Fe,1Mn) Inconel(活态) 镍(活态) 锡 铅 铅-锡焊药 18-8钼不锈钢(活态) 18-8不锈钢(活态) 高镍铸铁 13%Cr不锈钢 铸铁 钢或铁 2024铝(4.5Cu,1.5Mg,0.6Mu) 镉 工业纯铝(1100) 锌 镁和镁合金 (2) 环境因素 -- 介质的组成 水中锡对于铁是阴极,而在多数有机酸中,锡对于铁是阳极,所以在食品工业中常使用镀锡铁(Fe-Sn) -温度: 影响腐蚀电流 改变金属表面膜或腐蚀产物结构 Zn-Fe:冷水中,Zn是阳极; 热水中(>80℃),Zn是阴极 钢铁镀锌后:热水洗温度Br->I- .这些阴离子在金属表面不均匀吸附易导致钝化膜的不均匀破坏,诱发点蚀。 3.点蚀发生在特定临界电位以上(点蚀电位或破裂电位Eb) .当E>Eb时,点蚀迅速发生和发展 .当Eb4OH- 氧扩散困难-缺氧
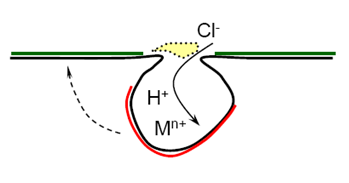
吸氧反应——孔内缺氧、孔外富氧——供氧差异电池 2.孔内金属离子浓度增加 吸引Cl-向内迁移:3~10倍; 金属离子水解:Mn+ + n(H2O) -> M(OH)n + nH+ 氢离子浓度升高,pH下降(2~3),孔内严重酸化
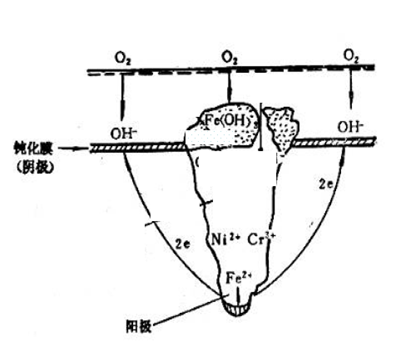
3.孔内介质:HCl,金属处于活化溶解态 孔外富氧:表面维持钝化态; ——活化(孔内)- 钝化(孔外)腐蚀电池,自催化 不锈钢在充气NaCl溶液中的孔蚀 .孔内反应:Fe->Fe2+ +2e Cr->Cr3+ +3e Ni-> Ni2+ +2e .孔外反应: O2+2H2O+4e -> 4OH- .阴阳极彼此分离,二次腐蚀产物在孔口形成,不起保护作用 Fe+ OH- -> Fe(OH)2 -> Fe(OH)3 多孔的蘑菇状,罩在蚀孔口
.孔口介质的pH逐渐升高,水中可溶性盐转化为沉淀: Ca(HCO3)2 → CaCO3 ↓ .锈层+垢层在孔口沉积 -> 形成闭寒电池 .孔内介质呈滞流状态 .溶解氧不易向内扩散 孔内金属难以钝化 .金属离子不易向外扩散 金属离子增加,氯离子迁入以维持电中性,形成氯化物(FeCl2)
.高浓氯化物水解,孔内酸度增加,促使阳极溶解加快 MCl2+2H2O -> M(OH)2 + 2H+ + 2Cl- . 孔内氯化物浓缩,进一步水解,酸度进一步增加(pH~0) .阳极加速溶解-蚀孔高速深化 .由于闭塞电池引起孔内酸化加速腐蚀的作用——自催化酸化作用 影响点蚀的因素 —————————————————— (1)材料因素 (2)环境因素 (1)材料因素 能够钝化的金属容易发生点蚀,故不锈钢比碳钢对点蚀的敏感性高。金属钝态愈稳定,抗孔蚀性能愈好。孔蚀最容易发生在钝态不稳定的金属表面。 ● 对不锈钢,Cr、Mo和N有利于提高抗点蚀能力。 另外,S、P、C等元素不利于提高抗孔蚀能力。 ● 表面状态:表面光滑和清洁不易发生点腐蚀 热处理状态:生成沉淀相,易发生点腐蚀 (2)环境因素 ●活性离子能破坏钝化膜,引发点蚀。 一般认为,金属发生点蚀需要Cl- 浓度达到某个最低值(临界氯离子浓度)。这个临界浓度可以作为比较金属材料耐蚀性能的一个指标,临界浓度高,金属耐点蚀性能好 。 ●缓蚀性阴离子 缓蚀性阴离子可以抑制点蚀的发生。 OH- > NO3- > SO42- > ClO4- · pH值 在较宽的pH值范围内,点蚀电位Eb与溶液pH值关系不大。当pH﹥10,随pH值升高,点蚀电位增大,即在碱性溶液中,金属点蚀倾向较小。 ·温度 温度升高,金属的点蚀倾向增大。当温度低于某个温度,金属不会发生点蚀。这个温度称为临界点蚀温度(CPT) ,CPT愈高,则金属耐点蚀性能愈好。 ·溶液流速 介质处于流动状态,点蚀速率比介质静止时小 |
【本文地址】
今日新闻 |
推荐新闻 |